11.1: Acilación de alcoholes y aminas
- Page ID
- 73269
La biocatálisis es una herramienta altamente eficiente y poderosa para que los químicos orgánicos preparen moléculas ópticamente puras. Ya se ha utilizado una amplia gama de métodos biocatalíticos para la fabricación a gran escala de productos intermedios de fármacos. Este módulo abarca algunos de los desarrollos recientes en la catálisis enzimática.
La resolución enzimática de alcoholes y aminas proporciona un método eficaz para acceder a alcoholes y aminas ópticamente activos a partir de sustratos racémicos o proquirales.
Reacciones con Alcoholes
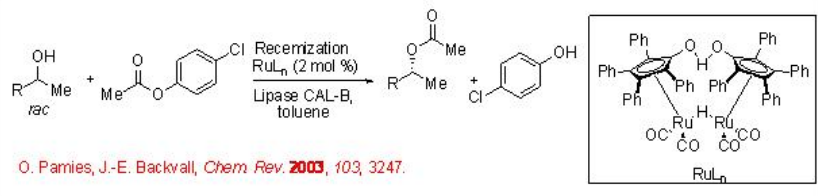
El uso de lipasa para la resolución de alcoholes racémicos es una tecnología ampliamente conocida. Sin embargo, este método le da al producto un rendimiento máximo de hasta el 50%. Esta limitación puede superarse acoplando la resolución enantioselectiva catalizada por lipasa con una racemización del sustrato alcohólico, obteniendo así un proceso de resolución cinética dinámica. Este último proceso puede perseguirse empleando un complejo metálico no quiral como catalizador. Por ejemplo, usando la combinación del complejo Ru y CAL-B, la acilación del alcohol racémico se puede lograr con 78-92% de rendimiento y 99% ee (Esquema\(\PageIndex{1}\)).
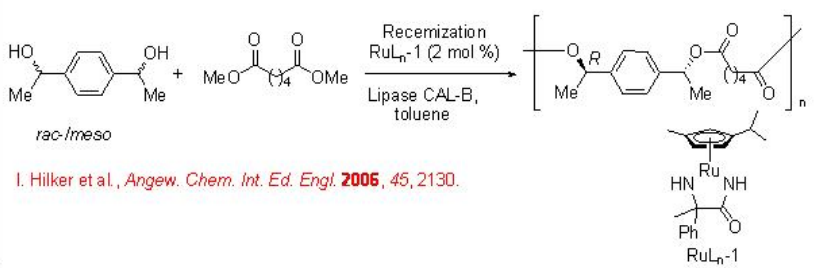
Esta metodología se ha utilizado posteriormente para la síntesis enantio- y diastereoselectiva de polímeros quirales. Por ejemplo, el adipato de dimetilo reacciona con una mezcla de alcoholes racémicos y meso para dar poliéster quiral (Esquema\(\PageIndex{2}\)). El complejo Ru actúa como catalizador de racemización en combinación con la lipasa CAL-B como biocatalizador para la resolución.
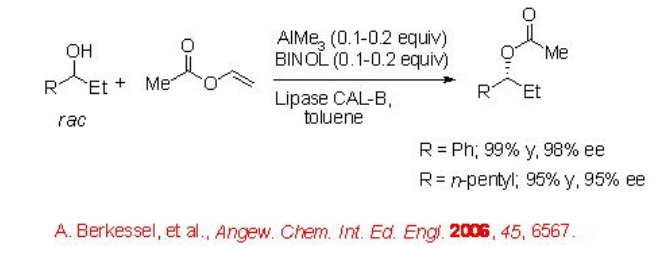
Además, la transformación se ha demostrado empleando un complejo de aluminio barato y fácilmente disponible preparado a partir de AlMe 3 y BINOL como catalizador de racemización. Por ejemplo, el 1-fenil-1-propanol racémico se puede acilar con 99% de rendimiento y 98% ee (Esquema\(\PageIndex{3}\)).
11.1.2 Reacciones con Amina
Las aminas ópticamente puras sirven como intermedios versátiles en la fabricación de productos farmacéuticos y agroquímicos. La acilación catalizada por lipasa de aminas procede eficientemente con excelente enantioselectividad (Esquema\(\PageIndex{4}\)). En esta reacción, uno de los enantiómeros se convierte en amida y el enantiómero amina restante se puede obtener en forma enantioméricamente enriquecida. La reacción funciona en medio orgánico, MTBE como solvente, y el valor E excede 2000 (E = impacto ambiental del proceso.
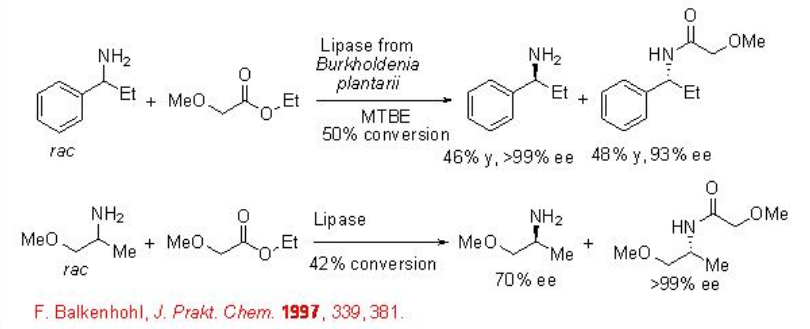
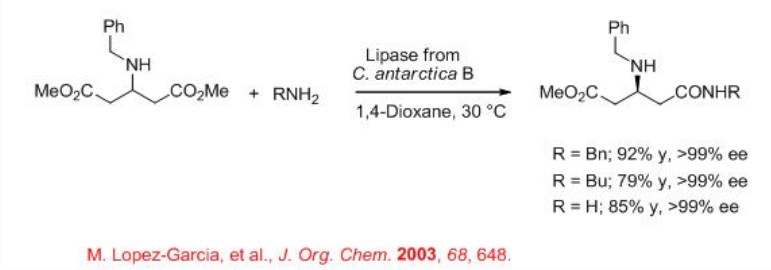
11.1.3 Otras acilaciones
La transformación catalítica enzimática de aminas aquirales y componentes de ácido racémico conocida como aminólisis proporciona un enfoque elegante para la síntesis de ácidos enantioenriquecidos. Un ejemplo interesante es la reacción del 3- (bencilamino) glutarato de dimetilo para dar monoamidas con excelente enantioselectividad (Esquema\(\PageIndex{5}\)). Las monoamidas son intermedios para la síntesis de β-aminoácidos no naturales.
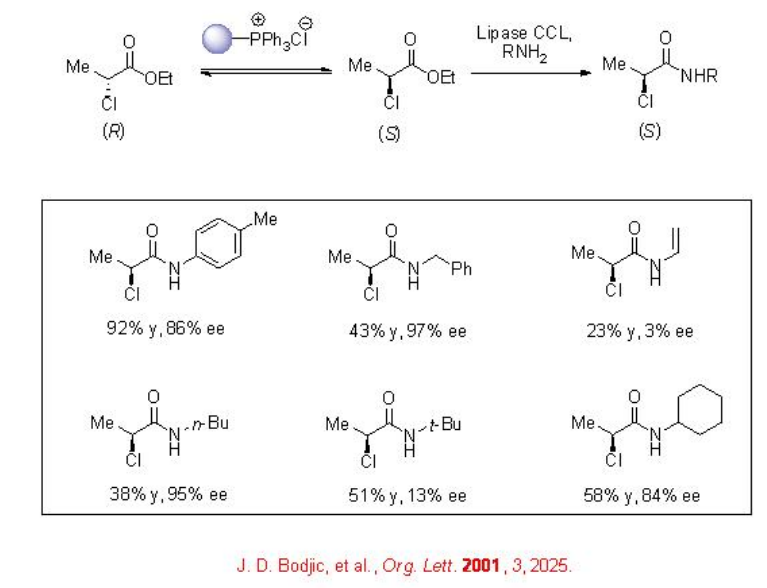
Una resolución cinética dinámica con aminólisis enzimática proporciona una vía efectiva hacia el acceso de ácidos enantioméricamente enriquecidos. Por ejemplo, en presencia de un cloruro de fosfonio inmovilizado para racemización de 2-cloropropionato de etilo y lipasa, se puede llevar a cabo la aminólisis para dar amidas con hasta 92% de rendimiento y 86% ee (Esquema\(\PageIndex{6}\)).
Reacciones hidrolíticas
La hidrólisis enzimática de ésteres, amidas, nitrilos y epóxidos racémicos proporciona métodos efectivos para la síntesis de ácidos carboxílicos ópticamente puros, aminas, amidas, ésteres y alcoholes. Las reacciones de una amplia gama de sustratos han sido bien exploradas.
Hidrólisis Ester
La hidrólisis de éster racémico o proquiral usando enzimas como lipasa, esterasa y proteasa proporciona un método eficaz para la resolución de una amplia gama de sustratos. Recientemente, se ha demostrado la hidrólisis del éster etílico de indol utilizando una lipasa de Pseudomonas fluoresens (Esquema\(\PageIndex{7}\)). El proceso se ejecuta a un concentrado de sustrato alto 100g/L y resultó ser técnicamente factible para funcionar con éxito en una escala de 40 kg.
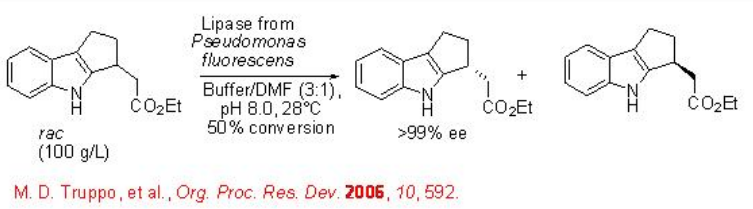
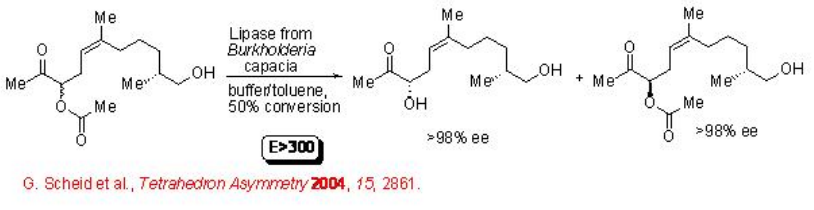
Las lipasas también son adecuadas para la resolución de moléculas complejas que tienen más de un grupo funcional adicional. Por ejemplo, el acetato de aciloína puede hidrolizarse con E > 300 conduciendo a diol en excelente enantioselectividad (Esquema\(\PageIndex{8}\)).
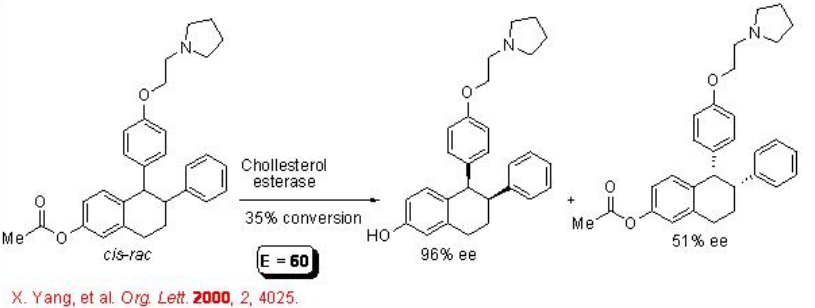
Las hidrolasas también pueden reconocer “centros quirales remotos”. Por ejemplo, el grupo éster separado del centro estereogénico por un grupo aromático procede a la hidrólisis con enantioselectividad teniendo el valor E de 60 (Esquema\(\PageIndex{9}\)). El producto, Lasofoxifeno (cis), es un modulador potente y selectivo del receptor de estrógenos.
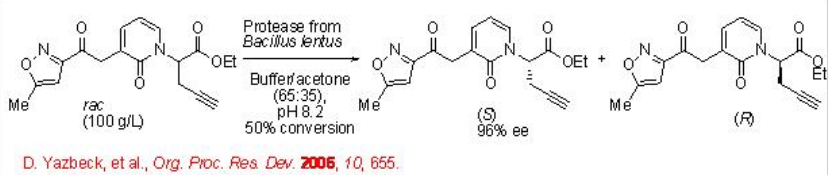
La síntesis de un intermedio para un inhibidor de proteasas de rinovirus se ha logrado mediante una resolución impresionante empleando una proteasa de Bacillus lentus (Esquema\(\PageIndex{10}\)).
Hidrólisis de nitrilo
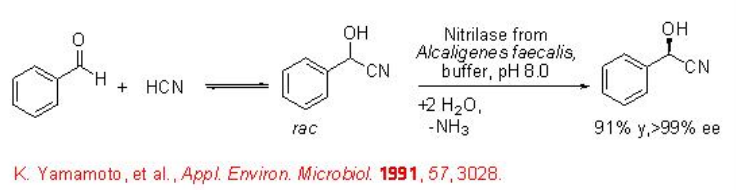
Las nitrilasas se utilizan para la hidrólisis de nitrilos racémicos o proquirales para dar ácidos carboxílicos. Por ejemplo, la nitrilasa de A. faecalis cataliza la hidrólisis de α -hidroxi nitrilos para dar ácido (R) -mandélico con excelente enantioselectividad (Esquema\(\PageIndex{11}\)).
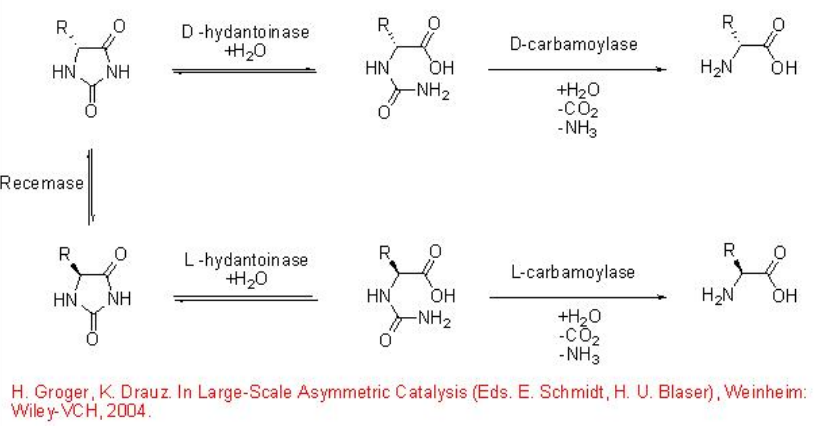
11.2.3 Hidrólisis de hidantoína
Las hidantoinasas y carbamoilasas hidrolizan hidantoínas racémicas para dar α-aminoácidos ópticamente puros (Esquema\(\PageIndex{12}\)). Al principio, la hidantoinasa cataliza la apertura hidrolítica del anillo de la hidantoína para dar un N-carbamoil aminoácido que procede a la escisión para dar el α- aminoácido deseado.
11.2.4 Hidrólisis de epóxido
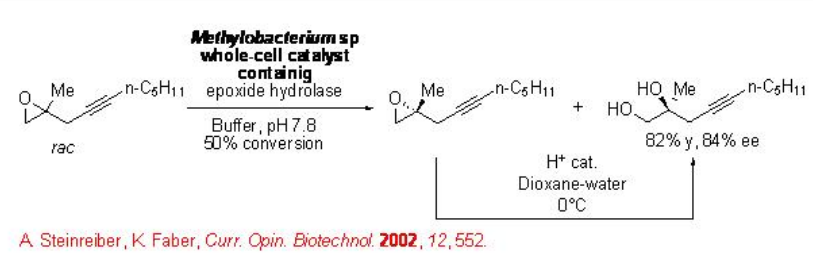
La hidrólisis del epóxido racémico usando epóxido hidrolasa procede con alta enantioselectividad. Por ejemplo, la resolución de epóxido alifático que tiene grupo funcional se puede lograr usando Methylobacterium sp. con buena enantioselectividad (Esquema\(\PageIndex{13}\)).