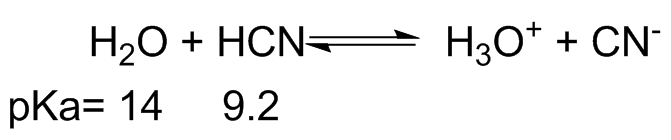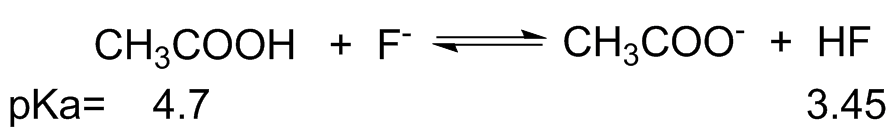2.E: Estructura y Reactividad: Ácidos y Bases, Moléculas Polares y No Polares (Ejercicios)
- Page ID
- 78172
Estos son ejercicios de tarea para acompañar al Capítulo 2 del mapa de texto “Química Orgánica” de Vollhardt y Schore.
2.9: Rotación en Etanos Sustituidos
Problemas
Q26
Se deja una bandeja de cubitos de hielo en el mostrador de una habitación, y los cubitos de hielo se derriten. Si la habitación es un sistema cerrado, ¿cuál es la entalpía total del sistema (habitación + hielo)? ¿La entropía del sistema? ¿Y la energía libre? ¿Es este proceso termodinámicamente favorable? ¿Cómo se compararía la temperatura del hielo, ahora del agua, y de la habitación?
Q27
(a) Utilizando las siguientes fuerzas de unión, calcular el ∆H o para cada una de las reacciones.
| Bond | Fuerza Media (kcal mol -1) |
|---|---|
| C-C | 83 |
| C=C | 146 |
| C-H | 99 |
| Cl-Cl | 57 |
| H-Cl | 102 |
| C-Cl | 78 |
(i) CH 3 -CH=CH 2 + Cl 2 → CH 3 -CHCl-CH 2 Cl
(ii) CH 3 -CH=CH 2 + Cl 2 → CH 2 Cl-CH=CH 2 + HCl
(b) Una de estas reacciones como ∆S o <0 (-35 cal mol -1) y la otra tiene un ∆S o =0. Asigne las dos a las ecuaciones, y dé su razonamiento.
(c) Con base tanto ∆S o como ∆H o calcular ∆G o para cada reacción a 30 o C y 800 o C. ¿Las reacciones son favorables a estas temperaturas?
Q28
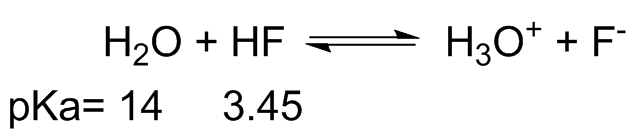
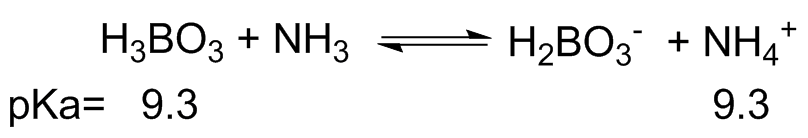
- En cada una de las siguientes ecuaciones etiquetar el ácido y la base de Brønsted, en ambos lados.
- También, determinar en qué dirección se encuentra el equilibrio, izquierda o derecha.
- A partir del pK dado a de cada ácido se calcula la constante de equilibrio, K eq. (pK a H 3 O + = -1.7)
Q29
En el problema 28 usa flechas de empuje de electrones para mostrar lo que está ocurriendo, mirando de izquierda a derecha.
Q30
Determinar si cada una de las siguientes especies es un ácido de Lewis o una base de Lewis. Demostrar esta habilidad con un mecanismo de empuje de flecha electrónica.
a) AlCl 3 b) H 2 O c) ZnCl 2 d) SCCl 3 e) N 3 - f CH 3 CH 2 O -
Q31
Para cada una de las siguientes moléculas denotan las polaridades de enlace, δ + o δ -.
a)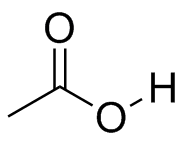 b
b ) c
) c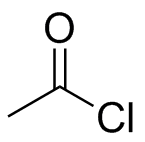 ) d
) d ) e
) e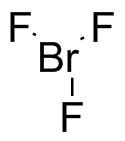
Q32
Identificar si cada especie es nucleófila o electrófila
a) Anión fluoruro, F - (b) anión hidruro, H - (c) cloruro de ácido, CH 3 COCl (d) SCCl 3 (e) N, N'-dietilcarbodiimida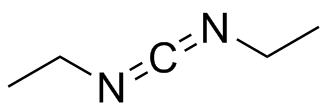
Q33
Identificar los grupos funcionales presentes en cada molécula a continuación.
a) b
b ) c
) c ) d
) d ) e
) e ) f
) f
Q34
Determinar, con base en la interacción coulómbica, si es probable que reaccionen los siguientes. Ninguna reacción es una posibilidad.
(a) amoníaco (NH 3) y ciclohexanona (b) H + y etanol (c) azida (N 3 -) y bromoetano (d) nitrógeno (N 2) y propano (e) trietilamina y H +
Q35
Dibuja el mecanismo de empuje de flecha electrónica de la interacción potencial en el problema 34
Q36
Nombrar cada uno de los siguientes compuestos de acuerdo con la IUPAC.
a) b
b ) c
) c ) d
) d ) e
) e
f)
Q37
Dibuja las siguientes estructuras del nombre
- 2,3,4-trimetilpentano
- 4-etil-3,4,5,5-tetrametilnonano
- neopentano
- 2,2,4,4-tetrametilpentano
- 7-pentiltridecano
- 2,3,4,5,6-pentametilheptano
Q38
Dibujar las estructuras que corresponden a los siguientes nombres, corregir los nombres que no estén de acuerdo con las reglas de nomenclatura sistemática.
- 3-metil-2-fluoropentano
- 1-cloro-3-bromo-2,2-dimetilbutano
- 2-etil-2-cloro-4,5-metilhexano
- 3-metilpentano
Q39
Dibujar todos los isómeros posibles de C 6 H 14
Q40
En cada uno de los siguientes compuestos identifican cada carbono como primario (1 o), secundario (2 o), terciario (3 o), o cuaternario (4 o).
(a) ciclopentano (b) 3,3,5,5-tetraetilheptano (c) metilciclopentano (d) 2,3,4-trimetilpentano
Q41
Identificar cada uno de los siguientes grupos alquilo como primarios, secundarios, terciarios o cuaternarios. Esto se basa en la posición 1 en el grupo alquilo, conectado al enlace discontinuo. También, dar su nombre IUPAC.
(a) (b)
(b) (c)
(c) (d)
(d)
Q42
¿La molécula en (a) contiene un carbono terciario? ¿La molécula en (b)? Explique por qué.
a) b)
b)
Q43
Con base en las siguientes estructuras, piense en las fuerzas de dispersión londinenses y cómo eso afectaría el punto de ebullición. Clasificar los siguientes compuestos en orden de menor a mayor punto de ebullición.
(a) 2,3,4-trimetilhexano (b) nonano (c) 2,3-dimetilpentano (d) 3-metilheptano
Q44
Dibuja la proyección de Newman de menor energía de lo siguiente:
- 2,3-dimetilbutano C2-C3
- 2,2-dimetilbutano C2-C3
- 2-metilpentano C2-C3
- 2-metilpropano
Q45
Dibuja el diagrama de energía, Energía vs. ángulo torsional del enlace C2-C3 del butano, incrementos rotativos de 60 o comenzando en la conformación de energía más baja. También dibuja la proyección Newman de cada uno.
Q46
Dado que 85% de todas las moléculas son anti- y 15% de todas las moléculas son conformación eclipsada a lo largo de un cierto enlace C-C, tomar por ejemplo C2-C3 de butano, dibujan las dos proyecciones de Newman. Calcular el valor ΔG o usando ΔG o =-RTLN (K), a 25 o C donde R=1.986 cal deg -1 mol -1. ¿Tiene sentido la información dada? Si no, ¿de qué manera?
Q47
Identificar los grupos funcionales en cada compuesto.
(a) (aspirina) (b)
(aspirina) (b) (dopamina) (c)
(dopamina) (c) (eritritol- edulcorante)
(eritritol- edulcorante)
(d) (limoneno- en naranjas y limones, sutiles diferencias en la estereoquímica marcan la diferencia en el olor)
(limoneno- en naranjas y limones, sutiles diferencias en la estereoquímica marcan la diferencia en el olor)
Q48
Nombra el grupo alquilo como si la línea discontinua estuviera donde se conectó con el resto de la molécula, indíquelo si es primario, secundario o terciario.
(a) (b)
(b) (c)
(c) (d)
(d)
Q49
Calcular el nuevo valor de k, relativo al valor inicial, utilizando la ecuación de Arrhenius con incrementos de 10, 25 y 60 o C. Supongamos que la temperatura inicial es de 300 o C.
Donde E a es el siguiente
(a) 10 kcal mol -1 (b) 25 kcal mol -1 (c) 50 kcal mol -1
Q50
Una forma alternativa de la ecuación de Arrhenius implica tomar el logaritmo natural de la ecuación dando lo siguiente.
ln k =LnA- (E a/RT)
¿Qué parcela que involucra tanto a k como a T produciría una línea recta? Dar algunas características de la línea, pendiente e intercepción.
Q51
Para la pregunta 35 dibuja el producto que resultaría del mecanismo de empuje de flecha. Asegúrese de no extraer un carbono pentavalente en (a) (use el átomo de oxígeno) y (b) (sustituya el bromo y déjelo salir).
Q52
Dado que la energía libre de Gibbs viene dada por la siguiente ecuación ΔG=ΔH-TΔS, rellene la tabla que produzca un proceso espontáneo (ΔG<0)
|
ΔH |
ΔS |
|---|---|
| Menos de cero | ??? |
| ??? | Mayor que cero |
Q53
Bajo ciertas condiciones, las dos reacciones siguientes son de segundo orden, proporcionales a las concentraciones de ambos reactivos. Escribe la ley de velocidad para cada reacción, y similar a en el problema 35 dibuja las estructuras con cualquier interacción electrostática.
a)
b)
Q54
¿Cuál de las siguientes cosas es cierto sobre el 2,3-dimetilbutano?
- Hay 10 H's primarias
- Hay 6 veces más H primarias que H terciarias
- Hay 3 C terciarias
- No hay C primarias
Q55
Usando ΔG=ΔH-TΔS, donde ΔH=-1000 cal/mol y ΔS=-2cal/mol a T=200K, cuál de las siguientes es verdadera.
- La reacción es endotérmica
- La reacción no es espontánea
- La reacción es exergónica
- Es probable que la reacción involucre un reactivo y produzca dos productos.
Q56
En el 2-metilbutano ¿qué ángulos de unión existen?
- 90 o
- 120 o
- 180 o
- 109.5 o
Q57
¿Qué conformación describe la siguiente proyección de Newman? ¿Cuál sería el más bajo en energía?

- anti eclipsado
- anti gauche
- gauche escalonado
- anti escalonado
Q58
La siguiente molécula, isatina, tiene todos los siguientes grupos funcionales a excepción de:

- anillo aromático
- cetona
- aldehído
- amida
Soluciones
S26
La entalpía del sistema es cero, ya que el cambio es cancelado por el hielo ganando calor y la habitación perdiendo calor. Sin embargo, la entropía sí aumenta y así disminuye la energía libre. Este proceso es termodinámicamente favorable a medida que disminuye la energía libre. La temperatura final del hielo y el agua sería igual.
S27
(a) ∆H o = Bonos Rotos - Bonos Formados
(i) ∆H o = (C=C + Cl-Cl) - (2 C-Cl + C-C)
= (146 + 57) - (2 (78) + 83) = -36 kcal mol -1
(ii) ∆H o = (C-H + Cl-Cl) - (C-Cl + H-Cl)
= (99 + 57) - (78 + 102) = -24 kcal mol -1
b) La reacción (i) implica la combinación de dos moléculas en una sola. Un menor número de productos concentra la energía, y por lo tanto conduce a un valor negativo ∆S o. La reacción (ii) comienza con dos moléculas y da como resultado dos moléculas. No hay cambio en la entropía, y así ∆S o =0.
(c) Los dos valores anteriores pueden ser utilizados para encontrar el cambio en la Energía Libre de Gibbs usando la siguiente ecuación.
∆G o = ∆H o - T∆S o
(i) a 30 o C, o (30 + 273.15) =303.15 K
∆G o = - 36 - 303.15 (-35x10 -3) = -25 kcal mol -1 Favorable
a 800 o C, o 973.15 K
∆G o = - 36 - 1073.15 (-35x10 -3) = +1 kcal mol -1 No Favorable
ii) a 30 o C
∆G o = - 24 - 303.15 (0) = -24 kcal mol -1 Favorable
a 700 o C
∆G o = - 24 - 1073.15 (0) = -24 kcal mol -1 Favorable
S28
(a) (i) H 2 O = Base más débil HF= Ácido más débil; H 3 O + = Ácido más fuerte F - =Base más fuerte
(ii) Desde arriba, el equilibrio estaría a la izquierda
(iii) Usando el pKa podemos encontrar el Ka para cada ácido, Ka=10 -pKa HF K a =10 -3.45 y H 3 O + K a = 10 1.7
K a HF = [F -] [H +]/[HF] y K a H3O + = [H +] [H 2 O]/[H 3 O +] y K eq = [H 3 O +] [F -]/[H 2 O] [HF], a partir de esto podemos ver que K eq = K a HF /K a H3O + o 10 -3.45 /10 1.7 = 7.08x10 -6. Esto tiene sentido porque los favorecen a la izquierda, por lo que calcular el equilibrio a la derecha significaría una constante de equilibrio muy pequeña.
(b) (i) H 2 O = base más débil HCN = ácido más débil; H 3 O + = ácido más fuerte CN - =Base más fuerte
(ii) De la parte (i), el equilibrio estaría a la izquierda.
iii) K a H3O + = [H +] [H 2 O]/[H 3 O +] = 10 1.7 y K a HCN = [CN -] [H +]/[HCN] = 10-9.2 y el K eq = K a HCN /K a H3O + = 10 -9.2 /10 1.7 = 1.26x10 -11, el caso es el mismo que el problema anterior. La constante de equilbrio para la reacción tal como se dibuja, de izquierda a derecha, es muy pequeña.
(c) (i) CH 3 COOH = Ácido más débil F - =Base más débil; CH 3 COO - =Base más fuerte HF=Ácido más fuerte
(ii) Debido a la parte (i), el equilibrio estaría a la izquierda.
(iii) K a CH3COOH = [H +] [CH 3 COO -]/[CH 3 COOH] =10 -4.7 K HF = [H +] [F -]/[HF] =10 -3.45 Esto da como resultado K eq =K a CH3COOH /K HF = 10 -4.7 /10 -3.45 =5.62x10 -2
(d) (i) H 3 BO 3 = igualmente ácido NH 3 = Igualmente básico; H 2 BO 3 - =Igualmente básico NH 4 + = Igualmente ácido
(ii) El equilibrio de reacción no se encuentra a ninguno de los lados. H 3 BO 3 y NH 4 + son igualmente ácidos según su pKa
(iii) Si se calcularon los K eq será igual a 1. 10 -9.3 /10 -9.3 =1.
S29
a)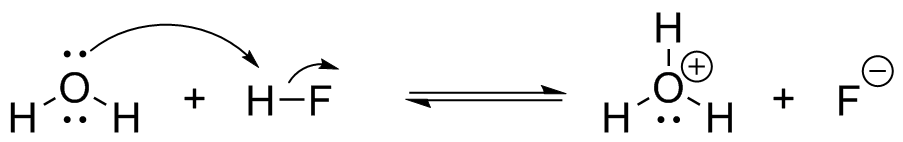 b)
b)
c) c)
c)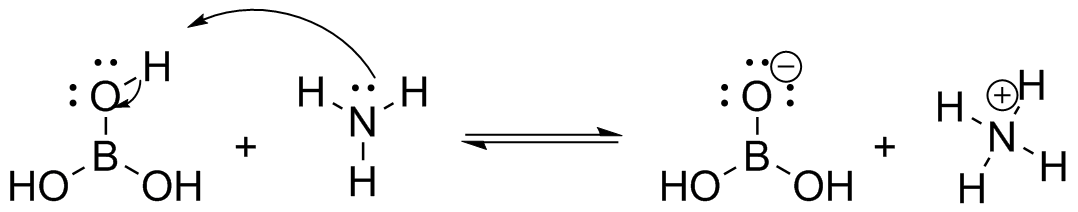
S30
(a) AlCl 3 es un ácido de Lewis. El aluminio es deficiente en electrones, y con tres halógenos electronegativos unidos, el centro de aluminio es un aceptor de electrones.
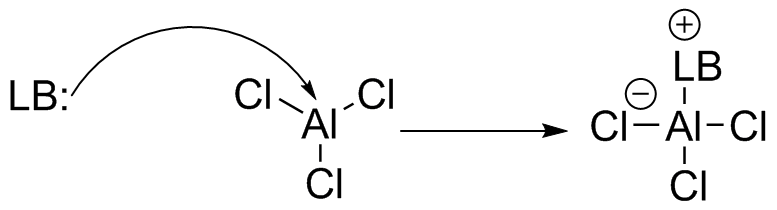
(b) H 2 O es una base de Lewis. El oxígeno tiene dos pares solitarios de electrones, y por lo tanto es un donante de electrones.

(c) ZnCl 2 es un ácido de Lewis. El centro de zinc es Zn 2+, perdiendo dos electrones de los orbitales 4s dejándolo con un orbital 3d completo. Se encuentra en un estado de oxidación positiva y tiene dos halógenos electronegativos unidos, por lo que el centro de zinc es un aceptor de electrones.
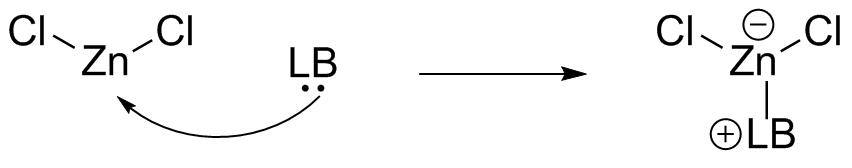
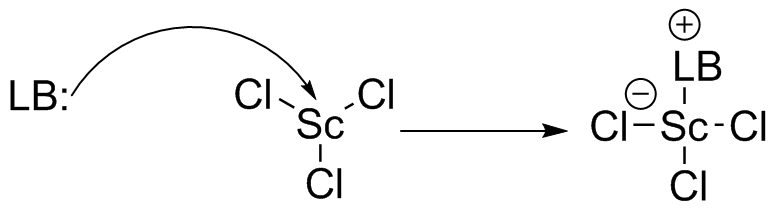
(d) SCCl 3 es un ácido de Lewis. El centro de escandio es Sc 3+, careciendo de dos electrones en los orbitales 4s y uno del orbital 3d, dejándolo con un orbital 3p completo. Se encuentra en un estado de oxidación positiva la mano tiene tres halógenos electronegativos unidos, por lo que el centro de escandio es un aceptor de electrones.
(e) N 3 - es una base de Lewis. Existen dos posibles estructuras de resonancia para esta especie, y en ambas hay electrones de pares solitarios en el nitrógeno frontal. Es un donador de electrones.
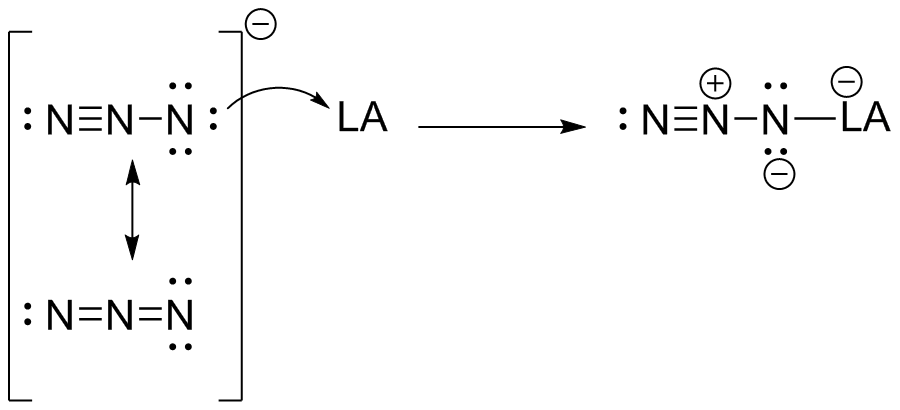 por simplicidad, solo se mostró una estructura de resonancia como el aducto ácido/base de Lewis.
por simplicidad, solo se mostró una estructura de resonancia como el aducto ácido/base de Lewis.
(f) CH 3 CH 2 O - es una base de Lewis. El oxígeno tiene tres pares solitarios de electrones, es un donador de electrones. Aunque no estuviera cargada negativamente seguiría siendo una base de Lewis, con dos parejas solitarias.

S31
a)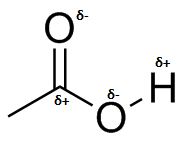 b
b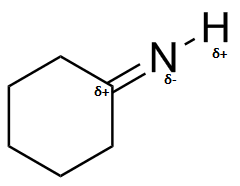 ) c
) c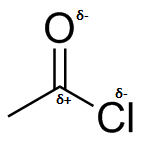 ) d
) d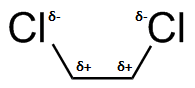 ) e
) e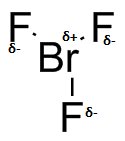
S32
(a) El anión fluoruro está cargado negativamente, y es nucleófilo. b) El anión hidruro está cargado negativamente y es nucleófilo. (c) Los cloruros de ácido son similares a los ésteres y cetonas en que hay un carbono electrófilo con doble enlace al oxígeno, pero los cloruros de ácido suelen ser mucho más reactivos. (d) Se vio anteriormente que SCCl 3 era ácido de Lewis y es electrofílico. (e) El carbono central en N, N'-dietilcarbodiimida es electrófilo debido a las polarizaciones de enlace entre los dos átomos de nitrógeno.
S33
(a) Están presentes un anillo aromático y un ácido carboxílico. (b) Alcohol (c) éster (d) haloalcano (e) anhídrido, esto es similar a un éster, pero la diferencia es la colocación del átomo de oxígeno. (f) amida
S34
- La cetona proporciona un carbono electrófilo.
- El alcohol tiene dos pares solitarios de electrones, y con una carga positiva hay una atracción coulómbica.
- Lo importante aquí es la polarización del enlace C-Br, haciendo que el carbono sea electrofílico. La azida tiene una carga negativa general, y una atracción coulómbica está presente.
- No hay una gran polarización en los enlaces presentes. Ambos gases no son conocidos por ser nucleofílicos o electrófilos.
- Esta es una reacción ácido-base estándar, pero puede explicarse por la atracción coulómbica entre el ion hidrógeno cargado positivamente y el par solitario sobre el nitrógeno.
S35
(a) (b)
(b) (c)
(c) (d) Ninguna reacción (e)
(d) Ninguna reacción (e)
S36
(a) (b)
(b) (c)
(c)
d ) e
) e ) f
) f
S37
(a) (b)
(b) (c)
(c) (d)
(d)
e ) f)
) f)
S38
(a) (b)
(b) (c)
(c) (d)
(d) o 2-metilpentano
o 2-metilpentano
S39

S40
(a) (b)
(b) (c)
(c) (d)
(d)
S41
(a) primario, 2,2-dimetilbutil (b) terciario, 1-etil-1-metilbutilo (c) secundario, 1,3-dimetilbutilo (d) terciario, 1,1,2,2-tetrametileetilo
S42
La molécula (a) no contiene un carbono terciario, solo está unida a otros dos átomos de carbono. Un átomo de oxígeno no afecta esto. El compuesto (b) sí contiene un carbono terciario, ya que está unido a otros tres átomos de carbono.
S43
2,3,4-trimetilpentano<2,3-dimetilhexano<3-metilheptano<nonano
Esta es una combinación tanto del peso molecular como del grado de ramificación de la molécula (afecta la fuerza de las fuerzas de dispersión de Londres). Cuanto mayor sea el peso molecular mayor es el punto de ebullición, pero también cuanto más ramificada es una molécula, menor es el punto de ebullición.
S44
(a) (b)
(b) (c)
(c) (d)
(d)
S45


S46

ΔG o =- (1.986) (273+25) ln (85/15) = -1027 cal o -1.027 kcal
La información dada tiene sentido en que un mayor porcentaje de las moléculas están presentes en la conformación Anti debido a su menor energía. Sin embargo, no se incluyen otras conformaciones, algunas menores en energía que la forma eclipsada como la escalonada. Estos probablemente también hagan una contribución.
S47
(a) (b)
(b) (c)
(c) (d)
(d)
S48
(a) 1,6,6-trimetilhexilo, secundario (b) 1,1,2,2-tetrametilbutilo, terciario (c) 2,2-dimetilbutilo, (d) primario (d) 2-metiletil o isopropilo, primario
S49
La ecuación de Arrhenius es k =Ae - (E a/RT) donde A es una constante. Para calcular el nuevo valor k usa lo siguiente k 2 /k 1 = Ae - (E a/RT 2) /Ae - (E a/RT 1) y la constante, A, cancela.
k 2 = [e - (E a/RT 2) /e - (E a/RT 1)] k 1 también recuerda convertir la E a de kcal a cal.
(a) 10 o C - k 2 = [e - (10.000/ (1.986) (310)) /e - (10.000/ (1.986) (300))] k 1 = 1.71 k 1
25 o C - k 2 = 3.64 k 1
60 o C - k 2 = 16.4 k 1
b) 10 o C - k 2 =3.87 k 1
25 o C - k 2 = 25.2 k 1
60 o C - k 2 = 1090 k 1
c) 10 o C- k 2 = 15.0 k 1
25 o C- k 2 = 636 k 1
60 o C- k 2 =1.19x10 6 k 1
Tenga en cuenta el aumento en el efecto de la temperatura cuanto mayor sea la energía de activación.
S50
ln k =LnA- (E a/RT)
Una parcela de ln k vs. 1/T produciría una línea recta. La pendiente de esta línea sería - (E a/R) con una intercepción x de E a/(R (LnA)) y una intercepción y de LnA.
S51
(a) (b)
(b) (c)
(c) Este es un ejemplo de una reacción de sustitución, de la que conocerás más adelante.
Este es un ejemplo de una reacción de sustitución, de la que conocerás más adelante.
d) Ninguna reacción e)
S52
ΔG=ΔH-TΔS
| ΔH | ΔS |
|---|---|
| Menos de cero | ΔS puede ser cualquier valor positivo o un valor negativo tal que |TΔS|<|ΔH| |
| ΔH puede ser cualquier valor negativo o un valor positivo tal que |ΔH|<|TΔS| | Mayor que cero |
S53
a) Velocidad= k [CH 3 CH 2 O -] [bromuro de alquilo]

b) Velocidad= k [CHC -] [bromuro de alquilo]

S54
 (b) es correcto, hay 12 H primarias y 2 H terciarias.
(b) es correcto, hay 12 H primarias y 2 H terciarias.
(a) Hay 10 H primarias - incorrectas, hay 12 H primarias
c) Hay 3 C terciarias - incorrectas, hay 2 C terciarias
(d) No hay C primarias - Hay 4 C primarias
S55
ΔG=ΔH-TΔS=-1000- (200) (-2) =-600 cal/mol, entonces (c) es cierto. exergónico significa que ΔG<0.
(a) La reacción es endotérmica - incorrecta, ΔH<0
(b) La reacción no es espontánea - incorrecta, ΔG<0
(d) Es probable que la reacción involucre un reactivo y produzca dos productos. - incorrecto, con un cambio negativo en la entropía, es más probable que dos reactivos dieran un producto.
S56
Esta molécula está completamente hibridada sp 3, por lo que todos los ángulos son 109.5 o, (d).
S57
(c) - gauche escalonado es la conformación. Los dos grupos CH 3 están separados por 60 o y ningún grupo es eclipsado. La conformación de energía más baja sería (d) anti escalonada, donde los grupos CH 3 más grandes son anti y no hay grupo eclipsado.
S58
(c), el aldehído no está en la molécula. Hay una cetona, pero no aldehído.