1.E: Estructura y Vinculación en Moléculas Orgánicas (Ejercicios)
- Page ID
- 78399
Estos son ejercicios de tarea para acompañar el Capítulo 1 del mapa de texto “Química Orgánica” de Vollhardt y Schore.
1.8: Orbitales híbridos: unión en moléculas complejas y problemas de práctica
Q25
Dibuje las Estructuras de Lewis de las siguientes moléculas, y si es necesario asigne cargas.
- BrF
- CLcN
- SocL
- CH 3 CH 2 NH 2
- CH 3 CH 2 OCH 2 CH 3
- (CH 3) 2 NNH 2
- CH 3 NCNCH 3
- CH 3 COOH
- N 2 O 4
Q26
En el problema 25 se identifican los enlaces covalentes polares con δ+ y δ- en los átomos según su electronegatividad.
Q27
Dibuje las Estructuras de Lewis de las siguientes especies, y si es necesario asigne cargos.
- H 3 O +
- NH 4 +
- CH 3 CH 2 -
- CH 3 CH 2 +
- CH 3 CH 2
- CH 3 CH
- H -
- CH 3 COO -
Q28
Agregue cargos a las siguientes Estructuras Lewis, si es neutral no agregue ningún cargo.
(a)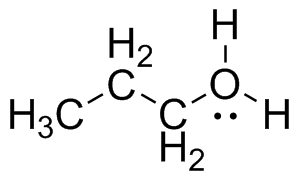 (b)
(b)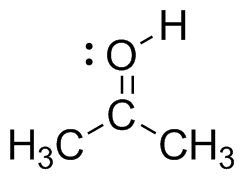 (c)
(c)
d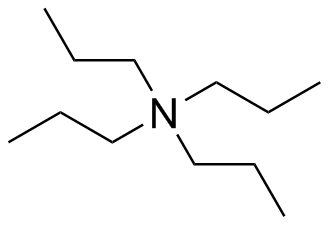 ) e
) e ) f
) f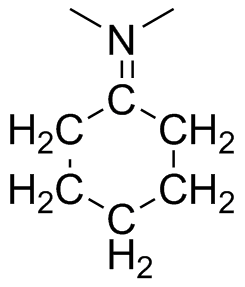
Q29
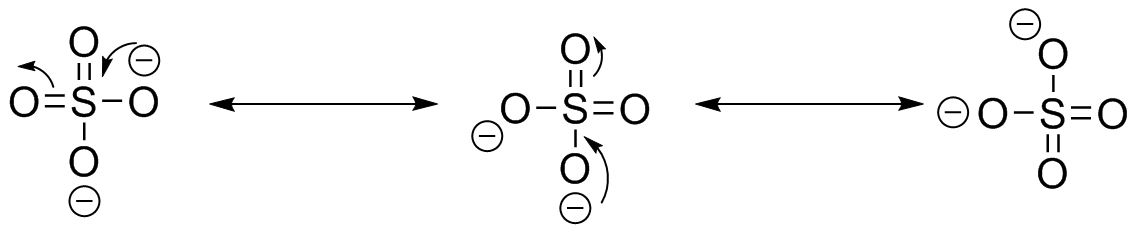
El Ácido Sulfúrico es un ácido fuerte conocido, es desprotonado de la forma SO 4 2-, tiene varias estructuras de resonancia. Dibuja los dos restantes usando flechas de empuje de electrones.

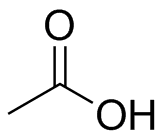
El ácido acético es un ácido doméstico común una vez desprotonado forma un anión con estructuras de resonancia posibles. Dibuja estos con flechas que empujan electrones.
Q30
En el problema 25 varias de las especies tienen posibles estructuras de resonancia. Dibuje las flechas de empuje de electrones y las estructuras de resonancia resultantes para 25.c, 25.h, 25.i. Identificar al contribuyente principal, y dar razones.
Q31
Dibujar todas las estructuras de resonancia posibles de las siguientes especies.
- CH 2 COCH 3 -
- CH 2 N 2
- CO
- CH 2 ENCADO (CH 3) 2
- SCN -
- NO 3 2-
- O 3
Q32
Dibujar todas las estructuras de resonancia posibles de lo siguiente. Con base en las estructuras de resonancia, ¿qué carbono carbonílico, marcado en rojo, sería el más deficiente en electrones?

Q33
Dibuja la estructura de Lewis para cada compuesto.
- Flúor y el anión fluoruro
- GeH 4 y GeO
- H 2 O 2 (Peróxido de Hidrógeno)
- Fosfina (PH 3) y Amoniaco (NH 3)
Q34
Dibuja los diagramas orbitales moleculares de H 2 +, He 2 2+ y He 2, e indica el orden de enlace. Compara y contrasta los diagramas orbitales moleculares de He 2 + y He 2, ¿cuál es más favorable?
Q35
Predecir la geometría para cada átomo resaltado en rojo y dar la hibridación de ese centro.
a)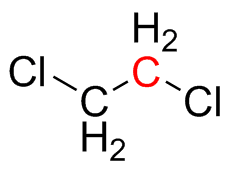 b
b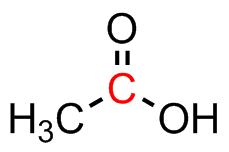 ) c
) c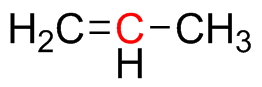 ) d
) d ) e
) e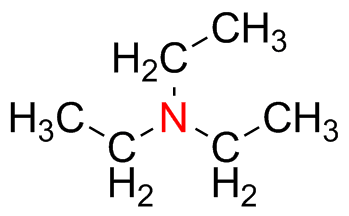 ) f
) f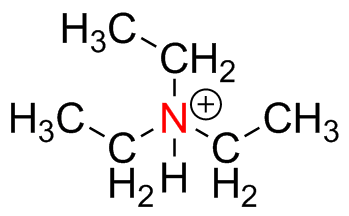
Q36
En el problema 35 indican las interacciones de los orbitales híbridos (sp 3, sp 2, sp) y los orbitales atómicos utilizados (s, p).
Q37
Dibujar los orbitales hibridados para cada uno de los carbonos resaltados en el problema 35.
Q38
Determinar la hibridación de cada carbono en función de la forma de cada molécula.
(a) CH 3 Br (b) CH 3 CH 2 OH (c) H 3 CHCCH (d) CH 3 - (e) NH 4 +
Q39
Dibuja las estructuras Kekule para las siguientes moléculas, a continuación se da un ejemplo.
Ejemplo. CH 3 CH 2 CH 2 CH 3
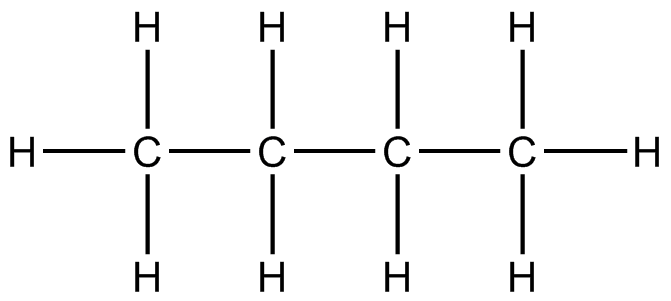
(a) CH 3 CH 2 OH (b) (CH 3) 2 CH 2 OH (c) (CH 3) 2 NCHO (d) CH 2 CLch 2 Cl (e) HOOCCH 2 COOH
Q40
Dibuja las estructuras Kekule para las siguientes moléculas.
a)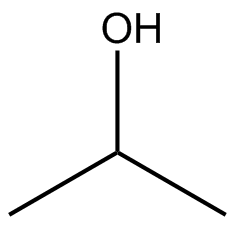 b
b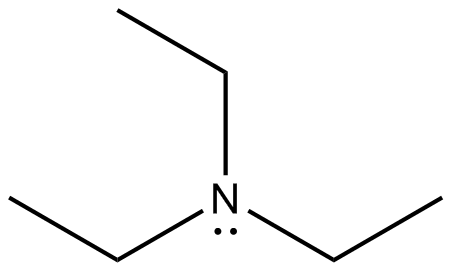 ) c
) c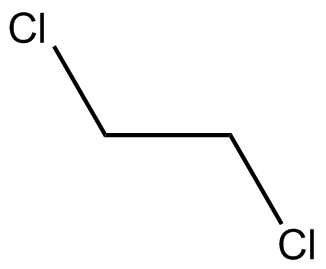 ) d
) d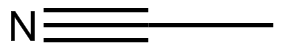 ) e
) e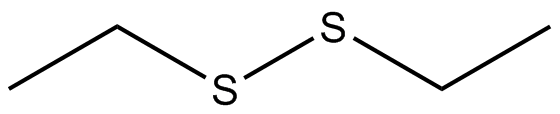 ) f
) f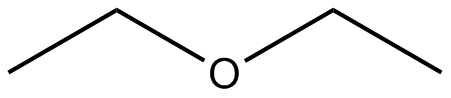
Q41
Convertir las siguientes estructuras en fórmulas condensadas
(a)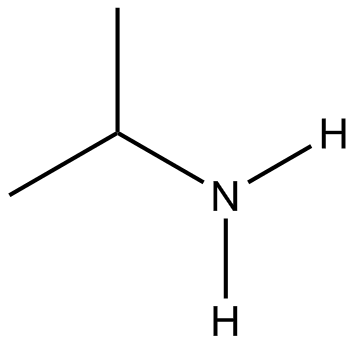 (b)
(b)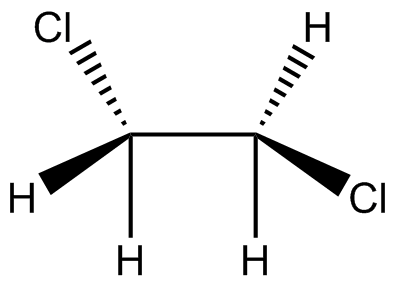 (c)
(c)
Q42
Dar las estructuras condensadas para las siguientes estructuras Kekulé.
a)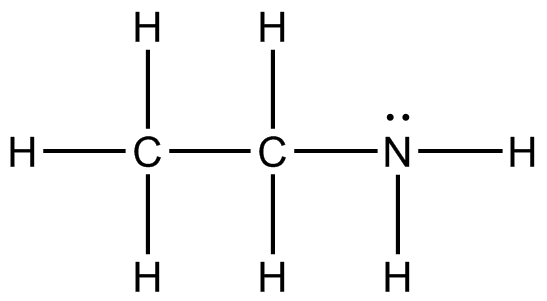 b
b ) c
) c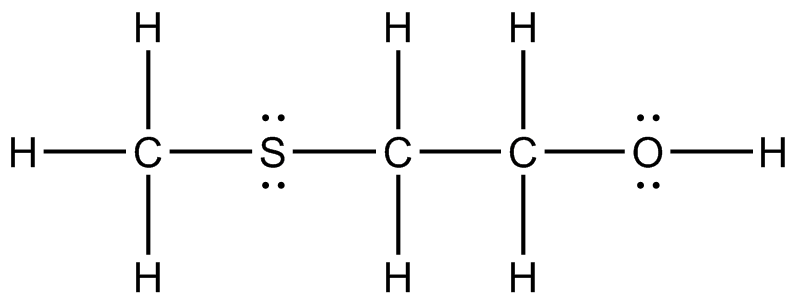 ) d
) d ) e
) e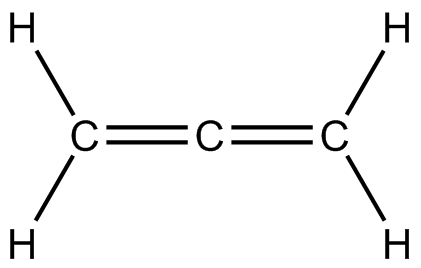 ) f
) f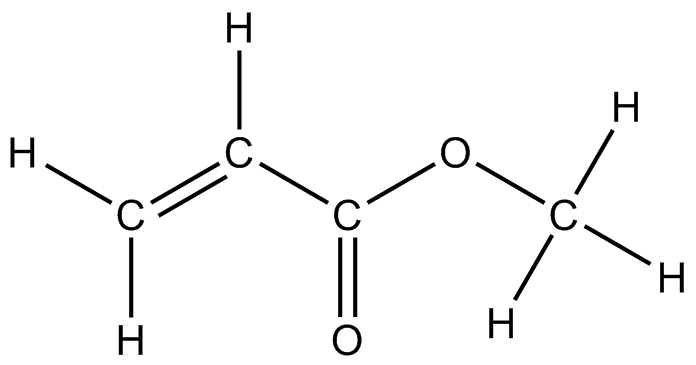
Q43
En el problema anterior, 42, dibujan las estructuras de Kekulé como estructuras de líneas de unión.
Q44
Dibuje las siguientes fórmulas condensadas como estructuras de líneas acuñadas.
- CH 3 CH 2 OCH 2 CN
- CH 2 Cl 2
- (CH 3 CH 2) 3 P
- CH 2 CHCH 2 SiH 3
Q45
Dibujar todos los isómeros constitucionales posibles, en forma de línea de enlace, de las siguientes moléculas.
a) C 3 H 8 b) C 6 H 14 c) C 4 H 10
Q46
Dibuje estructuras de enlace lineal de los siguientes pares de especies e incluya todas las cargas. ¿Alguna de las parejas son formas de resonancia de las otras especies en la pareja? Si no explique la diferencia
(a) H 3 CCHCCH 2 y H 2 CCCHCH 3 (b) HCN y H 3 CNH 2 (c) CH 3 CH 2 COH y CH 3 CH 2 CHOH
Q47
Los siguientes compuestos de boro y halógeno tienen estructuras de resonancia posibles. Dibujarlos y en cada compuesto indicar qué estructura es favorecida (pista: la regla del octeto tiene precedencia). Además, compare los niveles de energía relativa de las tres estructuras de resonancia favorecidas, ¿cuál es la más favorecida/más baja en energía?
(a) (CH 3) 2 BF (b) (CH 3) 2 BCl (c) (CH 3) 2 BBr
Q48
Usando la fórmula para los grados de cada ángulo, [(n-2) *180] /n, donde n es igual al número de lados, determina los ángulos en cada una de las siguientes formas. Si las formas dadas se consideraron estructuras de líneas de unión, ordenarlas de mayor a menor favorabilidad en función de los ángulos (El mejor solapamiento en el carbono hibridado sp 3 es a 104.5 o). Compara esta respuesta con las siguientes energías de deformación de anillo de cada una: ciclopropano (triángulo) - 27.5 kcal/mol ciclobutano (cuadrado) - 26.3 kcal/mol ciclopentano (pentágono) - 6.2 kcal/mol ciclohexano (hexágono) -0.1 kcal/mol.

Q49
Dar el orbital de hibridación al que pertenece el par solitario de cada una de las siguientes especies. Además, dado que los orbitales 2p son más altos en energía que los orbitales 2s, ordene a las especies de menor a mayor energía de acuerdo con el carácter s/p. (sp 3 = 1/4s y 3/4p) (sp 2 = 1/3s y 2/3p) (sp= 1/2s y 1/2p).
a) CH 3 CH 2 CH 2 - b CH 3 CHCH - c CH 3 CC -
Con base en su energía relativa, ¿qué especies sería más favorable someterse a la siguiente disociación (HA representa el hidrocarburo neutro)?

Q50
En cada conjunto ¿cuál de los siguientes átomos de enlace de carbono polarizados positivamente es el más electropositivo?
a) i) CHCl 3 ii) CHCl 2 iii) CCl 4
(b) (i) CLch 2 OCh 2 Cl (ii) CH 3 OCH 2 Cl
c) i) (CH 3) 3 C + ii) (CH 3 CH 2) 3 C +
Q51
La siguiente molécula es un insecticida común, la ciflutrina. Se sabe que es muy eficaz contra los invertibratos, pero no es tan tóxico para los mamíferos. A continuación destacan un (a) enlace sencillo covalente altamente polarizado (b) un doble enlace altamente polarizado (c) un átomo de carbono hibridado sp 2 (d) un átomo de carbono hibridado sp y (e) un sistema conjugado.

Q52
En la siguiente reacción, ¿cambia la hibridación del átomo de carbono resaltado? Dar la hibridación antes y después.

Q53
Un análisis elemental de combustión encuentra que un compuesto está compuesto por 84% de carbono y 16% de hidrógeno (C=12.0, H=1.0, O=16.0). ¿Cuál de los siguientes podría ser el compuesto probado?
a) CH 4 O b) C 6 H 14 O 2 c) C 14 H 22 d) C 7 H 16
Q54
Según lo dibujado, ¿cuál de las siguientes es una asignación formal correcta de cargo?

(a) +1 en F (b) -1 en N (c) +2 en N (d) -1 en B (e) +1 en B (e) +1 en B
Q55
El vínculo resaltado está formado por la interacción entre ¿qué dos orbitales?

Q56
¿Qué centro de carbono resaltado tiene los ángulos de unión más pequeños?
(a) C O 2 (b) C H 2 Cl 2 (c) H C CH (d) C O
Q57
¿Qué par de estructuras son híbridos de resonancia?
(a) (b)
(b) (c)
(c) (d)
(d)
Soluciones
S25.
(a) (b)
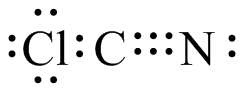 (c)
(c)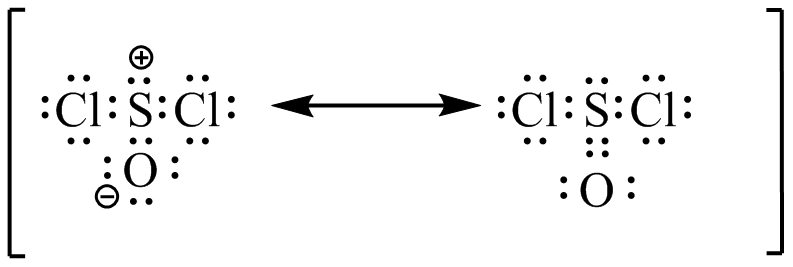 (d)
(d)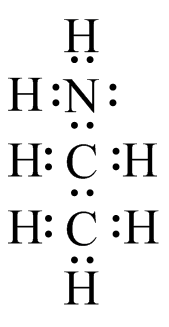
(e)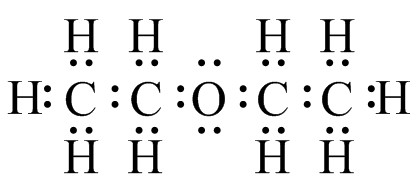 (f)
(f)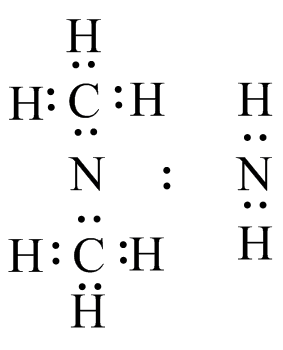 El par solitario se comparte entre los dos átomos de N.
El par solitario se comparte entre los dos átomos de N.
g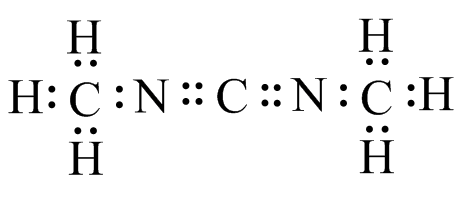 ) h
) h ) i
) i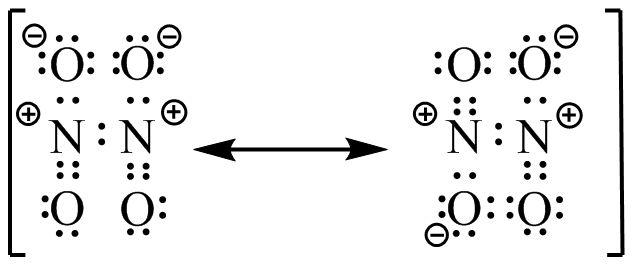
S26
(a)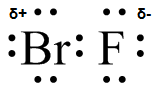 (b)
(b)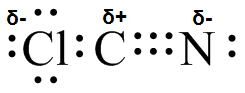 (c)
(c)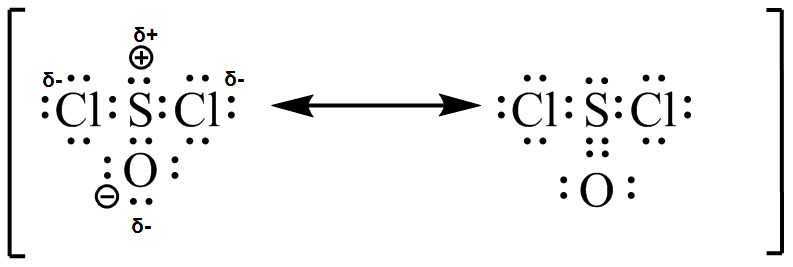 (d)
(d)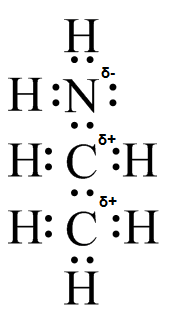
(e)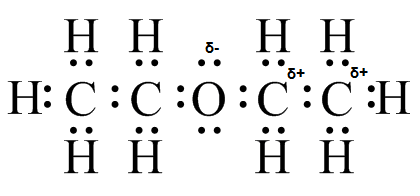 (f)
(f)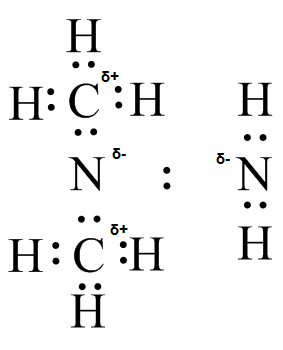 (g)
(g)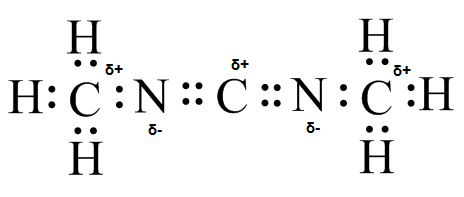
h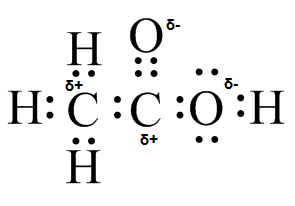 ) i
) i
S27
(a)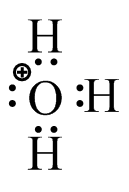 (b)
(b)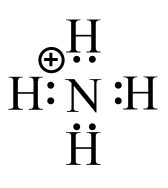 (c)
(c) (d)
(d)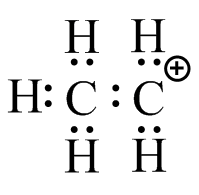
(e)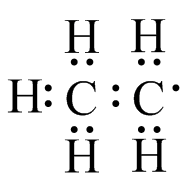 f)
f) (g)
(g) (h)
(h)
S28
(a)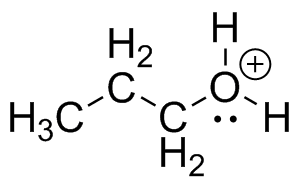 (b)
(b) (c)
(c)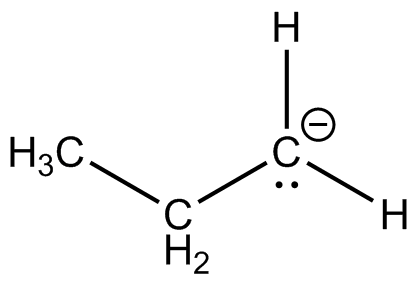
d ) e)
) e) neutral f
neutral f
S29
El ácido sulfúrico tiene dos estructuras de resonancia más posibles. Posteriormente, se mencionará la distribución de resonancia/carga; las estructuras de resonancia posibles para el ácido sulfúrico desprotonado son una de las razones por las que es tan fuertemente ácido.
El ácido acético tiene una estructura de resonancia adicional posible, nuevamente una razón de su moderada acidez.

S30
c)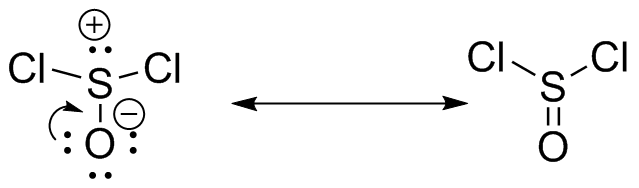 La estructura de resonancia sin cargos es el principal contribuyente.
La estructura de resonancia sin cargos es el principal contribuyente.
(h)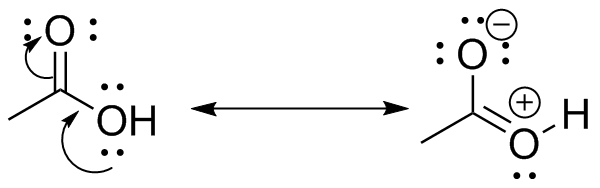 Nuevamente, la estructura de resonancia sin cargos es el principal contribuyente.
Nuevamente, la estructura de resonancia sin cargos es el principal contribuyente.
(i) Cada estructura de resonancia es equivalente, por lo que no hay un “contribuyente mayor”.
Cada estructura de resonancia es equivalente, por lo que no hay un “contribuyente mayor”.
S31
a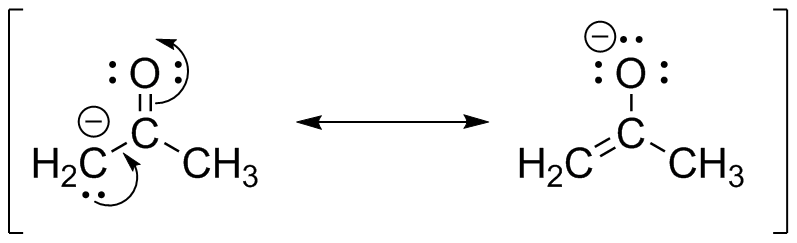 ) b
) b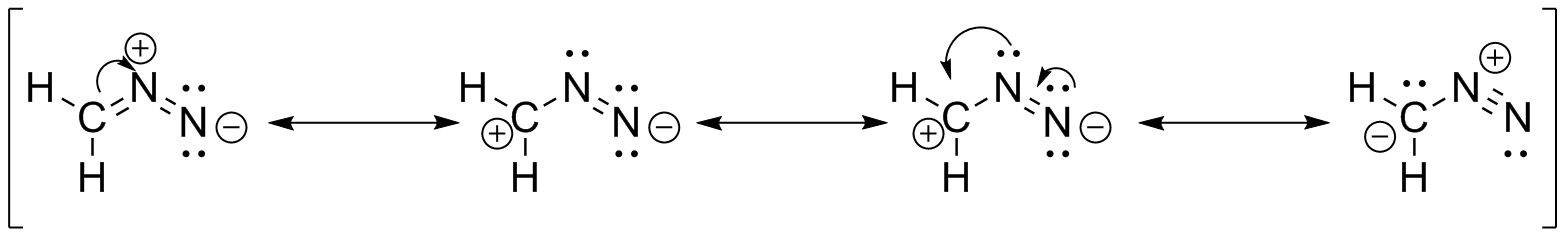
c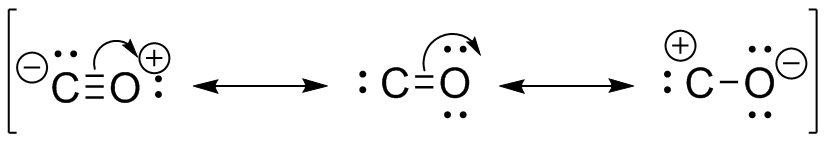 ) d
) d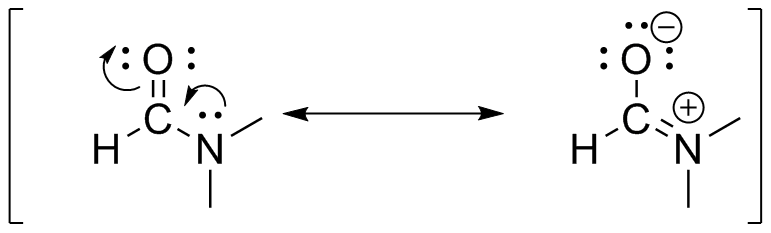
e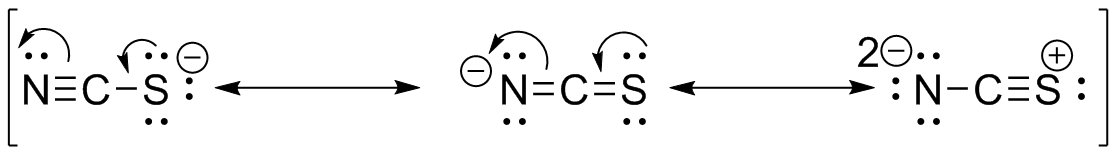 ) f
) f
(g)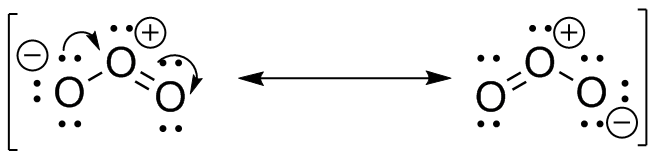
S32
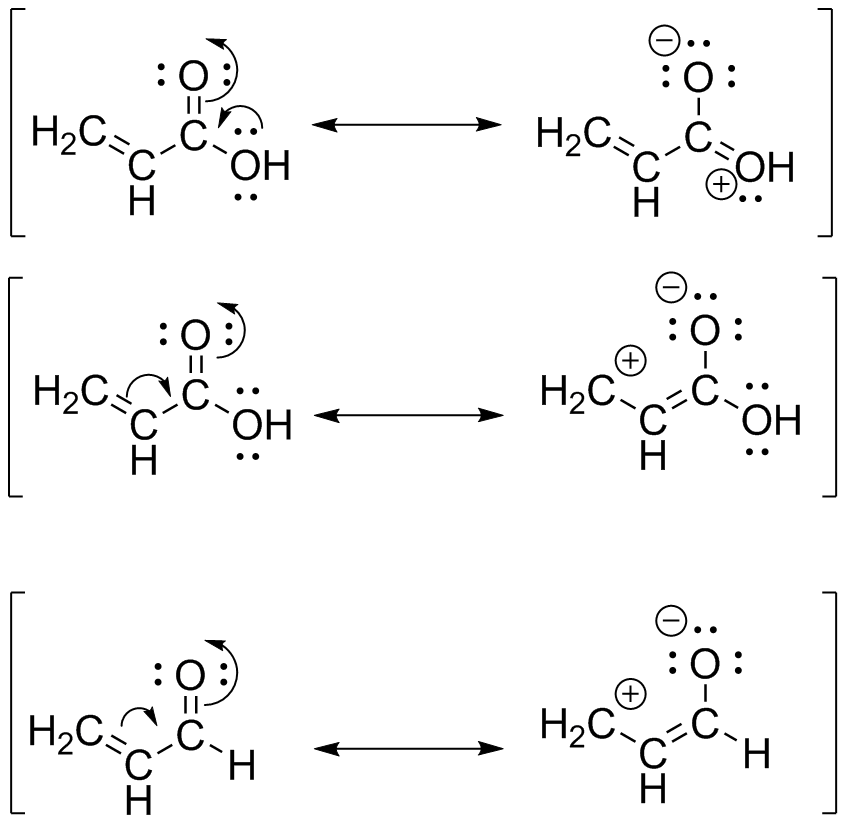
La primera estructura tiene dos posibles estructuras de resonancia, distribuyendo más electrones entre el carbono carbonilo. Sin embargo, la segunda estructura solo tiene una posible estructura de resonancia. Esto distribuye electrones en menor medida entre el carbono carbonilo. Así, en la segunda estructura, el aldehído, el carbono marcado en rojo es más deficiente en electrones que en el ácido carboxílico.
S33
(a) (b)
(b)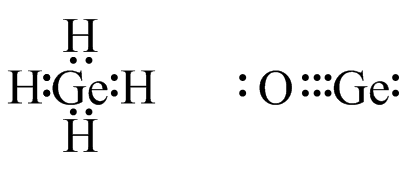 (c)
(c) (d)
(d)
S34
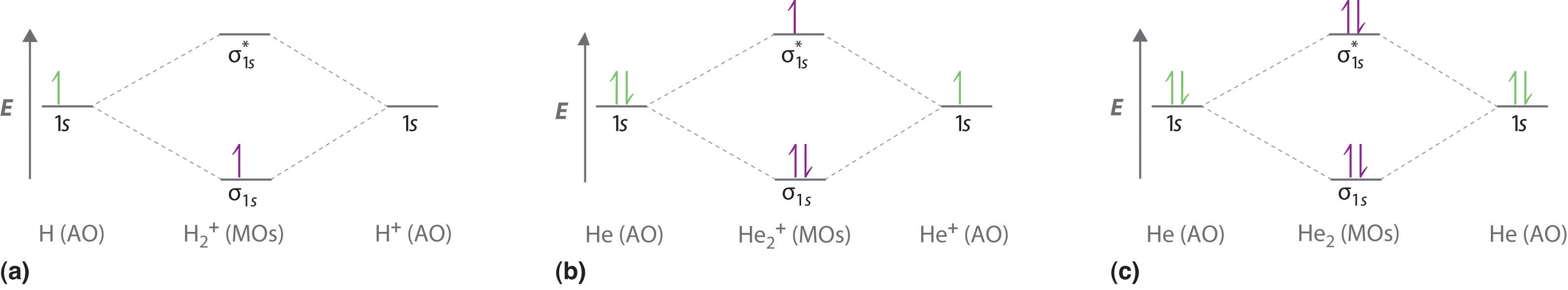
H 2 + tiene una orden de fianza de 1/2, He 2 + tiene una orden de fianza de 1/2, y He 2 tiene una orden de fianza de 0. El orden de bonos cero indica que He 2 no es favorable.
S35
- dicloroetano: El centro de carbono resaltado es tetraédrico con una hibridación de sp 3; está unido a otros cuatro grupos.
- ácido acético: El centro de carbono es plano trigonal con una hibridación de sp 2; está unido a tres grupos y no tiene pares solitarios.
- propeno: El centro de carbono es plano trigonal con una hibridación sp 2; está unido a tres grupos y no tiene pares solitarios.
- acetileno: El centro de carbono es lineal con una hibridación de sp; está unido a dos grupos sin pares solitarios.
- trietilamina: El centro de nitrógeno es tetraédrico con una hibridación de sp 3; está unido a tres grupos con un par solitario.
- Ion trietilamonio: El centro de nitrógeno es tetraédrico con una hibridación de sp 3; está unido a cuatro grupos sin pares solitarios. Todos son enlaces sigma.
S36
- El carbono resaltado forma enlaces con un cloro, dos átomos de hidrógeno y otro carbono. Cada uno de estos átomos se conecta al carbono central formando orbitales hibridados sp 3 -sp 3. El carbono y el hidrógeno utilizan electrones del orbital s, mientras que los electrones de enlace del cloro son de los orbitales p. Todos son enlaces sigma.
- El carbono central es sp 2 hibridado, y está unido a un carbono y dos átomos de oxígeno. El enlace al carbono implica un solapamiento sp 3 -sp 2 con el orbital s en el carbono adyacente involucrado en la unión, unión sigma. El doble enlace carbono-oxígeno es un poco más complicado. Es menos probable que el oxígeno sufra hibridación orbital. Entonces, el enlace C (sp 2) -O (p) sigma se forma junto con la interacción del segundo orbital de oxígeno p con el orbital carbono p para producir un enlace pi. El enlace carbono-oxígeno es similar formando un enlace sigma a través de la interacción C (sp 2) -O (p).
- El carbono central es sp 2 hibridado y unido a otros dos carbonos y un átomo de hidrógeno. El enlace entre el átomo de hidrógeno implica la interacción C (sp 2) -H (s) que produce un enlace sigma. El doble enlace C=C implica la interacción C (sp 2) -C (sp 2) creando un enlace pi. El enlace sencillo C-C es un enlace sigma que involucra los orbitales híbridos C (sp 2) -C (sp 3).
- El carbono resaltado está unido a un átomo de hidrógeno y un átomo de carbono. El enlace sencillo C-H se compone de la interacción C (sp) -H (s) produciendo un enlace sigma. El triple enlace C-C se compone de los orbitales híbridos C (sp) -C (sp) que producen un enlace sigma, orbitales s y dos enlaces pi, utilizando los dos orbitales p.
- El nitrógeno resaltado está unido a tres grupos de carbono idénticos y tiene un par solitario. Cada uno de los átomos de carbono es sp 3 hibridado. Entonces, un N (sp 3) -C (sp 3) produce un enlace sigma.
- El nitrógeno resaltado está unido a tres átomos de carbono idénticos y un hidrógeno. No hay pares solitarios en el nitrógeno, y es sp 3 hibridado. Los enlaces N-C son los mismos que en la parte (e), N (sp 3) -C (sp 3) dando un enlace sigma. El enlace N-H se forma a partir de la interacción N (sp 3) -H (s), también un enlace sigma.
S37
(a) (b)
(b)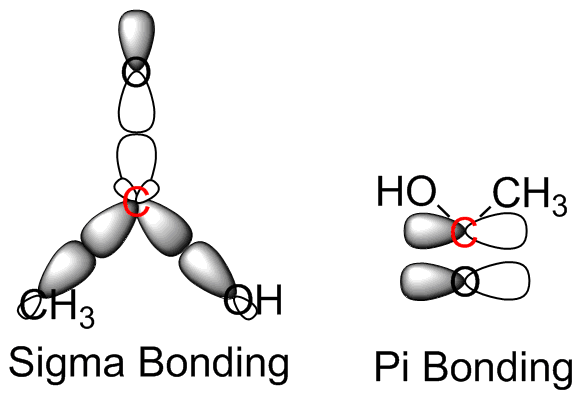 (c)
(c)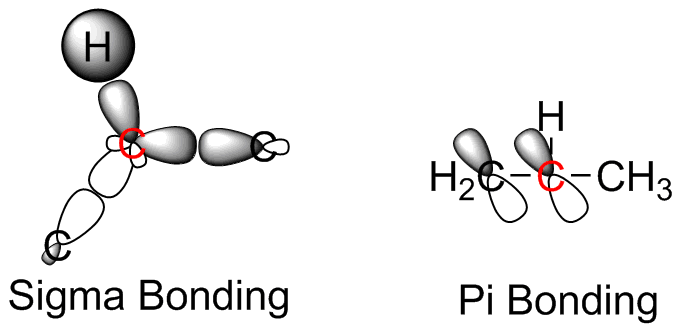
d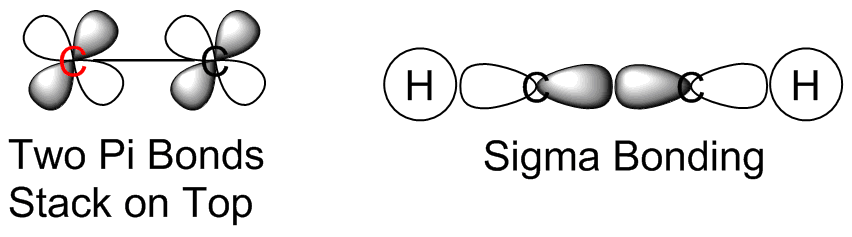 ) e
) e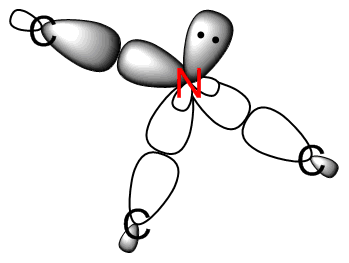 ) f
) f
S38
La hibridación de cada carbono se enumera de izquierda a derecha en la fórmula química.
- tetraédrico, sp 3
- tetraédrico, sp 3; tetraédrico, sp 3
- tetraédrico, sp 3; lineal, sp; lineal, sp
- tetraédrico, sp 3
- tetraédrico, sp 3
S39
a) b
b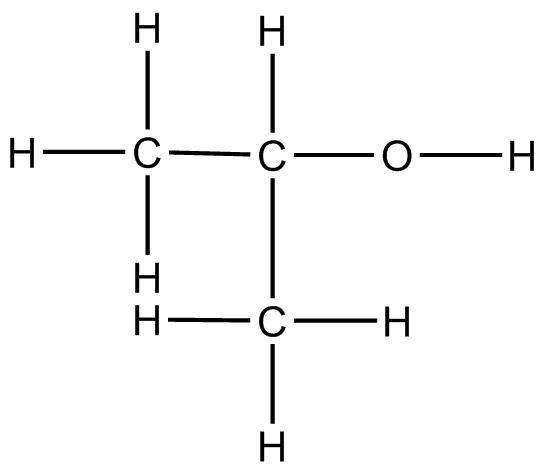 ) c
) c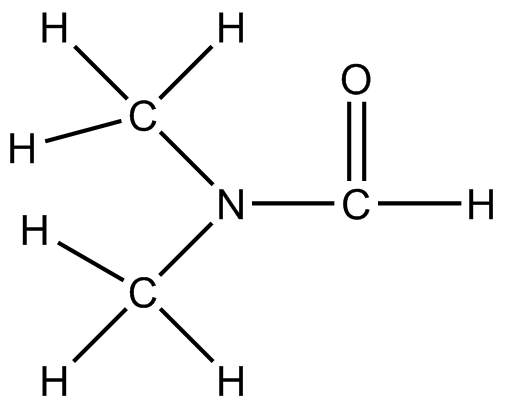 ) d
) d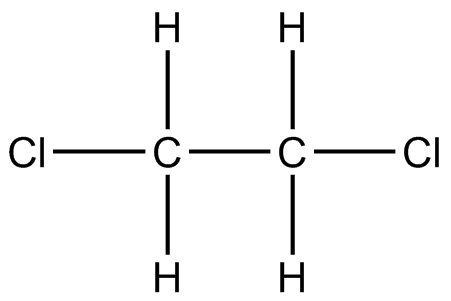 ) e
) e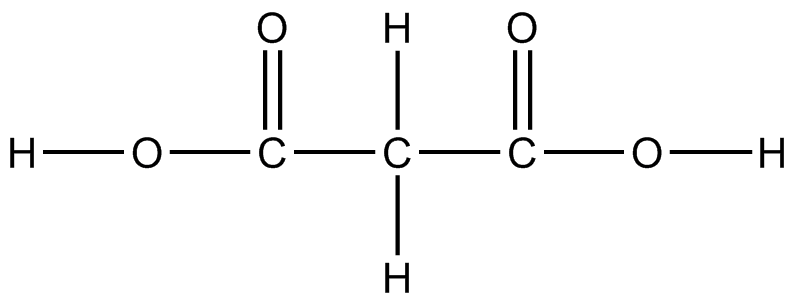
S40
(a)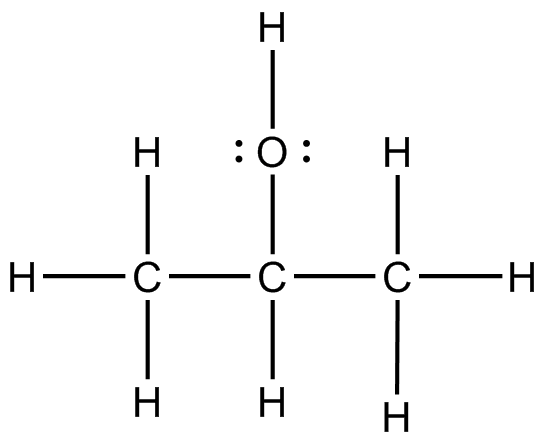 (b)
(b) (c)
(c)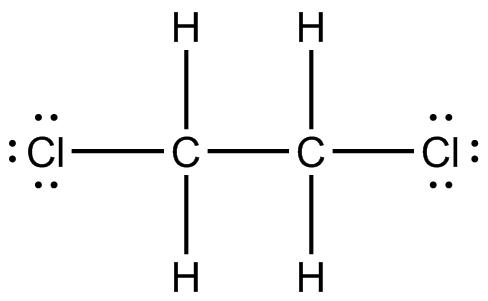 (d)
(d)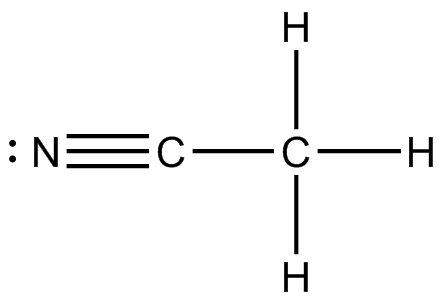
e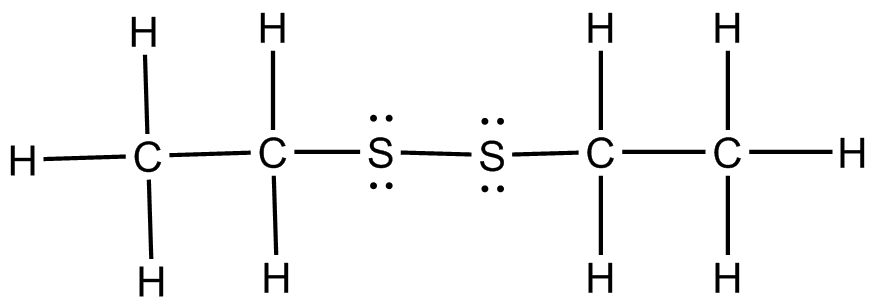 ) f
) f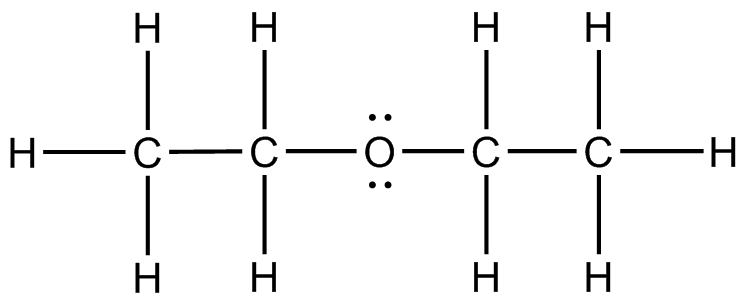
S41
a) (CH 3) 2 CHNH 2 b) CClH 2 CH 2 Cl c) CH 3 I
S42
(a) CH 3 CH 2 NH 2 (b) CH 3 C=O CH 3 (c) CH 3 SCH 2 C 2 OH (d) CF 3 CHOHCF 3 (e) CH 2 CCH 2 (f) CH 2 CH C=O OCH 3
S43
a)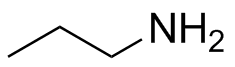 b
b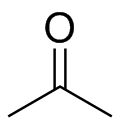 ) c
) c ) d
) d ) e
) e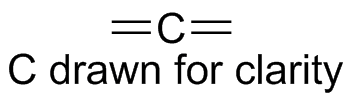 ) f
) f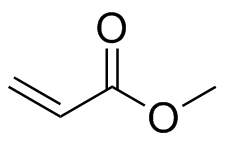
S44
(a) (b)
(b)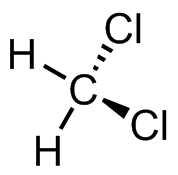 (c)
(c)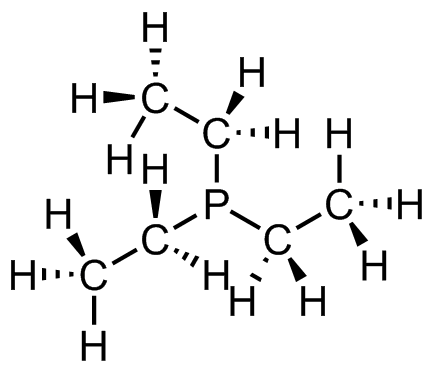 (d)
(d)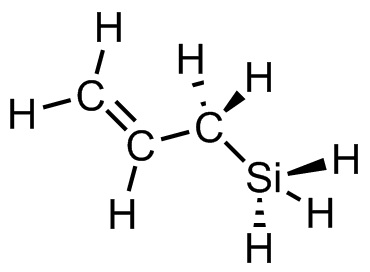
S45
(a) (b)
(b)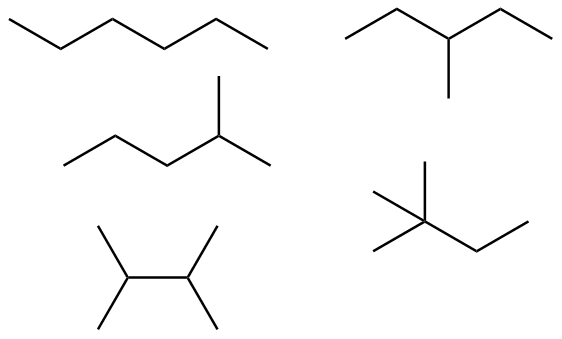 (c)
(c)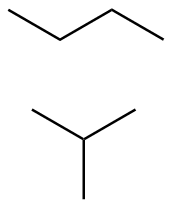
S46
(a) las dos estructuras son idénticas (b)
las dos estructuras son idénticas (b) Estas no son estructuras de resonancia; hay átomos H adicionales. (c)
Estas no son estructuras de resonancia; hay átomos H adicionales. (c) Estas no son estructuras de resonancia; hay tres átomos de H adicionales.
Estas no son estructuras de resonancia; hay tres átomos de H adicionales.
S47
 En cada caso se prefiere la estructura de resonancia de doble enlace, debido a que se cumple la regla del octeto.
En cada caso se prefiere la estructura de resonancia de doble enlace, debido a que se cumple la regla del octeto.
La estructura energética más baja se puede determinar pensando en la electronegatividad de cada átomo de halógeno. Cuanto mayor sea la electronegatividad, menos favorable es una carga positiva. El orden de la electronegatividad es el siguiente, F>Cl>Br, y así lo contrario es el orden de favorabilidad. (CH 3) 2 BF (b) (CH 3) 2 BCl (c) (CH 3) 2 BBr
S48
Triángulo- 60 o Cuadrado- 90 o Pentágono- 108 o Hexágono- 120 o
Esto llevaría a la expectativa de que el orden de favorabilidad sea Pentágono>Cuadrado>Hexágono>Triángulo. Sin embargo, el orden difiere y de hecho es Hexágono>Pentágono>Cuadrado>Triángulo.
En realidad esto se debe a diferentes conformaciones de las formas, por lo que el hexágono y el pentágono ya no son planos/planos. Esto se cubrirá con más detalle más adelante.
S49
CH 3 CH 2 CH 2 - - sp 3 CH 3 CHCH - - sp 2 CH 3 CC - - sp
El orden de la energía es el siguiente, o aumentando el carácter p. CH 3 CC - <CH 3 CHCH - <CH 3 CH 2 CH 2 -
La reacción sería más favorable si la A - es la más baja en energía, por lo que, el orden de favorabilidad es el reverso de lo anterior. CH 3 CH 2 CH 2 - <CH 3 CHCH - <CH 3 CC -
S50
a) CCl 4
(b) CLch 2 OCH 2 Cl
(c) (CH 3) 3 C + Los hidrocarburos adicionales en el grupo etilo se hiperconjugan marginalmente y donan electrones al carbono central, haciéndolo menos electropositivo.
S51
(a) En esta estructura cualquier carbono sp 3 conectado a un heteroátomo sería un enlace polarizado.
En esta estructura cualquier carbono sp 3 conectado a un heteroátomo sería un enlace polarizado.
(b) En esta estructura este es el único doble enlace altamente polarizado.
En esta estructura este es el único doble enlace altamente polarizado.
(c) Cualquier carbono de doble enlace podría considerarse sp 2 hibridado.
Cualquier carbono de doble enlace podría considerarse sp 2 hibridado.
(d) Este es el único carbono hibridado sp.
Este es el único carbono hibridado sp.
(e) Estos dos anillos de benceno son de sistema conjugado.
Estos dos anillos de benceno son de sistema conjugado.
S52
La hibridación cambia de sp 2 a sp 3.
S53
(d) 84/12=7 Carbono y 14/1=14 Hidrógeno
S54
(d) es correcto, el boro típicamente tiene 3 electrones de valencia. Actualmente está unido a cuatro átomos diferentes; tiene un octeto. 8/2=4 electrones, y 3-4=-1 carga formal.
S55
El enlace se forma por la interacción entre el orbital s del hidrógeno y el orbital sp 2 del carbono.
S56
(b) Este es el único carbono resaltado hibridado sp 3, caracterizado por ángulos de enlace de 104.5 o. Que es menor que ambos sp 2 y sp, 120 o y 180 o respectivamente.
S57
(c) El número de electrones es el mismo y todos los átomos están en las mismas ubicaciones. Es importante tener en cuenta la colocación de cargas; en los pares sin cargas presentes entonces algunos átomos se movieron alrededor.

