26.8: Polipéptidos en la naturaleza: transporte de oxígeno por las proteínas mioglobina y hemoglobina
- Page ID
- 78292
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Transporte de Oxígeno
Muchos microorganismos y la mayoría de los animales obtienen energía por respiración, la oxidación de moléculas orgánicas o inorgánicas por O 2. A 25°C, sin embargo, la concentración de oxígeno disuelto en el agua en contacto con el aire es solo de aproximadamente 0.25 mM. Debido a su alta relación de superficie a volumen, los microorganismos aeróbicos pueden obtener suficiente oxígeno para la respiración por difusión pasiva de O 2 a través de la membrana celular. A medida que aumenta el tamaño de un organismo, sin embargo, su volumen aumenta mucho más rápidamente que su superficie, y la necesidad de oxígeno depende de su volumen. En consecuencia, a medida que un organismo multicelular crece, su necesidad de O 2 supera rápidamente el suministro disponible a través de la difusión. A menos que se disponga de un sistema de transporte que proporcione un suministro adecuado de oxígeno a las células interiores, los organismos que contengan más de unas pocas células no pueden existir. Además, O 2 es un oxidante tan potente que las reacciones de oxidación utilizadas para obtener energía metabólica deben controlarse cuidadosamente para evitar liberar tanto calor que el agua en la célula hierve. En consecuencia, en organismos de nivel superior, el aparato respiratorio se localiza en compartimentos internos llamados mitocondrias, que son las centrales eléctricas de una célula. Por lo tanto, el oxígeno debe transportarse no solo a una celda sino también al compartimento adecuado dentro de una celda.
Tres soluciones químicas diferentes al problema del transporte de oxígeno se han desarrollado de manera independiente en el curso de la evolución, como se indica en el Cuadro 26.8.13. Mamíferos, aves, reptiles, peces y algunos insectos utilizan una proteína hemo llamada hemoglobina para transportar oxígeno de los pulmones a las células, y utilizan una proteína relacionada llamada mioglobina para almacenar temporalmente oxígeno en los tejidos. Varias clases de invertebrados, incluyendo gusanos marinos, utilizan una proteína que contiene hierro llamada hemeritrina para transportar oxígeno, mientras que otras clases de invertebrados (artrópodos y moluscos) utilizan una proteína que contiene cobre llamada hemocianina. A pesar de la presencia del prefijo hem, la hemeritrina y la hemocianina no contienen un complejo metal-porfirina.
Cuadro 26.8.13 Algunas propiedades de las tres clases de proteínas transportadoras de oxígeno
| Proteína | Fuente | M por Subunidad | M por O 2 Encuadernado | Color (forma desoxídica) | Color (forma oxy) |
|---|---|---|---|---|---|
| hemoglobina | mamíferos, aves, peces, reptiles, algunos insectos | 1 Fe | 1 Fe | Rojo-Morado | rojo |
| hemeritrina | gusanos marinos | 2 Fe | 2 Fe | incoloro | rojo |
| hemocianina | moluscos, crustáceos, arañas | 2 Cu | 2 Cu | incoloro | azul |
Mioglobina y Hemoglobina
La mioglobina es una proteína relativamente pequeña que contiene 150 aminoácidos. La unidad funcional de la mioglobina es un complejo hierro-porfirina que está incrustado en la proteína (Figura 26.8.1). En la mioglobina, el hierro hemo es de cinco coordenadas, con solo un solo ligando histidina-imidazol de la proteína (llamado histidina proximal porque está cerca del hierro) además de los cuatro átomos de nitrógeno de la porfirina. Una segunda histidina imidazol (la histidina distal porque está más distante del hierro) se localiza en el otro lado del grupo hemo, demasiado lejos del hierro para unirse a él. En consecuencia, el átomo de hierro tiene un sitio de coordinación vacante, que es donde se une O 2.
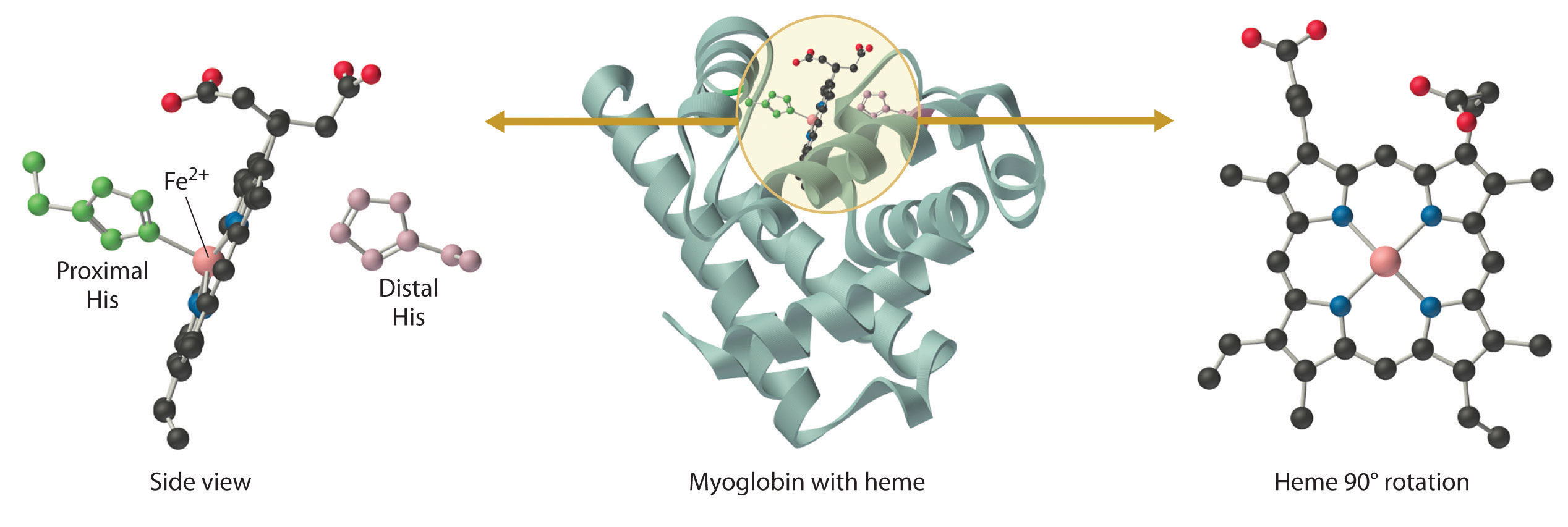
Figura 26.8.1: La estructura de la desoximioglobina, mostrando el grupo hemo. El hierro en la desoximioglobina es de cinco coordenadas, con un ligando histidina-imidazol de la proteína. El oxígeno se une en el sitio vacante sobre hierro.
En la forma ferrosa (desoximioglobina), el hierro es de cinco coordenadas y alto espín. Debido a que el Fe 2 + de alto espín es demasiado grande para caber en el “agujero” en el centro de la porfirina, está aproximadamente a las 60 pm por encima del plano de la porfirina. Cuando O 2 se une a la desoximioglobina para formar oximioglobina, el hierro se convierte de cinco coordenadas (espín alto) a seis coordenadas (espín bajo; Figura 26.8.2). Debido a que el Fe 2 + y el Fe 3 + de espín bajo son más pequeños que el Fe 2 + de alto espín, el átomo de hierro se mueve hacia el plano del anillo de la porfirina para formar un complejo octaédrico. La presión de O 2 a la que la mitad de las moléculas en una solución de mioglobina se unen a O 2 (P 1 /2) es de aproximadamente 1 mm Hg (1.3 × 10 −3 atm).
afinidad inalterada, lo cual es importante porque el monóxido de carbono se produce continuamente en el cuerpo por la degradación del ligando de porfirina (incluso en los no fumadores). En condiciones normales, el CO ocupa aproximadamente 1% de los sitios hemo en la hemoglobina y la mioglobina. Si la afinidad de la hemoglobina y la mioglobina por CO fuera 100 veces mayor (debido a la ausencia de la histidina distal), esencialmente el 100% de los sitios hemo estarían ocupados por CO, y no se podría transportar oxígeno a los tejidos. La intoxicación grave por monóxido de carbono, que frecuentemente es mortal, tiene exactamente el mismo efecto. Así, la función primaria de la histidina distal parece ser disminuir la afinidad de CO de la hemoglobina y la mioglobina para evitar la autointoxicación por CO.

