2.1: Interacciones de Radiación Electromagnética y Electrones en Moléculas
- Page ID
- 76790
Ahora vamos a extender esta idea de átomos a moléculas. Así como los electrones ocupan orbitales atómicos en átomos, los electrones en las moléculas ocupan orbitales moleculares. \[\left. A+hv \rightarrow A^{*}(\text { excited state }) \rightarrow A \text { (ground state }\right)+hv\]
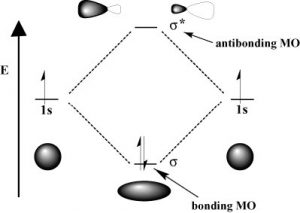
Al igual que con los orbitales atómicos, los electrones en los orbitales moleculares pueden absorber o liberar fotones de una energía específica a medida que se mueven de un orbital molecular a otro. Sin embargo, existe una diferencia significativa entre el proceso de absorción/emisión en átomos aislados (o iones) versus el de las moléculas. Cuando un electrón es promovido a un nivel de energía más alto en un átomo, el producto es un átomo en un estado excitado, generalmente el átomo excitado (o ion) decaerá de nuevo al estado fundamental emitiendo un fotón (\(\downarrow\)). Sin embargo, cuando un electrón dentro de una molécula es excitado se mueve (o es “promovido”) de su orbital molecular original a otro. Ahora hay una serie de consecuencias diferentes que pueden ocurrir. Por ejemplo, si el electrón absorbe un fotón y es promovido de un orbital molecular de enlace a un orbital antienlace, el resultado será que el enlace se romperá, ya que ahora no hay interacción estabilizadora global. Considera\(\mathrm{H-H}\), que es la molécula más simple posible. El conjunto de orbitales moleculares para hidrógeno incluye un enlace\(\sigma\) (sigma) y un orbital\(\sigma^{\star}\) antienlace. En el estado de tierra (o de menor energía), el hidrógeno molecular tiene un orbital de\(\sigma\) enlace que contiene ambos electrones de la molécula. Si uno de los electrones de unión absorbe un fotón que tiene la cantidad justa de energía (la diferencia de energía entre el orbital de enlace y antienlace) se promoverá y se moverá hacia el orbital antienlace desestabilizado, lo que hará que el enlace entre los átomos se rompa porque ahora no hay unión general interacción. Como se podría imaginar, si los enlaces químicos fueran susceptibles de romperse simplemente por estar expuestos a radiación electromagnética de baja energía (como la de la luz visible) el mundo sería un lugar diferente (y bastante aburrido). Por ejemplo, la vida no sería posible ya que depende de la estabilidad de las moléculas. De hecho, la energía de los fotones requerida para provocar la ruptura del vínculo es bastante grande. Por ejemplo, la energía requerida para romper un\(\mathrm{H-H}\) enlace (la energía de enlace) es\(436 \mathrm{kJ} / \mathrm{mol} \text {. }\). Si se calcula la longitud de onda de un fotón que podría entregar esta cantidad de energía, la cantidad de energía requerida para romper un\(\mathrm{H-H}\) enlace estaría en la sección UV lejana del espectro electromagnético (~280nm). El enlace covalente\(\sigma\) (o sencillo) típicamente fuerte requiere fotones de bastante alta energía para romperlos.
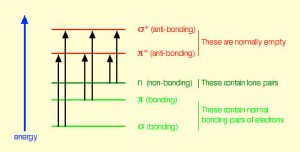
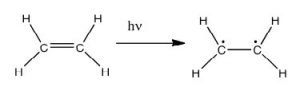
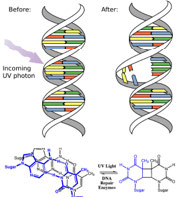
De hecho, la atmósfera terrestre bloquea la mayoría (\(>98 \%\)) fotones de alta energía (ultravioleta) y las moléculas biológicamente más importantes no pueden absorber la luz visible, así que eso nos deja con la pregunta de por qué hay necesidad de protector solar, que filtra los fotones UV A (400 - 315 nm) y UV B (315 - 280 nm) . La respuesta es que una serie de moléculas biológicas contienen más que simples enlaces sigma. Por ejemplo, la mayoría de las moléculas biológicas complejas también contienen enlaces\(\pi\) (pi) y electrones no enlazantes además de\(\sigma\) enlaces; se pueden observar transiciones entre estos orbitales. Las brechas de energía entre estos diferentes orbitales son bastante menores que la brecha de energía\(\sigma-\sigma\) *. Los fotones con suficiente energía para provocar estas transiciones de electrones están presentes en la luz solar. Por ejemplo, un doble enlace implica típicamente tanto un\(\sigma\) enlace como un\(\pi\) enlace. La absorción de un fotón que promovería un electrón de un\(\pi\) orbital de\(\pi^{\star}\) enlace a un orbital antienlace tendría el efecto de romper el enlace pi original. Una forma de representar esto se muestra aquí (\(\rightarrow\)). En este caso, uno de los electrones que estaba en el enlace pi se encuentra ahora en el orbital antienlace pi* de alta energía y es mucho más reactivo. Otra forma de pensarlo es que los electrones ahora están desapareados, y es mucho más probable que reaccionen para formar una entidad más estable. [1] Una manera obvia de recuperar la estabilidad es que el electrón en el orbital\(\pi\) antienlace vuelva a caer al nivel de energía de unión y emita un fotón de la misma energía, y en la mayoría de los casos esto es lo que sucede, en última instancia, sin causar daño. (Como veremos más adelante, dado que los dobles enlaces están rotacionalmente restringidos, otra posible ocurrencia es que puede haber rotación alrededor del enlace sencillo [\(\sigma\)]) y luego la reforma del\(\pi\) enlace, conduciendo a un isómero del alqueno original). Sin embargo, en algunos casos, si hay otra especie potencialmente reactiva en la proximidad, pueden ocurrir reacciones entre moléculas (o en el caso de macromoléculas biológicas, entre distintas regiones de estas moléculas) y causar problemas. Por ejemplo: la mayoría de nosotros somos conscientes de que la exposición al sol provoca daños en la piel que pueden llevar al cáncer de piel. Un mecanismo importante ocurre en el ADN donde dos bases de timidina están adyacentes entre sí. Un fotón UV puede ser absorbido por un enlace pi en una base de timina. Este enlace pi roto (y el electrón desapareado resultante) es muy reactivo. Puede reaccionar con un enlace pi en una timina adyacente conduciendo a un nuevo enlace, una reacción que produce un anillo de carbono de cuatro miembros, conocido como dímero de timina. La maquinaria de replicación del ADN no puede replicar con precisión una secuencia que contiene un dímero de timina, lo que resulta en un cambio en la secuencia de ADN, una mutación. Las mutaciones de este tipo son un paso temprano común en la generación de células cancerosas de la piel (carcinomas) y células pigmentarias (melanomas). [2]
Un ejemplo más benigno de absorción de fotones en sistemas biológicos subyace al mecanismo por el cual nosotros (y otros organismos) detectamos la luz, ¡así es como podemos ver las cosas! Si bien originalmente se pensaba (al menos por algunos) que la visión involucraba rayos emitidos por los ojos, [3] ahora entendemos que para ver necesitamos detectar fotones que son reflejados o emitidos por los objetos que nos rodean. El proceso comienza cuando los fotones de luz caen sobre las células conocidas como fotorreceptores. A nuestros ojos, estas células se encuentran dentro de la retina: una lámina de células que recubren la superficie interior del ojo. Dentro de un subconjunto de células retinianas hay varios tipos diferentes de moléculas que contienen enlaces pi. Estas moléculas son proteínas conocidas genéricamente como opsinas. Una opsina está compuesta por un polipéptido (o apoproteína) que se une covalentemente a otra molécula, 11-cis-retinal. [4]
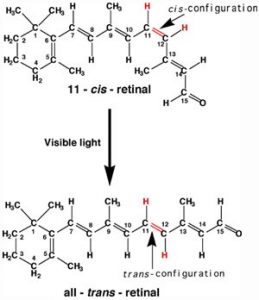
Esta molécula se deriva de la vitamina A (todo-trans-retinal). El complejo de apoproteína y retinal es la proteína opsina funcional. Hay una serie de diferentes componentes de opsina que influyen en la longitud de onda de los fotones absorbidos por la proteína opsina funcional. Cuando se absorbe un fotón, promueve un electrón de uno de los enlaces pi de la retina a un orbital antienlace. En lugar de reaccionar con otra molécula, como la timina, hay una rotación alrededor del enlace simple restante (sigma), y luego la formación de un nuevo enlace pi, esto conduce a la isomerización de la forma 11-cis original en el isómero trans. Este cambio en la forma de la retina influye en la forma de la proteína opsina que inicia una cascada de eventos electroquímicos que transportan señales al resto del cerebro (la retina se considera una extensión del cerebro) que finalmente son reconocidas como entrada visual.


