2.2: Espectroscopia UV-Vis y Chormophores - o ¿Por qué las zanahorias son naranjas?
- Page ID
- 76778
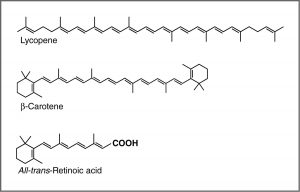
Una recomendación común de los médicos es que comamos muchas frutas y verduras altamente coloreadas. Los compuestos que dan a estos alimentos su color fuerte tienen una serie de puntos en común. Por ejemplo, el compuesto que le da a las zanahorias y batatas su distintivo color naranja es el betacaroteno. Bien podría notar su similitud con la retina. El compuesto que contribuye al color rojo de los tomates es el licopeno. Las moléculas de este tipo se conocen genéricamente como pigmentos.
Las longitudes de onda a las que un compuesto absorbe la luz depende de la brecha de energía entre los orbitales que están involucrados en la transición. Esta brecha de energía está determinada por la estructura de la molécula. Una molécula con solo enlaces simples absorbe la luz a longitudes de onda más cortas (en los UV de alta energía), mientras que patrones de unión más complejos están asociados con la absorción de luz visible. Por ejemplo, la presencia de múltiples enlaces pi y sus interacciones dentro de la molécula pueden afectar la brecha de energía entre los orbitales moleculares. Recordemos nuestra discusión sobre el grafito. En lugar de pensar en el grafito como láminas de anillos fusionados de seis miembros con enlaces simples y dobles alternantes, podemos pensar en cada enlace como un enlace sigma localizado y un enlace pi deslocalizado. Hay un gran número de orbitales moleculares pi repartidos por toda la lámina de átomos de carbono. Cuantos más pi MO haya, más disminuye la brecha de energía entre estos orbitales; es decir, menos energía (luz de longitud de onda más larga) se necesita para mover un electrón de un orbital pi a pi*. En el caso de las sustancias de red como el grafito y los metales, la brecha energética entre los orbitales se vuelve insignificante, y pensamos en el modelo de unión como una banda de orbitales moleculares. En estos casos, muchas longitudes de onda de luz pueden ser absorbidas y luego reemitidas lo que le da al grafito y a los metales su brillo característico. En sustancias como el licopeno o\(\beta\)-carotene we also find this pattern of alternating single and double bonds. We say that compounds with this pattern of alternating single and double bonds (e.g. \(\mathrm{-C=C-C=C-}\)) are conjugated, and we can model the bonding in the same way as graphite. There are pi MO’s that can extend over the region of the molecule, and the more orbitals there are, the closer together in energy they get.
Para un\(\mathrm{C=C}\) doble enlace aislado, la energía requerida para promover un electrón del orbital pi al pi* corresponde a la luz en la región UV (alrededor de 170 nm), pero a medida que aumenta el número de dobles enlaces que se conjugan (separados por enlaces simples), la brecha de energía entre los más altos ocupados orbital molecular (HOMO) y el orbital molecular desocupado más bajo (LUMO) disminuye. Finalmente, la longitud de onda de la luz necesaria para promover un electrón del HOMO al LUMO se mueve hacia la región visible, y la sustancia se vuelve coloreada. (Tenga en cuenta que no se convierte en el color de la luz que se absorbe, sino en la luz restante que se transmite o refleja). Estas regiones conjugadas de moléculas se denominan cromóforos. [5] Cuanto más larga sea la sección conjugada de la molécula, mayor será la longitud de onda de la luz que absorbe. Notarás que tanto el licopeno como el\(\beta\) -caroteno contienen grandes regiones cromóforos.
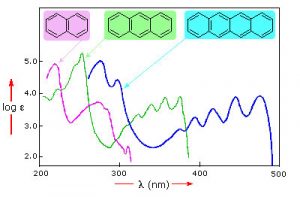
Aquí se muestran muestras de espectros de absorción UV-VIS. Nótese que en contraste con los espectros de absorción atómica que vimos anteriormente (que consistían en líneas nítidas correspondientes a la longitud de onda de la luz absorbida por los átomos) estos espectros son amplios y mal definidos. Además, se puede ver que cuanto más largo (más grande) es el cromóforo, más larga es la longitud de onda que se absorbe, y cada uno de estos compuestos parece ser de un color diferente. El hecho de que los picos en estos espectros no sean agudos significa que la espectroscopia UV-VIS normalmente no se usa para la identificación de compuestos (ver a continuación para la espectroscopia IR y RMN que se puede usar para este propósito). Sin embargo, la cantidad de luz absorbida es proporcional a la concentración de la sustancia y, por lo tanto, se puede utilizar la espectroscopia UV-VIS para determinar la concentración de muestras.
Preguntas a Responder:
- Construye una representación que pueda ayudarte a explicar por qué los compuestos con cromóforos más largos absorben fotones de menor energía que aquellos con cromóforos más cortos
- ¿Qué compuesto crees que absorbe fotones de la luz de menor energía? Explica tu razonamiento, usando un diagrama orbital molecular para ilustrar.