3.1: Conformas de Moléculas Orgánicas
- Page ID
- 77023
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Si bien la mayoría de los enlaces\(\mathrm{C-C}\) simples permiten la rotación libre, existen costos de energía asociados con tales rotaciones que surgen del hecho de que a medida que los carbonos giran alrededor del eje del enlace, la distancia entre los grupos unidos a cada carbono (incluso si son hidrógenos) cambia. Para comprender las implicaciones de esta distancia cambiante entre estos grupos, recordemos nuestras discusiones anteriores sobre las fuerzas de dispersión londinenses y las interacciones de van der Waals. [2] A medida que dos átomos, moléculas o grupos no cargados dentro de una molécula se acercan entre sí, inicialmente hay una atracción entre ellos debido a los dipolos instantáneos e inducidos en sus nubes de electrones (fuerzas de dispersión de Londres). Si las moléculas (o partes de una molécula) también tienen un dipolo permanente (es decir, la molécula es polar), entonces hay una interacción adicional atractiva (o repulsiva) en forma de interacciones dipolo-dipolo y enlaces de hidrógeno. Las interacciones atractivas conducen a una disminución de la energía potencial del sistema y las interacciones repulsivas conducen a un aumento. Incluso cuando la interacción es atractiva, a medida que las moléculas que interactúan (o regiones de moléculas) se acercan, las interacciones repulsivas entre sus nubes de electrones aumentan y la energía potencial del sistema aumenta. Esto da lugar a la curva familiar (o al menos debería ser familiar) de energía potencial v distancia que hemos encontrado muchas veces en CLUE.

Si bien hemos discutido previamente este cambio en la energía potencial para moléculas separadas (y átomos), los mismos principios se aplican a medida que las partes de las moléculas se acercan entre sí, por ejemplo, debido a las rotaciones alrededor de los enlaces\(\mathrm{C-C}\) sigma. Las diferentes estructuras rotacionales de una molécula se denominan conformaciones, y una de las mejores formas de representar diferentes conformaciones posibles se llama proyección de Newman. En una representación de Newman, miramos hacia abajo el\(\mathrm{C-C}\) vínculo de interés; esto tiene el efecto de hacer que los grupos (átomos, etc.) unidos a cada carbono (conocidos como sustituyentes) parezcan estar en ángulos entre sí (esto se debe a la perspectiva desde la cual estamos viendo la molécula; el enlace\(120^{\circ}\) los ángulos siguen\(109^{\circ}\)). Si imaginamos que los carbonos giran uno con respecto al otro, podemos ver cómo las distancias relativas entre los grupos en cada carbono cambian con el “ángulo diedro” entre los sustituyentes en los carbonos frontal y posterior. Las dos conformaciones que se muestran para el etano son la conformación completamente eclipsada, donde el ángulo diedro es igual a\(0^{\circ}\), y la conformación escalonada, donde está el ángulo diedro\(60^{\circ}\). A medida que continúa la rotación alrededor del\(\mathrm{C-C}\) enlace, estas dos conformaciones se repiten.
Con base en estudios de RMN a baja temperatura, estas dos conformaciones no son igualmente estables, la conformación escalonada es aproximadamente\(13.8 \mathrm{~kJ} / \mathrm{mol}\) más estable que la conformación eclipsada. A temperatura ambiente, esta diferencia de energía es insignificante, es decir, una colisión molecular típica suministra mucha más energía, y las dos conformaciones se interconvierten rápidamente entre sí. A medida que la muestra se enfría, sin embargo, la energía disponible de las colisiones se reduce (porque las moléculas se mueven más lentamente) y de hecho podemos encontrar, a partir de estudios de RMN, que podemos ver diferentes conformaciones presentes en diferentes proporciones, en parte porque en la conformación eclipsada los hidrógenos en los dos carbonos se acercan más a sus radios van der Waals y así comienzan a repelerse entre sí, elevando la energía potencial de la molécula.
Energía Potencial v Ángulo Diedro para Butano
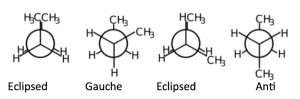
Si miramos el butano (\(\rightarrow\)) hacia abajo en el eje del\(\mathrm{C}2\mathrm{-C} 3\) enlace podemos ver una versión más exagerada de esta repulsión debido a la presencia de los grupos metilo más voluminosos. Hay dos tipos de conformaciones eclipsadas, y dos tipos de conformaciones escalonadas: la anti conformación donde los grupos metilo son uno\(180^{\circ}\) del otro, y la conformación gauche donde están\(60^{\circ}\) separados. Si trazamos sus energías relativas vs ángulo diedro podemos ver cómo cambia la energía potencial a medida que los centros más grandes de densidad electrónica (los grupos metilo) se acercan entre sí. La conformación anti es la más estable y la conformación del grupo metilo eclipsado es la menos estable. Nuevamente, estas diferencias energéticas no son del todo tan grandes. La diferencia entre la conformación eclipsada de mayor energía y la anti conformación de menor energía es aproximadamente\(21 \mathrm{~kJ} / \mathrm{mol}\), lo que no es una barrera lo suficientemente grande como para evitar la rotación a temperatura ambiente.

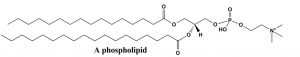
Al aplicar estas ideas, también podemos predecir conformaciones de alcanos de cadena larga. Por lo general, dibujamos alcanos de cadena larga en la conformación más estable (todo-"anti”), pero hay ocasiones en las que la conformación gauche también está presente, el resultado de esta conformación es una curva o torcedura en la cadena. Esto tiene implicaciones sobre cómo los grupos alquilo de cadena larga interactúan entre sí e influye en las propiedades físicas de las moléculas, como el punto de fusión. Muchas moléculas lipídicas significativas desde el punto de vista biológico contienen grupos alcanos de cadena larga. Por ejemplo, los fosfolípidos forman la base estructural de las membranas biológicas. Estos lípidos son un componente importante de la membrana celular que es la barrera permeable que rodea a la célula. Los ácidos grasos de cadena larga que componen la membrana se encuentran típicamente en la conformación totalmente anti, que no solo es la conformación de menor energía, sino que también genera la mayor superficie. Si las cadenas largas estuvieran en la conformación gauche, estarían más agrupadas y tendrían una superficie más baja. Tener una gran superficie significa que es más probable que las cadenas se atraigan entre sí por las fuerzas de dispersión de Londres, lo que también estabiliza la estructura de la membrana.
Preguntas para responder
- Construya una explicación de por qué la energía potencial del etano cambia a medida que gira alrededor del\(\mathrm{C-C}\) enlace. ¿Cuál es la interacción que está elevando la energía potencial? ¿De dónde viene la energía, para que pueda ocurrir la rotación alrededor del\(\mathrm{C-C}\) enlace?
- Construya un diagrama de ángulo diedro de energía potencial v para propano, mientras mira hacia abajo el\(\mathrm{C}1\mathrm{-C} 2\) enlace. Etiquetar los máximos y mínimos con las proyecciones correspondientes de Newman.
- Dibuje una imagen esquemática de una bicapa lipídica compuesta por fosfolípidos (sin necesidad de dibujar cada enlace y átomo). ¿Cuál sería el efecto si los\(\mathrm{C-C}\) enlaces en los fosfolípidos tomaran la conformación gauche menos estable?
Conformaciones de compuestos cíclicos
Como veremos, los compuestos cíclicos muestran algunos de los mismos tipos de cambios energéticos con rotaciones alrededor de los\(\mathrm{C-C}\) enlaces; las conformaciones cambian de eclipsadas a escalonadas. Sin embargo, cuando la molécula es cíclica entran en juego otros dos factores y complican un poco las cosas. La primera es que, por su propia naturaleza, los compuestos de anillo están más restringidos; no es posible hacer una\(360^{\circ}\) rotación completa alrededor de los\(\mathrm{C-C}\) enlaces sin romper un enlace covalente (que requiere más energía de la disponible a través de colisiones térmicas). Sin embargo, existe una gama de rotaciones por las que la mayoría de los compuestos de anillo pueden moverse. El otro factor involucra anillos que tendrían ángulos de enlace que son inconsistentes con el ángulo de\(\sim 109^{\circ}\) enlace que generalmente se encuentra para los carbonos\(\mathrm{sp}^{3}\) hibridados.

Por ejemplo, considere los\(\mathrm{C-}3\) a\(\mathrm{C-}6\) cicloalcanos (\(\rightarrow\)). Podemos calcular los ángulos de unión para estos poliedros regulares si fueran planos, es decir, bidimensionales: oscilarían desde\(60^{\circ}\) ciclopropano hasta\(120^{\circ}\) ciclohexano, ambos muy fuera del rango de ángulos de\(\mathrm{sp}^{3}\) enlace. No es sorprendente que los cicloalcanos se comporten de diferentes maneras para minimizar la tensión impuesta por ambos ángulos de unión y las restricciones en la rotación del enlace. Esta deformación del anillo se puede determinar experimentalmente midiendo los calores de combustión de los cicloalcanos: la energía liberada por esta reacción es un indicador de la estabilidad del cicloalcano particular. Para comparar entre cicloalcanos, necesitamos calcular el calor de combustión por\(\mathrm{CH}_{2}\) grupo, y como veremos en breve, los anillos de seis miembros no tienen, de hecho, ninguna tensión de anillo por lo que podemos determinar las estabilidades de anillos de diferente tamaño en comparación con el ciclohexano.
|
Cicloalcano |
Calor de combustión (\(\mathrm{kJ} / \mathrm{mol}\)) |
Calor de combustión por\(\mathrm{CH}_{2}\) (\(\mathrm{kJ} / \mathrm{mol}\)) |
Deformación del anillo en comparación con\(\mathrm{C}_{6} \mathrm{H}_{12}\) (\(\mathrm{kJ} / \mathrm{mol}\)) |
Deformación total del anillo \(= \text { Ring strain } \times \# \text { of } \mathrm{CH}_{2}\)(\(\mathrm{kJ} / \mathrm{mol}\)) |
|
C 3 H 6 |
-499.8 |
-166.3 |
9.2 |
27.6 |
|
C 4 H 8 |
-655.9 |
-164 |
6.6 |
26.4 |
|
C 5 H 10 |
-793.5 |
-158.7 |
1.3 |
6.5 |
|
C 6 H 12 |
-944.5 |
-157.4 |
0 |
0 |
Calores de Combustión para los Cicloalcanos
El ciclopropano es en realidad el peor de los casos: tiene la tensión más alta porque se ve obligado a existir como un\(2\mathrm{-D}\) anillo plano (ya que tres puntos definen un plano). Si miramos una proyección Newman de ciclohexano podemos ver que todos los\(\mathrm{C-C}\) enlaces\(\mathrm{C-H}\) y están eclipsados, lo que eleva la energía potencial de la molécula.

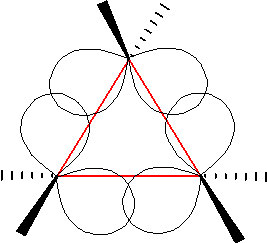
En un intento de aliviar parte de la tensión impuesta por tener un ángulo de\(60^{\circ}\) unión, el ciclopropano tiene enlaces doblados (a veces llamados enlaces de banano). La densidad de electrones sobresale en lugar de ubicarse entre los dos carbonos, lo que hace que el ángulo de enlace sea un poco más grande, sin embargo, todavía hay una tensión considerable. La combinación de ángulo y deformación eclipsante (también llamada tensión torsional) explica por qué el ciclopropano es una especie mucho más reactiva que su análogo de cadena recta, el propano. Hay algunos compuestos de anillo de tres miembros que ocurren naturalmente, pero en general son bastante reactivos químicamente ya que la estructura del anillo es bastante inestable. Los anillos de cuatro miembros son más estables, tienen menos deformación angular porque el anillo es más grande y porque el anillo más grande puede doblarse un poco, lo que tiene el efecto de aliviar parte de la tensión torsional. A temperatura ambiente, el anillo de ciclobutano se dobla constantemente para que cada carbono pueda ser relevado de un poco de la tensión. Hay una serie de compuestos de anillo de cuatro miembros importantes con los que puede haber encontrado: los antibióticos penicilina (1) y cefalosporina (2) tienen un anillo de amida de cuatro miembros como parte de su estructura (à). Normalmente (como veremos), los grupos amida son relativamente estables (químicamente no reactivos), pero debido a que esta amida en la estructura del anillo está restringida en un anillo de alta energía, de cuatro miembros, es mucho más reactiva de lo normal. Los antibióticos actúan apuntando a alguna parte de la bioquímica de las bacterias que no afectarán al organismo huésped (nosotros). Estos antibióticos interfieren con la síntesis y replicación de la pared celular microbiana, que es una estructura tipo que la mayoría de los animales no tienen (tenemos membranas celulares).


La estabilidad del anillo mejora con ciclopentano. Si la molécula fuera plana, tendría casi exactamente los ángulos de\(\mathrm{sp}^{3}\) enlace entre los carbonos del anillo; esto significaría, sin embargo, que todos los enlaces estarían en la conformación eclipsada y la energía torsional resultante sería alta. Para aliviar la tensión torsional, la molécula se dobla en una secuencia de formas tipo “envolvente”, nuevamente en movimiento dinámico y rápido para reducir la energía asociada con la conformación eclipsada.

Esto nos lleva al ciclohexano, los “ricitos de oro” de los cicloalcanos. La flexión de la molécula de ciclohexano puede aliviar completamente todas las deformaciones angulares y torsionales. De hecho, el ciclohexano es tan estable como el hexano—no hay ninguna cepa de anillo asociada con un anillo de seis miembros. La conformación más estable del ciclohexano se conoce como la conformación de la silla, porque uno podría imaginarlo como una silla con reposapiés, asiento y respaldo. En la conformación de la silla todos los enlaces están escalonados, y todos los ángulos de unión lo son\(109^{\circ}\).

Los grupos unidos al anillo de ciclohexano pueden asumir dos tipos de posiciones: las posiciones que parecen apuntar hacia arriba o hacia abajo se llaman axiales, y las que están más en el plano del anillo se llaman ecuatoriales. En cada carbono, hay una posición axial y una ecuatorial como se muestra (\(\uparrow\)).

Las conformaciones de la silla pueden “voltear” como se muestra a continuación. Aquí la estructura de la izquierda tiene todas las posiciones axiales en azul y la ecuatorial en rojo. Al igual que con los otros anillos, el anillo está en constante movimiento y los enlaces están girando (en la medida de lo posible dentro de los confines del anillo) de manera que el anillo se “volteará” de un lado a otro entre las conformaciones de la silla, al llevar la silla hacia atrás hacia abajo y el reposapiés hacia arriba. Cuando esto sucede, los sustituyentes axiales se convierten en ecuatorial y viceversa. Vale la pena señalar que los componentes axiales pueden estar “por encima” o “debajo” del plano del anillo; y las posiciones ecuatoriales también están por encima o por debajo del plano, pero en promedio se encuentran en el plano del anillo. La otra cosa a notar es que si bien los grupos pueden voltear entre axial y ecuatorial, no voltean de arriba a abajo. Es decir, un sustituyente axial por encima del plano se convierte en un sustituyente ecuatorial por encima del plano.

Hay una serie de conformaciones entre una conformación de silla y otra, por ejemplo la conformación de barco (\(\rightarrow\)). Esta es una especie de mucha más alta energía ya que muchos de los enlaces están eclipsados y hay una fuerte repulsión de las H's en la posición 1 y 4.
Ciclohexanos monosustituidos:
Consideremos ahora metilciclohexano, el grupo metilo puede ser axial o ecuatorial. Cuando miramos las proyecciones de Newman vemos que el grupo metilo ecuatorial se encuentra en una posición más estable, es anti al\(\mathrm{C-C}\) enlace en el anillo, mientras que un grupo axial es gauche al\(\mathrm{C-C}\) enlace del anillo. 
Metilciclohexano ecuatorial
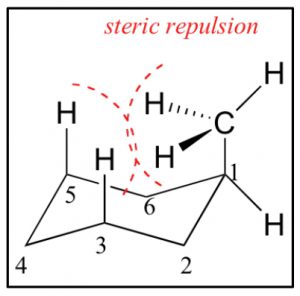

Además, un grupo metilo axial también está cerca de los hidrógenos axiales en los carbonos 3 y 5 en lo que se llama interacción diaxial 1.3, lo que introduce otra fuente de tensión. Por lo tanto, la conformación más estable es siempre ecuatorial.
Metilciclohexano axial
Para un grupo metilo la diferencia de energía sigue siendo bastante pequeña, y tanto axial como ecuatorial están presentes a temperatura ambiente, pero a medida que se introducen grupos más voluminosos en el anillo, la preferencia por ecuatorial se vuelve aún más fuerte. Por ejemplo, los anillos de ciclohexano con grupos isopropilo (\(-\mathrm{CH}\left(\mathrm{CH}_{3}\right)_{2}\)) o t-butilo (\(-\mathrm{CH}\left(\mathrm{CH}_{3}\right)_{2}\)) están bloqueados en conformaciones donde estos grupos son ecuatoriales.
Ciclohexanos disustituidos:

Cuando llegamos a anillos de ciclohexano que tienen dos (o más) sustituyentes, debemos considerar si los sustituyentes están en los mismos lados (cis) u opuestos (trans) del anillo. Esto es más fácil de ver si primero dibujamos el anillo plano y usamos una representación de guiones de cuña para mostrar las posiciones relativas de los grupos. En estas representaciones no sabemos si los grupos metilo se orientan en configuraciones axiales o ecuatoriales (pero podemos resolverlo), pero lo que sí sabemos es que estos son compuestos diferentes, no pueden ser interconvertidos por volteretas de anillo como axiales e ecuatoriales, que son conformaciones del mismo compuesto. Para interconvertir tendríamos que romper los\(\mathrm{C-C}\) lazos en el cuadrilátero. Estos dos compuestos se denominan isómeros geométricos, tienen la misma fórmula molecular y conectividad, pero sus átomos tienen una relación diferente (permanente) en el espacio (una geometría diferente).

Podemos determinar las conformaciones reales que cada isómero puede tomar dibujando la representación de la silla, y podemos voltear el anillo para encontrar la conformación más estable. Recuerda que ecuatorial siempre es favorecido, así que cuando hacemos esto podemos ver que el isómero trans tiene una conformación en la que ambos grupos metilo son ecuatoriales; mientras que la conformación cis tiene ambas conformaciones donde uno es axial y otro es ecuatorial. Por lo tanto, podemos concluir que el isómero trans es más estable que el cis. Tenga en cuenta que los grupos no cambian su relación cis o trans cuando el anillo se voltea.
Es posible hacer este tipo de análisis para ciclohexanos 1,3- y 1,4-disustituidos, e incluso para sustancias más complejas. Por ejemplo, la mayoría de los azúcares existen realmente como estructuras de anillo en las que los muchos grupos alcohol (que son más grandes que el hidrógeno) ocupan la posición ecuatorial. Por ejemplo, la glucosa existe como anillos cíclicos de seis miembros (uno de los átomos es un oxígeno pero el principio es el mismo).
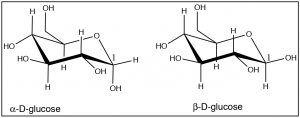
Observe cómo casi todos los\(\mathrm{OH}\) grupos toman la posición ecuatorial, excepto el\(\mathrm{OH}\) grupo\(\mathrm{C-}1\) en\(\alpha\) -D-glucosa. Estas dos formas de glucosa son en realidad compuestos separados. No es posible convertir\(\alpha\) -D-glucosa en\(\beta\) -D-Glucosa simplemente por un anillo volteo (convencerse de que esto es cierto haciendo modelo). Veremos mucho más de estas moléculas cíclicas de azúcar más adelante en el curso.
Preguntas para responder
- Use excel para trazar la deformación total del anillo vs el tamaño del anillo (número de\(\mathrm{CH}_{2}\) unidades) como se muestra en la Tabla 1. Además, use estos valores de deformación total del anillo para\(\mathrm{C}_{7} \mathrm{H}_{14}\) (\(6.3 \mathrm{~kJ} / \mathrm{mol})\)), y\(\mathrm{C}_{8} \mathrm{H}_{16}\) (\(9.6 \mathrm{~kJ} / \mathrm{mol})\)),\(\mathrm{C}_{9} \mathrm{H}_{18}\) (\(12.6 \mathrm{~kJ} / \mathrm{mol})\)). ¿Qué tendencias ves? ¿Cómo los contabilizas?
- Dibuja dos formas de silla de ciclohexanol, ¿cuál es la más estable? ¿Es este un isómero geométrico o un isómero conformacional?
- Dibuja formas de silla de cis y trans -1,3-dimetilciclohexano y predice qué isómero geométrico es el más estable. Haga lo mismo para cis y trans -1,4-dimetilciclohexano.
- ¿Existe 1,5-dimetilciclohexano?


