4.4: Eliminaciones
- Page ID
- 76904
Los reordenamientos esqueléticos son un inconveniente de exponer los sustratos a condiciones en las que el grupo de salida se ioniza. Desafortunadamente, no son la única complicación —también existe la posibilidad de que ocurra otro tipo de reacción— una eliminación para producir un alqueno.
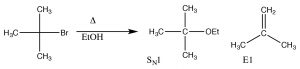
En este caso, la reacción procede a través del mismo carbocatión intermedio, y luego se elimina un protón de un carbono próximo al carbocatión (un\(\beta\) carbono).
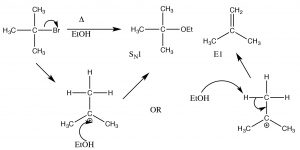
Una reacción de eliminación de E1
Esto se denomina reacción de eliminación, y es de primer orden ya que la etapa determinante de la velocidad es la formación del carbocatión, y por lo tanto es una\(\mathrm{E} 1\) reacción. De hecho,\(\mathrm{S}_{\mathrm{N} 1\) las reacciones suelen ir acompañadas de\(\mathrm{E} 1\) reacciones (y viceversa). Si existe la posibilidad de formar más de un alqueno (porque hay diferentes\(\beta\) carbonos), generalmente el alqueno más sustituido es el producto principal. [4] Por ejemplo, los alcoholes se someten a\(\mathrm{E} 1\) eliminaciones cuando se tratan con ácido sulfúrico concentrado. En este caso, no hay producto de sustitución debido a que el anión sulfato no es un buen nucleófilo (está altamente estabilizado por resonancia).
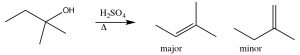
Aquí, el producto principal tiene tres grupos alquilo en el doble enlace, mientras que el producto menor solo tiene dos. De hecho, esta deshidratación catalizada por ácido de alcoholes es una reacción bastante útil sintéticamente, pero si el sustrato tiene el potencial de reordenamientos (es decir, el carbocatión resultante puede estabilizarse por un desplazamiento de hidruro o alquilo), entonces existe el potencial para la formación de aún más productos. Por ejemplo:
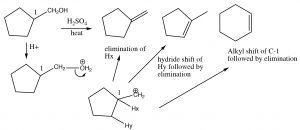
Eliminación y reordenamientos
Obviamente, este tipo de reordenamientos y eliminaciones no son sintéticamente útiles en sustratos que son propensos a reordenamientos esqueléticos. Sin embargo, existe una reacción de eliminación que normalmente nos proporciona mucho más control.
La\(\mathrm{E} 2\) Reacción.
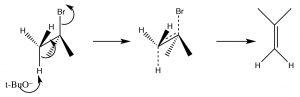
Como veremos en breve, la síntesis de alquenos por eliminación de\(\mathrm{H–L}\) (donde L es un grupo eliminable) es una reacción importante, pero es mucho más probable que tengamos control sobre los productos si la reacción no pasa por un carbocatión. Es decir, si podemos eliminar simultáneamente tanto al\(\mathrm{H}^{+}\) grupo como al grupo de salida hay menos posibilidades de reacciones secundarias. Esta reacción es una\(\mathrm{E} 2\) reacción (eliminación de segundo orden), y es promovida por la presencia de una base fuerte. Por ejemplo, la reacción del bromuro de t-butilo con hidróxido (o cualquier base fuerte), mostrada anteriormente. En este caso, hay poco producto de sustitución, y en su lugar la base elimina simultáneamente un protón del\(\beta\) carbono como se muestra.
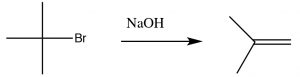
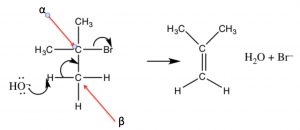
Una eliminación E2
Por lo tanto, la velocidad depende tanto del sustrato como de la base:\(\text { Rate }=k[\mathrm{RL}][\text{base}]\) —es decir, una reacción de segundo orden. Pero espera, ¿no vimos que las bases fuertes son buenos nucleófilos? Desde el inicio, hemos demostrado que los sustratos metílicos y primarios con nucleófilos fuertes experimentan\(\mathrm{S}_{\mathrm{N} 2\) reacciones. ¿Cómo podemos lograr una eliminación en este caso? Bueno, así como un sustrato con impedimento estérico no sufrirá una\(\mathrm{S}_{\mathrm{N} 2\) reacción, podemos usar una base estéricamente impedida para evitar tales reacciones. Si la base es demasiado voluminosa alrededor de su sitio reactivo, entonces no puede acercarse al sustrato en el centro electrófilo, y en su lugar recogerá un protón de uno de los\(\beta\) carbonos. Una de esas bases es la sal de t-butanol, t-butóxido de potasio (\(\mathrm{tBuOK}\)), que se utiliza para provocar\(\mathrm{E} 2\) eliminaciones de sustratos primarios y secundarios.
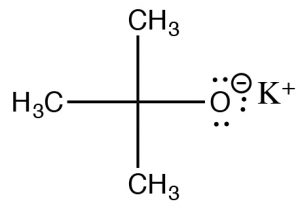
Al igual que con\(\mathrm{E} 1\) las reacciones, el doble enlace más sustituido es el producto principal:
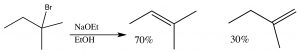
Otro factor que debe tenerse en cuenta en\(\mathrm{E} 2\) las reacciones es que para que ocurra tal reacción, el grupo lápida y el protón que se elimina deben estar en una orientación que permita que los orbitales rehibridantes se superpongan en el estado de transición.
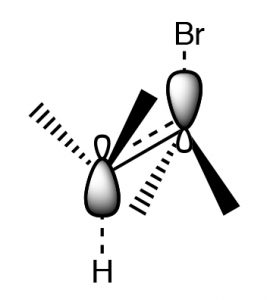
Esta orientación se llama antiperiplanar, y esta necesidad de un arreglo específico para que ocurra la reacción se denomina requisito estereoelectrónico.
Requisito estereoelectrónico antiperiplanario (o transdiaxial) para\(\mathrm{E} 2\) eliminaciones
En sistemas donde es posible la rotación libre, este alineamiento de los grupos no suele ser un problema, pero si la eliminación va a tener lugar en un sistema de anillos, entonces el\(H\) y el grupo de salida deben ser trans y diaxiales, de lo contrario no se puede cumplir el requisito estereoelectrónico.
Entonces, por ejemplo, el 1-bromo-2-metilciclohexano produce 3-metilciclohexeno, no 1-metilciclohexeno. Esto se debe a que el hidrógeno en el mismo carbono que el grupo metilo debe ser ecuatorial (si el grupo metilo es trans). Por lo tanto, el hidrógeno axial en el otro carbono beta se elimina en su lugar.
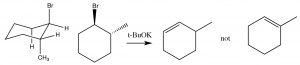
\(\mathrm{E} 2\)la eliminación requiere una conformación transdiaxial (antiperiplanar)
| Nucleófilo/Fuerza base | Methyl | Primaria | Secundaria | Terciario |
| Fuerte/fuerte, p.\({}^{-} \mathrm{OCH}_{3}\) | \(\mathrm{S}_{\mathrm{N}} 2\) | \(\mathrm{S}_{\mathrm{N}} 2\) | \(\mathrm{E} 2\) | \(\mathrm{E} 2\) |
| Fuerte/débil\(\mathrm{RSH}\), por ejemplo, iones haluro | \(\mathrm{S}_{\mathrm{N}} 2\) | \(\mathrm{S}_{\mathrm{N}} 2\) | \(\mathrm{S}_{\mathrm{N}} 2\) | \(\mathrm{NR}\) |
| Débil/fuerte\({}^{-} \mathrm{OBu}^{\mathrm{t}}\), por ejemplo, NaH | \(\mathrm{NR}\) | \(\mathrm{E} 2\) | \(\mathrm{E} 2\) | \(\mathrm{E} 2\) |
| Débil/débil\(\mathrm{H}_{2} \mathrm{O}\), por ejemplo,\(\mathrm{CH}_{3} \mathrm{OH}\) | \(\mathrm{NR}\) | \(\mathrm{NR}\) | \(\mathrm{S}_{\mathrm{N}} 1 / \mathrm{E} 1\) | \(\mathrm{S}_{\mathrm{N}} 1 / \mathrm{E} 1\) |
Una cosa es cierta: la interacción entre sustrato y disolvente puede ser muy confusa. Es imposible memorizar todos los resultados posibles de un conjunto dado de condiciones de reacción, y aunque se pueden hacer algunas generalizaciones, la mejor manera de manejar todo esto es tratar de trabajar a través de la reacción escribiendo un mecanismo plausible. Dicho esto, la siguiente tabla resume algunos de los posibles resultados por tipo de sustrato y fuerza del nucleófilo/base.


