8.10: Reacciones de Compuestos Aromáticos- Introducción de un grupo en el anillo
- Page ID
- 76831
Como hemos visto, los compuestos aromáticos son considerablemente más estables de lo que se podría predecir. En consecuencia, se necesita más energía para hacer que los compuestos aromáticos sufran reacciones ya que, para reaccionar el solapamiento aromático de los orbitales en el anillo, se debe destruir en algún momento durante la reacción. Dado que el anillo aromático es tan rico en electrones, podríamos predecir que sufriría un ataque electrófilo pero, en lugar de sufrir una adición electrófila como lo hacen los alquenos y los alquenos conjugados, los compuestos aromáticos suelen sufrir sustitución electrófila. Por ejemplo, el benceno reaccionará con bromo en presencia de un catalizador como bromuro de hierro (III) (FeBr 3) para dar bromobenceno.
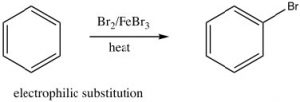
Echemos ahora un vistazo más de cerca a los pasos que implica esta reacción para ver cómo se logra esta sustitución (\(\mathrm{Br}\)por\(\mathrm{H}\) ivc). Dado que el benceno es tan estable, se necesita un electrófilo más reactivo para reaccionar con el anillo. Esto se logra mediante la adición de un catalizador ácido de Lewis\(\mathrm{FeBr}_{3}\), que forma un complejo con el bromo para producir\(\mathrm{Br}^{+}\) (estabilizado por el\(\mathrm{FeBr}_{4} {}^{-}\)). El\(\mathrm{Br}^{+}\) electrófilo ahora reacciona con el anillo de benceno rico en electrones para producir un intermedio estabilizado por resonancia llamado complejo sigma.
![]()
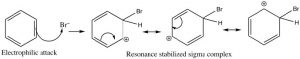
Ahora, en lugar de atacar a un nucleófilo, el anillo aromático se regenera por la pérdida de un protón.

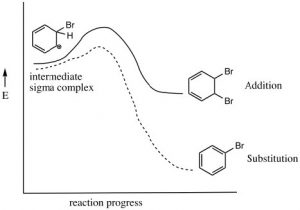
El bromobenceno resultante es mucho más estable que el producto de adición correspondiente.
 c
c
Esta reacción de sustitución electrófila es el mecanismo primario por el cual reaccionan la mayoría de los compuestos aromáticos. Se debe generar un electrófilo muy reactivo; luego agrega a uno de los carbonos del anillo seguido de la pérdida de un protón del mismo carbono.
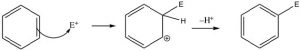
Hay una serie de sustituyentes que se pueden introducir en el anillo de esta manera, incluyendo grupos nitro, alquilo, acilo y sulfonilo. Cada uno procede a través de un mecanismo similar (a través de un electrófilo reactivo que se genera en la reacción) ya sea mediante el uso de un catalizador o mediante el uso de reactivos muy reactivos.
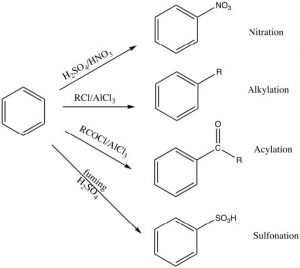

La alquilación y acilación se pueden lograr por tratamiento de un haluro de alquilo o haluro de acilo con un catalizador ácido de Lewis tal como tricloruro de aluminio (\(\mathrm{AlCl}_{3}\)). En este caso, el electrófilo reactivo se genera cuando el haluro de alquilo (o acilo) interactúa con el catalizador para producir un intermedio que es de tipo carbocatión. Es esta especie muy reactiva la que reacciona con el anillo de benceno para producir el benceno sustituido. Esta reacción se denomina alquilación (o acilación) de Friedel-Crafts. Normalmente se prefiere la reacción de acilación porque es difícil detener una reacción de alquilación con una sola sustitución ya que el producto es más reactivo que el material de partida (véase más adelante).
La nitración se logra tratando el benceno con una mezcla de ácidos nítrico y sulfúrico concentrados. Esta mezcla genera un ion nitronio (\(\mathrm{NO}_{2} {}^{+}\)), que es el electrófilo reactivo.
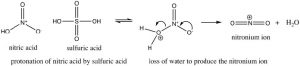
La sulfonación se logra mediante el uso de ácido sulfúrico fuminante, que en realidad contiene trióxido de azufre (\(\mathrm{SO}_{3}\)) disuelto en el ácido sulfúrico. Es el en realidad el\(\mathrm{SO}_{3}\) que es el electrófilo en este caso.
Algunos grupos no pueden introducirse directamente en el anillo: por ejemplo, los grupos que normalmente podríamos considerar como nucleófilos (como\(\mathrm{NH}_{2}\) o\(\mathrm{OH}\)) tienen que introducirse indirectamente. Por ejemplo, la anilina (aminobenceno) se puede producir a partir del nitrobenceno por reducción.
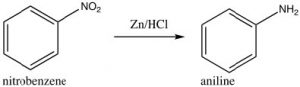
Como veremos más adelante, otros grupos nucleofílicos tienen que ser introducidos por un enfoque diferente.

