6.1: Radiación electromagnética y espectroscopía molecular
- Page ID
- 76365
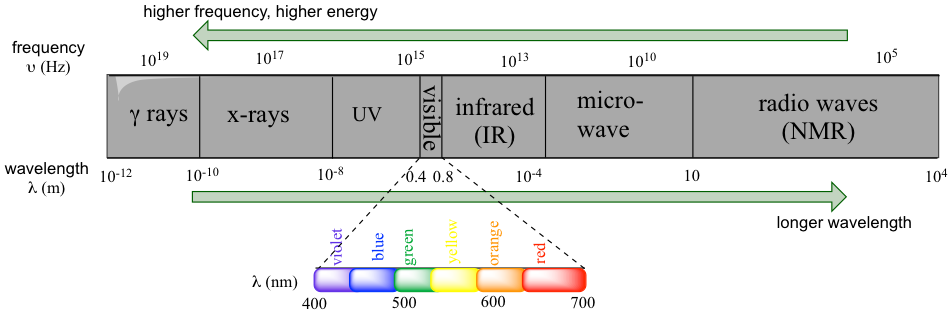
La radiación electromagnética es la radiación compuesta por campos eléctricos y magnéticos oscilantes. Todo el espectro electromagnético cubre la radiación en un rango muy amplio, desde los rayos gamma (emitidos por los núcleos de ciertos elementos radiactivos), los rayos X (utilizados para el examen médico de los huesos), hasta la luz ultravioleta (UV) (es responsable de las quemaduras solares, también se puede utilizar con fines de desinfección), microondas, y ondas de radiofrecuencia (utilizadas para la comunicación de radio y televisión, y de la señal del teléfono celular). La luz visible, la radiación que es visible a nuestros ojos desnudos y lo que comúnmente denominamos “luz”, solo explica una banda muy estrecha fuera del espectro electromagnético completo.
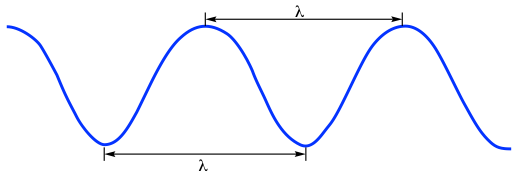
La radiación electromagnética exhibe propiedades onduladas. Como propiedad general de las ondas, la longitud de onda (λ, griego 'lambda') y la frecuencia (ν, griego 'nu', en unidad de Hz o s -1, 1Hz = 1s -1) de la radiación electromagnética se ajusta en la fórmula de:
c = λν Fórmula 6.1
donde c es la velocidad, generalmente referida como la “velocidad de la luz”, con el valor constante de 2.998×10 8 m/s en vacío (la velocidad de la luz en el aire es un poco más lenta que esta constante pero generalmente se considera como la misma). Debido a que la radiación electromagnética viaja a una velocidad constante, la longitud de onda (λ) y la frecuencia (ν) son inversamente proporcionales entre sí, las ondas más largas tienen frecuencias más bajas y las ondas más cortas tienen frecuencias más altas.
La energía de la radiación electromagnética se puede calcular en base a la fórmula:
E = hν = hc /λ Fórmula 6.2
donde E es la energía de cada fotón en unidad de Joule (J) y h es la constante de Planck con un valor de 6.626×10 -34 J·s.
Por lo que las radiaciones con frecuencias más altas corresponden a mayor energía. La radiación de alta energía, como la radiación gamma y los rayos X, se compone de ondas muy cortas, tan cortas como 10 -16 m. Las longitudes de onda más largas son mucho menos energéticas y, por lo tanto, son menos dañinas para los seres vivos. Las ondas de luz visible están en el rango de 400 — 700 nm (nanómetro, 1nm = 10-9 m), mientras que las ondas de radio pueden tener varios cientos de metros de longitud.
En un experimento de espectroscopia molecular, se permite que la radiación electromagnética de un rango específico de longitudes de onda pase a través de una muestra que contiene un compuesto de interés. Las moléculas de muestra absorben energía de algunas de las longitudes de onda y, como resultado, saltan de un “estado de tierra” de menor energía a un “estado excitado” de mayor energía. Otras longitudes de onda no son absorbidas por la molécula de muestra, por lo que pasan a través. Un detector registra qué longitudes de onda fueron absorbidas y cuánto fueron absorbidas.
Como veremos en este capítulo, podemos aprender mucho sobre la estructura de una molécula orgánica cuantificando cómo absorbe (o no absorbe) diferentes longitudes de onda en el espectro electromagnético. La espectroscopia IR implica la absorción de radiación en la región infrarroja y se aplican ondas de radio en la técnica de RMN.


