10.8: Alquinos
- Page ID
- 76402
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)El alquino es el hidrocarburo que contiene triple enlace C=C. En esta sección, exploraremos los métodos para la síntesis de alquinos y las reacciones químicas de los alquinos.
10.8.1 Acidez de Alquinos Terminales y Reacciones Relacionadas
En las discusiones sobre ácidos y bases (Capítulo 3), hemos aprendido que el átomo de hidrógeno unido al carbono del alquino terminal muestra mayor acidez que los átomos de hidrógeno unidos a los carbonos de un alqueno o alcano, y el valor de pKa del hidrógeno alquino terminal es de aproximadamente 25.
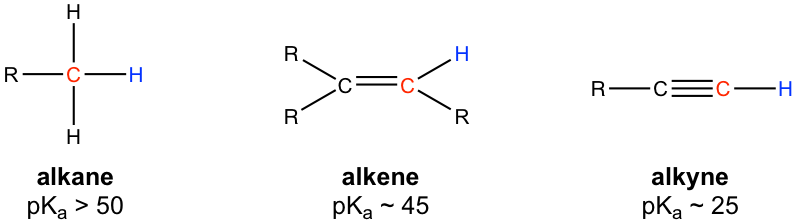
Debido a la acidez relativamente alta, los alquinos terminales pueden ser desprotonados por bases fuertes apropiadas, como NaH, NaNH 2.
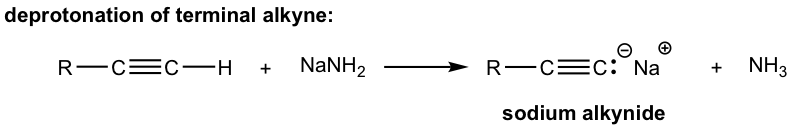
El producto de la desprotonación anterior, anión alquínido, es un buen nucleófilo que puede ser utilizado en la reacción de S N 2 con sustratos primarios (ya que los sustratos primarios funcionan mejor para tal reacción de S N 2 como hemos aprendido):

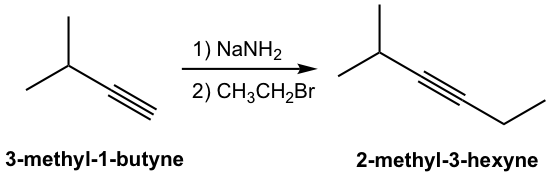
Se introduce nueva porción de carbono en el producto con nuevo enlace carbono-carbono formado en la reacción S N 2, y este es un método común para sintetizar alquinos internos con cadena carbonada más larga. Un ejemplo específico para la síntesis de 2-metil-3-hexino a partir de 3-metil-1-butino se da aquí:
El método en 10.4.1 se aplica a la síntesis de alquino con cierta estructura. La forma más general de sintetizar alquino es a través de la reacción de eliminación de dihaluros vecinales. Recordemos que los dihaluros vecinales son los productos de halogenación de los alquenos (sección 10.4). El dihaluro vecinal puede entonces ser sometido a una reacción de deshidrohalogenación doble con una base fuerte para producir un alquino.
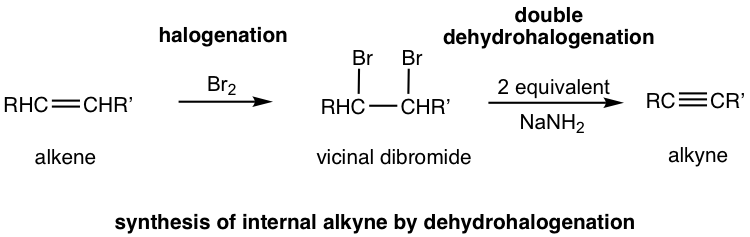
La deshidrohalogenación ocurre dos veces, en dos etapas, el primer producto es un haloalqueno, y el segundo producto es el alquino. La amida, generalmente NaNH2, es una base lo suficientemente fuerte como para provocar que ambas reacciones se lleven a cabo consecutivamente en una misma mezcla. Se requieren dos equivalentes molares de amida de sodio por mol del dihaluro para asegurar que la eliminación ocurra dos veces.

Si un alquino terminal es el producto deseado, entonces se requieren tres equivalentes molares de base. El alquino terminal producido después de la doble deshidrohalogenación es desprotonado por amida sódica, el tercer mol de base es para asegurar que la desprotonación ocurra completamente y todo el alquino terminal se convierta al formato de sal. La sal de alquinida se trató luego con cloruro amónico (o agua, como fuente de protón) para producir alquino terminal como producto final deseado.
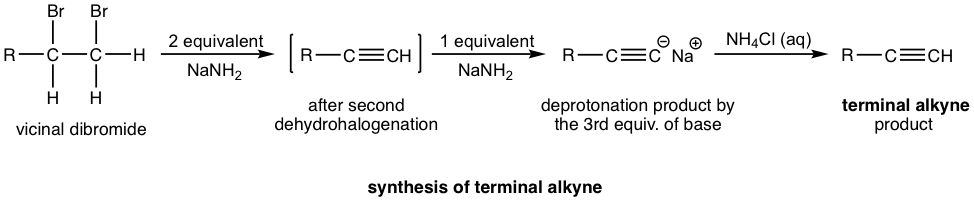
Ejemplos
Diseñar la ruta de síntesis de 1-butino a partir de 1-buteno.
Enfoque:
Utilizar análisis retro-sintético:
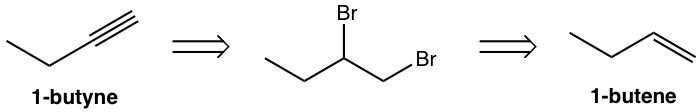
Ese análisis puede traducirse a la síntesis paso a paso como:
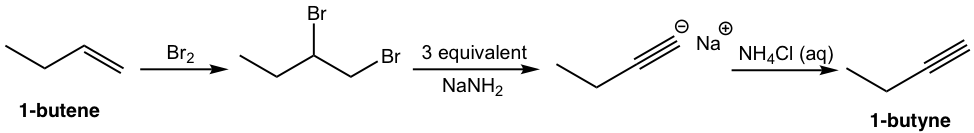
Solución: (mostrar los pasos juntos en el orden adecuado, sin mostrar intermedios para cada paso)
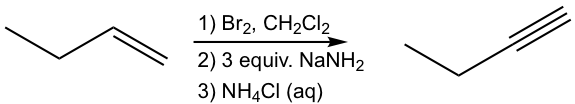
10.8.3 Reacciones de alquinos
Hidrogenación de alquinos
La hidrogenación catalítica también se aplicó a los enlaces π de los enlaces triples C=C. Dependiendo de las condiciones y catalizadores empleados, se añadirán uno o dos equivalentes molares de hidrógeno a un triple enlace y se producirán alqueno o alcano como producto respectivamente.
Cuando se aplican catalizadores de platino o paladio, el producto final de la hidrogenación es un alcano con suficiente hidrógeno proporcionado. El producto inicial es un alqueno, que se somete a la reacción sucesivamente para dar alcano como producto final.
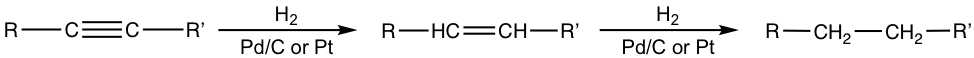
Con cierto catalizador utilizado, la hidrogenación del alquino se puede detener en la etapa alqueno. El catalizador más comúnmente empleado es el catalizador Lindlar. El catalizador Lindlar se prepara precipitando paladio sobre carbonato de calcio y luego tratándolo con acetato de plomo (II) y quinolina. El tratamiento especial modifica la superficie del metal paladio desactivándolo parcialmente y haciéndolo más efectivo para catalizar la hidrogenación a un triple enlace que a un doble enlace.
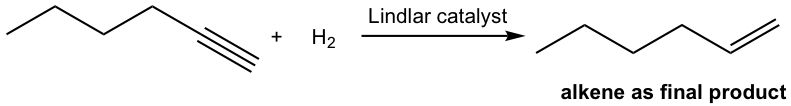
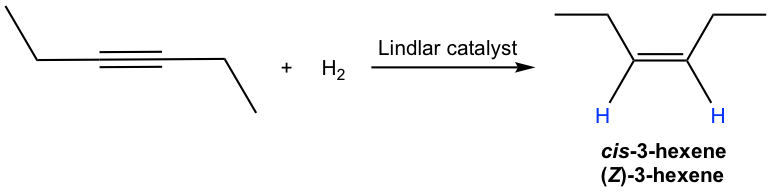
El mecanismo para la hidrogenación catalítica del alquino es casi el mismo que el del alqueno (10.5). Dado que ambos átomos de hidrógeno se entregan desde la superficie del catalizador, se entregan al mismo lado del triple enlace, por lo tanto se produce la adición de syn. Por lo que la hidrogenación de un alquino interno produce cis-alqueno con el catalizador Lindlar.
El alquino interno se puede convertir en trans-alqueno usando sodio (o litio) en amoníaco líquido. El mecanismo para esta reacción implica transferencias sucesivas de electrones individuales del metal (sodio o litio) y transferencias de protones desde amoníaco, con intermedios radicales. El metal de sodio (o litio) reacciona más rápidamente con triple enlace que con doble enlace, por lo que la reacción se detiene en la etapa alqueno. Es necesaria baja temperatura (-78 °C) para mantener el amoníaco en estado líquido.
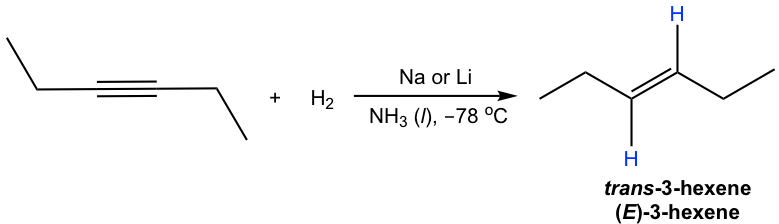
El anión trans-vinílico se forma preferentemente debido a la mayor estabilidad con dos grupos R más separados. La protonación del anión trans-vinílico conduce al trans-alqueno.

Hidrohalogenación de alquinos
Un alquino es una molécula rica en electrones con alta densidad de electrones pi, por lo tanto es un buen nucleófilo que reacciona fácilmente con los electrófilos. Así, los alquinos, al igual que los alquenos, también experimentan adición electrófila con haluro de hidrógeno.
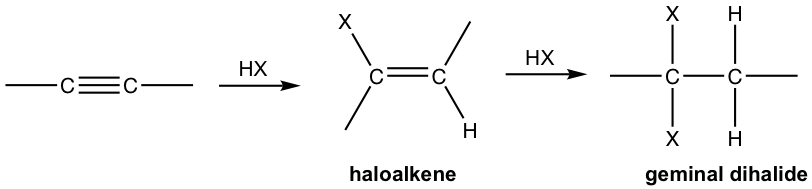
- Alquino reacciona con un mol de HX para formar haloalqueno, y con dos moles de HX para formar dihaluros geminales, el dihaluro con ambos halógenos unidos al mismo carbono. “Geminal” viene de geminus en latín, eso significa “gemelo”.
- Ambas adiciones siguen la regla de Markovnikov en términos de regioselectividad.
Si se dispone de un equivalente molar de HX, la adición se puede detener en la primera adición a haloalqueno. El alqueno halo-sustituido es menos reactivo que el alquino para la adición electrófila debido a que un sustituyente halógeno retira electrones inductivamente, disminuyendo así la nucleofilia del doble enlace.
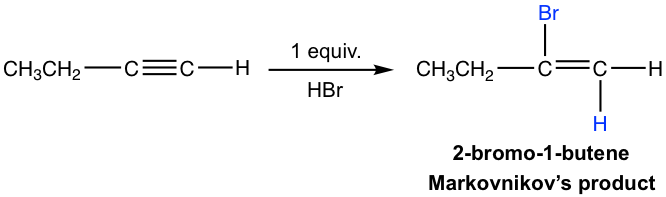
El mecanismo para la adición electrófila al alquino es bastante similar a la adición de alqueno, con la protonación como primer paso. Para el alquino terminal, si la protonación ocurre sobre diferentes carbonos de triple enlace, se formará el intermedio catiónico vinílico primario o secundario. La mayor estabilidad del catión vinílico secundario conduce a la regioselectividad de Markovnikov, que el átomo de hidrógeno unido al carbono que tiene el mayor número de átomos de hidrógeno.

Si está presente un exceso de hidro haluro, la adición al alquino ocurre dos veces para dar haluro geminal que sigue la regioselectividad de Markovnikov.
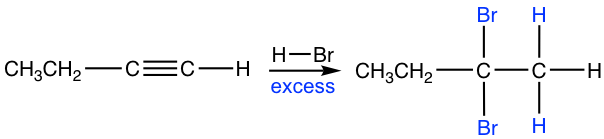
Hidratación de Alquinos
Los alquinos también se someten a la adición catalizada por ácido de agua (hidratación), similar a los alquenos. Como resultado, el H agregado a un carbono de triple enlace y OH agregado al otro carbono de triple enlace, y el producto formado se llama enol (“en” proviene de “ene” que significa doble enlace, “ol” significa grupo OH). Un enol es un compuesto con un doble enlace carbono-carbono y un grupo OH conectado en uno de los carbonos de doble enlace.
El enol es un compuesto muy inestable, inmediatamente se somete a reordenamiento para dar un compuesto carbonilo, aldehído o cetona más estable. La estructura de un compuesto carbonilo y un enol difieren en la ubicación del doble enlace y un átomo de hidrógeno, y se llaman tautomeros. La interconversión entre los tauteros se llama tautomerización. El mecanismo no está cubierto. El enol siempre se somete a tautomerización rápidamente debido a la alta estabilidad del compuesto carbonilo, como se muestra de la manera general a continuación.

Para alquino interno simétrico que tiene el mismo grupo unido a cada uno de los carbonos de triple enlace (sp), la adición de agua forma una sola cetona como producto. Al igual que en el primer ejemplo, la 2-butanona se produce a partir de la hidratación del 2-butino.
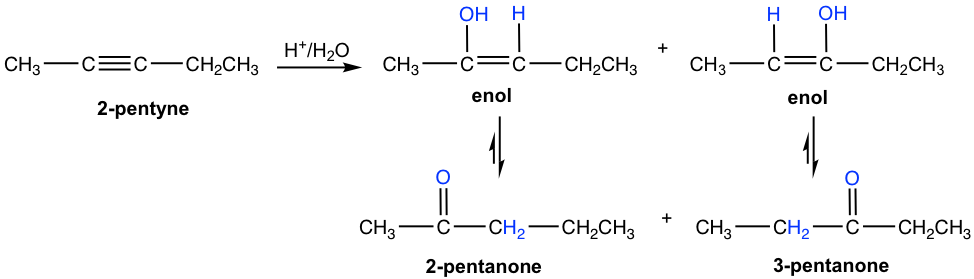
Para alquino interno asimétrico con diferentes grupos en cada uno de los carbonos de triple enlace, se forma la mezcla de dos cetonas debido a que la adición inicial del protón puede ocurrir en cualquiera de los carbonos sp. Aquí se muestra la hidratación de 2-pentino que producen la mezcla de 2-pemtanona y 3-pentanona como producto.
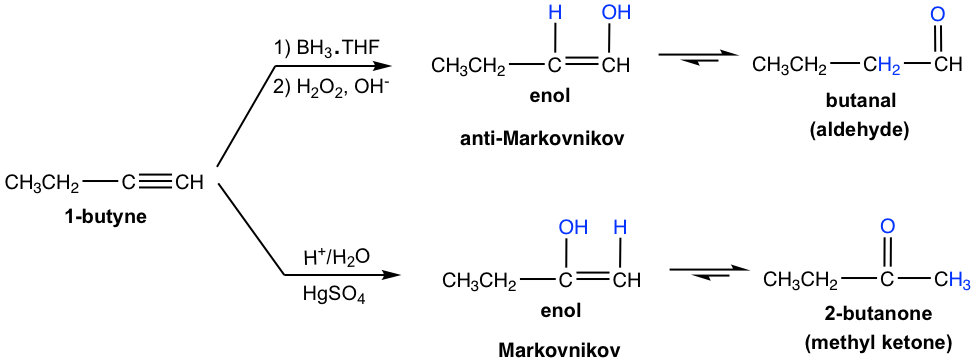
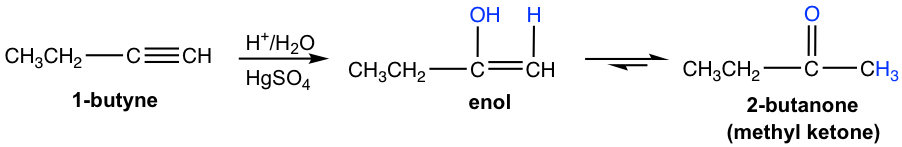
Los alquinos terminales no son tan reactivos como los alquinos internos hacia la hidratación. La adición de agua a un alquino terminal ocurrirá si el ion mercúrico (Hg 2+) se presenta como catalizador. El enol formado a partir de la adición sigue la regla de Markovnikov con el átomo de hidrógeno unido al carbono terminal, y una metil cetona (la cetona con un grupo metilo conectado en un lado del enlace C=O) es el producto final después de la tautomerización.
Hidroboración-Oxidación de Alquinos:
La hidroboración-oxidación también se aplica al alquino de manera similar a la del alqueno. El proceso de dos etapas da como resultado el enol, que pasa por tautomerización para dar compuesto carbonilo.
En tanto, la adición de borano a un alquino terminal muestra la misma regioselectividad que se observó en la adición de borano a un alqueno. Es decir, el boro se agrega preferentemente al carbono de triple enlace terminal (sp) (el carbono con más átomo de hidrógeno), o al carbono terminal con menos sustituyentes. Después de la oxidación, el grupo que contiene boro se convierte en el grupo OH, por lo que el enol se produce de la manera anti-Markovnikov, con OH conectado en el carbono terminal. La tautomerización de dicho enol genera aldehído como producto final.
Comparando los dos métodos de hidratación del alquino, la hidroboración-oxidación produce aldehído a partir del alquino terminal, mientras que la hidratación catalizada por ácido convierte alquino terminal en metil cetona.