6.1: Chiralidad
- Page ID
- 76411
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Objetivo de aprendizaje
- reconocer y clasificar las moléculas como quirales o aquirales e identificar planos de simetría
Los estereoisómeros son isómeros que difieren en la disposición espacial de los átomos, más que en el orden de conectividad atómica. Uno de sus tipos de isómeros más interesantes son los estereoisómeros de imagen especular, un conjunto no superponible de dos moléculas que son imagen especular entre sí. La existencia de estas moléculas está determinada por concepto conocido como quiralidad.
Introducción
Los compuestos orgánicos, moléculas creadas alrededor de una cadena de átomos de carbono (más comúnmente conocida como cadena principal de carbono), juegan un papel esencial en la química de la vida. Estas moléculas derivan su importancia de la energía que transportan, principalmente en una forma de energía potencial entre moléculas atómicas. Dado que dicha fuerza potencial puede verse ampliamente afectada debido a cambios en la colocación atómica, es importante entender el concepto de un isómero, una molécula que comparte la misma composición atómica que otra pero que difiere en las disposiciones estructurales. Este artículo se dedicará a unos isómeros específicos llamados estereoisómeros y su propiedad de quiralidad (Figura 1).
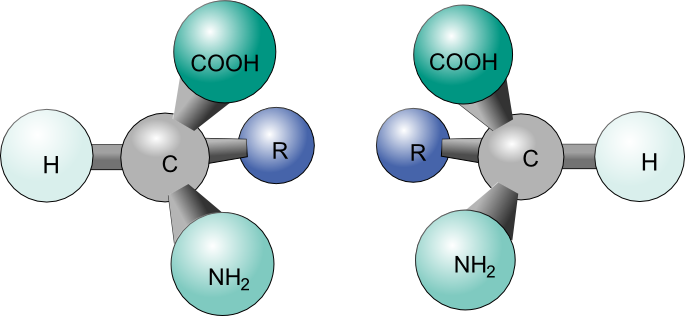
Los conceptos de esteroisomería y quiralidad tienen mucha importancia en la química orgánica moderna, ya que estas ideas ayudan a comprender las razones físicas y teóricas detrás de la formación y estructuras de numerosas moléculas orgánicas, razón principal detrás de la energía incrustada en estas productos químicos esenciales. En contraste con el isomerismo constitucional más conocido, que desarrolla compuestos isotópicos simplemente por diferentes conexiones atómicas, el estereoisomería generalmente mantiene conexiones atómicas iguales y órdenes de bloques de construcción además de tener el mismo número de átomos y tipos de elementos.
¿Qué, entonces, hace que los estereoisómeros sean tan únicos? Para responder a esta pregunta, el alumno debe ser capaz de pensar e imaginar no sólo en imágenes bidimensionales, sino también en el espacio tridimensional. Esto se debe a que los estereoisómeros son isómeros porque sus átomos son diferentes de otros en términos de disposición espacial.
Arreglo espacial
Ante todo, hay que entender el concepto de arreglo espacial para entender el estereoisomería y la quiralidad. La disposición espacial de los átomos se refiere a cómo se sitúan diferentes partículas y moléculas atómicas en el espacio alrededor del compuesto orgánico, es decir, su cadena de carbono. En este sentido, la disposición espacial de una molécula orgánica es diferente a otra si un átomo se desplaza en cualquier dirección tridimensional incluso en un grado. Esto abre una posibilidad muy amplia de diferentes moléculas, cada una con su colocación única de átomos en el espacio tridimensional.
Estereoisómeros
Los estereoisómeros son, como se mencionó anteriormente, contienen diferentes tipos de isómeros dentro de sí mismos, cada uno con características distintas que además se separan entre sí como diferentes entidades químicas que tienen diferentes propiedades. Los tipos llamados entaniómero son los estereoisómeros de imagen especular anteriormente mencionados, y se explicarán en detalle en este artículo. Otro tipo, el diastereómero, tiene diferentes propiedades y se introducirá posteriormente.
Los muchos sinónimos del carbono quiral
Tenga en cuenta: todos los siguientes términos se pueden usar para describir un carbono quiral.
carbono quiral = carbono asimétrico = carbono ópticamente activo = carbono estéreo
Enantiómeros
Este tipo de estereoisómero es la imagen especular esencial, tipo de estereoisómero no superponible introducido al inicio del artículo. La Figura 3 proporciona un ejemplo perfecto; tenga en cuenta que el plano gris en el medio degrada el plano espejo.
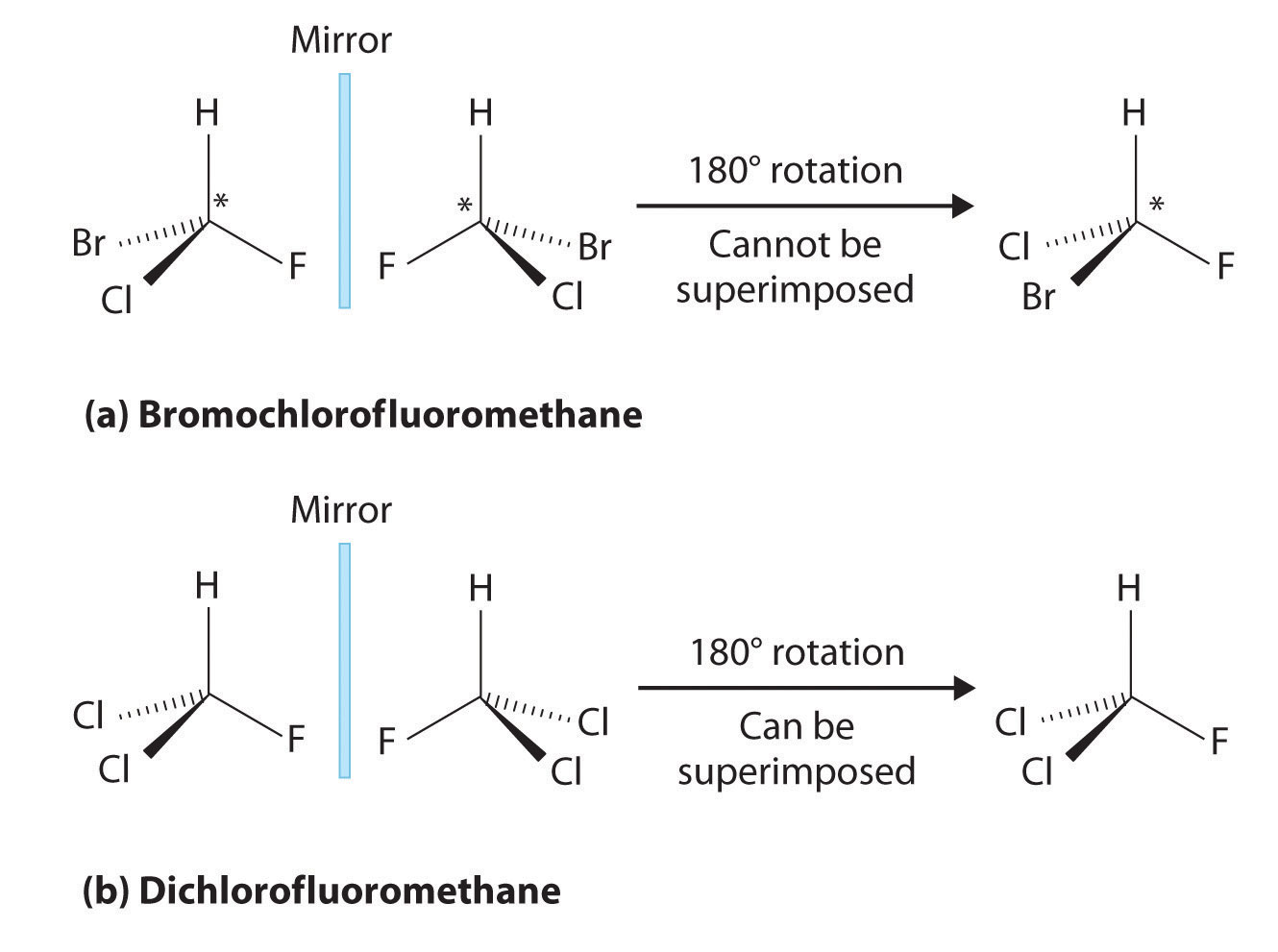
Tenga en cuenta que incluso si uno volteara la molécula izquierda hacia la derecha, la disposición espacial atómica no será igual. Esto es equivalente a la relación mano izquierda - mano derecha, y se conoce acertadamente como 'mano' en las moléculas. Esto puede ser algo contrario a la intuición, por lo que este artículo recomienda al lector probar el ejemplo de 'mano'. Coloque tanto la palma hacia arriba, como las manos una al lado de la otra. Ahora voltea cualquiera de los lados hacia el otro. Una mano debe estar mostrando el dorso de la mano, mientras que la otra muestra la palma. No son iguales y no superponibles.
Aquí es donde entra el concepto de quiralidad como una de las ideas más esenciales y definitorias del estereoisomería.
Chiralidad
Quiralidad significa esencialmente 'imagen especular, moléculas no superponibles”, y decir que una molécula es quiral es decir que su imagen especular (debe tener una) no es la misma que ella misma. Si una molécula es quiral o aquiral depende de un cierto conjunto de condiciones superpuestas. La Figura 4 muestra un ejemplo de dos moléculas, quiral y aquiral, respectivamente. Observe la característica distintiva de la molécula aquiral: posee dos átomos de un mismo elemento. En teoría y realidad, si uno fuera a crear un plano que recorra los otros dos átomos, podrán crear lo que se conoce como plano bisectriz: Las imágenes a cada lado del plano son las mismas que las del otro (Figura 4).
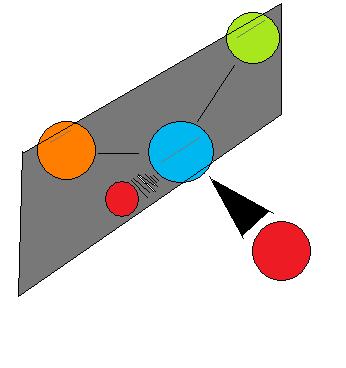
En este caso, la molécula se considera 'aquiral'. Es decir, para distinguir la molécula quiral de una molécula aquiral, se debe buscar la existencia del plano bisecante en una molécula. Todas las moléculas quirales son privativas del plano bisecante, ya sea simple o complejo.
Como regla universal, ninguna molécula con diferentes átomos circundantes es aquiral. La quiralidad es una idea simple pero esencial para sustentar el concepto de estereoisomería, siendo utilizada para explicar un tipo de su tipo. Las propiedades químicas de la molécula quiral difieren de su imagen especular, y en esto radica la importancia de la chilaridad en relación con la química orgánica moderna.

