3.3: Caja de herramientas moleculares — Circuitos Neuronales (Conceptos Básicos)
- Page ID
- 121914
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Claves para llevar
- Orientación de precisión de neuronas
- Optogenética los fundamentos
- Canalrodopsinas
- Opsinas inhibitorias
Orientación de precisión de neuronas
Las neuronas no funcionan de forma aislada y suelen hacer conexiones sinápticas que se asemejan a circuitos. La mayoría de las investigaciones de comportamiento y desarrollo se han basado en mapear los circuitos neuronales dentro del cerebro y el SNC. Comprender la conectividad de estos circuitos permite a los neurocientíficos comprender el comportamiento y las patologías (Figura\(\PageIndex{1}\).). En el pasado, esto ha significado lesionar o destruir partes de estos circuitos, o estimular electrofisiológicamente estos circuitos y examinar el comportamiento resultante. Estos métodos más antiguos nos han permitido diseccionar el funcionamiento detallado de los circuitos neuronales subyacentes al comportamiento natural, y también nos han permitido comprender cómo algunos circuitos neuronales se vuelven disfuncionales en estados de enfermedad como la enfermedad de Parkinson o la epilepsia.

Figura\(\PageIndex{1}\): Comienzos de estudios de circuitos cerebrales en ratones utilizando optrodos para excitar o inhibir canales iónicos. Adaptado de Nature 2016 (acceso abierto cc por 4).
El cerebro vertebrado (ratones, ratas, primates y humanos), contiene muchos tipos de células diferentes con distintos patrones de expresión molecular, actividad fisiológica y conectividad topológica, que se entremezclan en una red altamente heterogénea. Estudiar grupos específicos de neuronas en este entorno se vuelve muy desafiante y los científicos que utilizan estudios de lesión, estimulación y rastreo nunca estuvieron seguros sobre lo espacial (es decir, solo afectaron neuronas específicas) y temporal (es decir, se puede revertir la lesión, permitiendo la inversión del comportamiento).
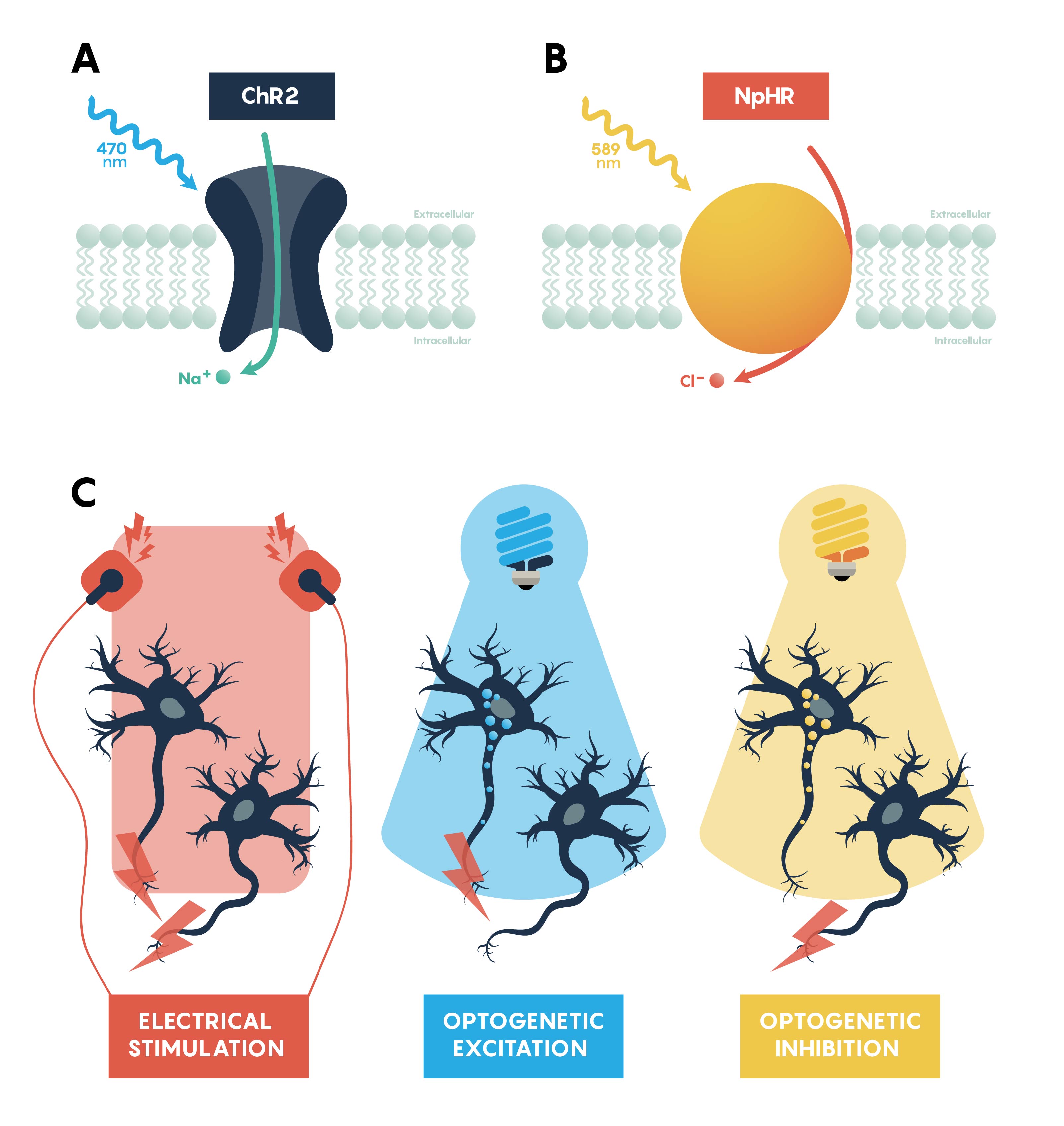
Figura\(\PageIndex{2}\). Paneles que resumen las características de las opsinas excitadoras, ChR2, (A) e inhibidoras, NpHR, (B). Panel C que muestra que todas las neuronas serían excitables usando un electrodo estándar. Sin embargo, la excitación optogenética (luz azul) y la inhibición (luz amarilla) solo funcionan en neuronas específicas que expresan la opsina apropiada.
Las preguntas en torno a la especificidad y reversibilidad temporal cambiaron con la introducción de la optogenética. Desde finales de la década de 2000, la optogenética ha marcado el inicio de una nueva era de control potente y dirigido sobre múltiples aspectos de la función neural. Los métodos genéticos y ópticos aplicados juntos permiten un estricto control espacial y temporal de la actividad de tipos específicos de neuronas en el cerebro vivo, un avance revolucionario que nos permitirá lograr una comprensión sin precedentes de la función del circuito neural en el comportamiento de los animales. Mediante esta técnica, las neuronas se modifican primero genéticamente (usando una variedad de mecanismos, descritos más adelante) para expresar proteínas sensibles a la luz (opsinas). Cuando estas neuronas se iluminan entonces con luz de la frecuencia correcta se activarán o inhibirán transitoriamente o se modularán sus vías de señalización, dependiendo del tipo particular de opsina que se eligió para su expresión. La expresión específica del tipo celular se logra típicamente con animales transgénicos, vectores virales o una combinación, y la aplicación de luz espacialmente restringida permite un refinamiento adicional en el direccionamiento a regiones específicas del cerebro. La luz se puede aplicar en una variedad de patrones temporales con el fin de influir de manera óptima en la función neuronal (permitiendo el control experimental de la frecuencia de pico y la ráfaga, entre otros parámetros), y puede restringirse a períodos específicos de conducta cortos de examen.
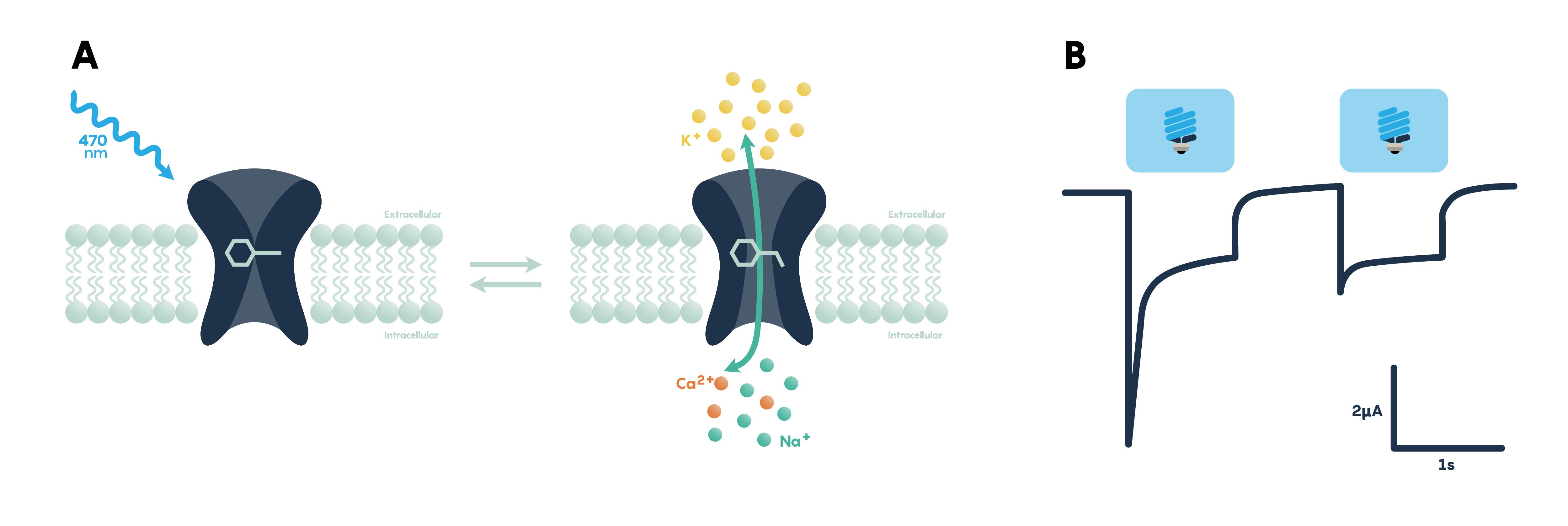
Figura\(\PageIndex{3}\). Panel A que muestra el efecto excitatorio de la luz azul sobre una opsina unida a membrana que funciona como canal. Panel B mostrando potenciales de acción en respuesta a la luz azul (excitatoria).
Optogenics: los fundamentos
¿Qué son los actuadores optogenéticos?
Los actuadores optogenéticos son proteínas que modifican la actividad de la célula en la que se expresan cuando esa célula se expone a la luz (Figura\(\PageIndex{3}\).). Estos actuadores se pueden usar para inducir potenciales de acción únicos o múltiples (que pueden organizarse en trenes de picos regulares o que pueden ser pseudoaleatorios a una velocidad controlada por el usuario), suprimir la actividad neuronal o modificar vías de señalización bioquímica, con control de milisegundos sobre el tiempo de eventos. Los actuadores más potentes y ampliamente utilizados son las opsinas, proteínas transmembrana sensibles a la luz de origen natural, que se encuentran en una variedad de organismos que van desde microbios hasta primates, y que pueden usarse como se encuentran en la naturaleza o diseñados para optimizar el funcionamiento. Las opsinas naturales se pueden clasificar ampliamente en dos clases principales: opsinas microbianas (Tipo I) y opsinas de vertebrados (Tipo II). Las opsinas de tipo I se encuentran en organismos microbianos procariotas y eucariotas, incluyendo bacterias, arqueas y algas, y están compuestas por un solo componente proteico unido a membrana que funciona como una bomba o canal. Estas opsinas son utilizadas por sus microorganismos hospedadores para una variedad de funciones, incluyendo la navegación hacia fuentes de energía y lejos de ambientes peligrosos, y el control de las concentraciones intracelulares de una variedad de iones y el latido de flagelos.
Las opsinas tipo I se utilizaron en los primeros experimentos de optogenética para controlar la función neuronal, tanto por la facilidad de la ingeniería genética usando una proteína de un solo componente como por su cinética más rápida, y siguen siendo la fuente primaria (pero no exclusiva) de nuevas opsinas naturales y modificadas.

Figura\(\PageIndex{4}\). Las opsinas son proteínas unidas a la membrana que se activan con luz, lo que da como resultado la activación celular (despolarización), inhibición (hiperpolarización) o modulación de cascadas de señalización intracelular (panel A). Aquí se ilustran ChR2 (un canal catiónico utilizado para estimular la actividad neural), iC1c2 (un canal de cloruro recientemente desarrollado utilizado para inhibir la actividad neural), ePhR3.0 (una bomba de cloruro utilizada para inhibir la actividad neuronal), eBR (una bomba de protones utilizada para inhibir la actividad neural) y OpToXR (un receptor acoplado a proteína G utilizado para modular cascadas de señalización intracelular). (Panel B) Grabaciones de células unidas y de células completas de una neurona que expresa tanto ChR2 como NpHR. Tenga en cuenta que los picos individuales se pueden provocar con un pulso corto de luz azul (que activa ChR2) y que estos picos pueden bloquearse con luz amarilla continua (que activa nPhR). Panel A adaptado con permiso de Fenno et al., 2011, y panel B adaptado con permiso de Zhang et al., 2007.
¿Cómo funcionan los actuadores optogenéticos?
Las opsinas de ambos tipos requieren retinal, una forma de vitamina A que se isomeriza tras la absorción de un fotón, para funcionar. Cuando la retina se une a la opsina, el complejo retinal-opsina se vuelve sensible a la luz, y si un fotón golpea la retina en este estado su fotoisomerización resultante inducirá un cambio conformacional en la opsina. Esto conduce a la apertura del canal o activación de la bomba, un cambio en el potencial de membrana y, en última instancia, la activación o inhibición de la actividad neuronal. Por lo tanto, la retina debe estar presente para que los actuadores optogenéticos funcionen. Afortunadamente, particularmente para los primeros experimentos de prueba de principio, la retina ya está presente en cantidades suficientes en el tejido neural de los mamíferos para permitir el uso de herramientas optogenéticas sin suplementación retiniana exógena. Sin embargo, los sistemas modelo de invertebrados como Drosophila necesitan suplementación retiniana a través de su dieta para que los efectores optogenéticos funcionen. Aquí revisamos las diferentes clases de actuadores optogenéticos, agrupados por su efecto sobre la actividad neural o señalización.
Estimulación Optogenética de la Actividad Neural: Cómo “Encender” las Neuronas
Canalrodopsinas
Las canalesrodopsinas (CHR) son canales iónicos activados por la luz descubiertos en Chlamydomonas reinhardtii, una alga verde unicelular. El primer uso de una opsina microbiana para controlar la actividad de adición de neuronas utilizó Canalrodopsina 2 (ChR2), una de las dos rodopsinas canalesexpresadas por este organismo. ChR2 es un canal catiónico inespecífico de luz que, cuando se ilumina con luz azul, se abre y permite el paso de cationes y la posterior despolarización de la célula. En 2005 se introdujo ChR2 en neuronas cultivadas del hipocampo y se utilizó con éxito para controlar la actividad de adición con precisión temporal fina. Como lo demuestra este artículo pionero, se pueden usar pulsos muy breves (milisegundos) de luz azul para inducir potenciales de acción única en neuronas que expresan CHR2, y la actividad de adición impulsada por la activación de esta opsina se puede controlar con alta precisión a frecuencias que se acercan a 30 picos por segundo.
Inhibición optogenética de la actividad neuronal: cómo apagar las neuronas
Bombas de Cloruro
La inhibición de la actividad neuronal en los circuitos neuronales puede complementar las herramientas excitatorias al permitir a los investigadores probar el papel de los componentes individuales del circuito neuronal. Una de las opsinas inhibidoras optogenéticas más eficientes y ampliamente utilizadas, NpHR, es una halorodopsina del arqueón Natronomonas pharaonis. NpHR bombea iones cloruro a la célula tras la activación de luz de longitud de onda larga, lo que resulta en hiperpolarización. La ingeniería genética ha llevado a una serie de revisiones que producen enPHR3.0, una opsina con localización mejorada de la membrana superficial y una fotocorriente más grande. Con un máximo de excitación a 590 nm, la ePhr3.0 puede ser impulsada por longitudes de onda de luz verde, amarilla o roja, lo que permite el uso de sistemas láser menos costosos.
Bombas de protones
Las bombas de protones también pueden usarse para inhibir neuronas a través de la hiperpolarización, bombeando protones fuera de la célula, y tienen algunas características que las convierten en alternativas deseables a las bombas de cloruro, que incluyen una rápida recuperación de la inactivación y corrientes de mayor tamaño después de la activación. Arch (archaerhodopsina-3 de Halorubrum sodomense), Mac (del hongo Leptosphaeria maculans), ArchT (una archaerodpsina de la cepa TP009 de Halorubrum) y eBR (una versión mejorada de bacteriorodopsina de Halobacterium salinarum) son bombas de protones que muestran una eficacia robusta en la inhibición. Un trabajo reciente ha demostrado que la inhibición de las neuronas que expresan EnpHR3.0 puede hacer que la neurona inhibida sea transitoriamente más excitable debido a un cambio impulsado por cloruro en el potencial de inversión del receptor de ácido γ-aminobutírico tipo A (GABAA) que puede apuntar hacia un inhibidor de la bomba de protones como la opsina de elección para algunos experimentos que involucran especialmente a este sistema.
Ejercicio\(\PageIndex{1}\)
¿Qué opsina funciona como una bomba de protones?
Ejercicio\(\PageIndex{2}\)
¿Qué opsina, cuando se expresa, permitiría que la neurona se excitara?
- ChR2
- NpHR
- 0
- Ninguna de las anteriores


