3.2: Electrofisiología Patch-Clamp
- Page ID
- 121905
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Desde que hemos aprendido que las neuronas contienen canales, receptores y transportadores en la Unidad 1, uno de los parámetros más útiles que examinan los neurocientíficos, implica determinar el movimiento de iones y la modulación resultante del potencial de membrana neuronal. Específicamente, las técnicas electrofisiológicas utilizadas en los tejidos excitables se basan en la conductancia iónica de los canales iónicos y cómo estos influyen en los cambios en el potencial de membrana de la célula que se examina. Se han desarrollado diversas técnicas electrofisiológicas para detectar y manipular la función del canal iónico y/o la generación de potencial de acción. Determinar cuándo usar cada técnica electrofisiológica depende de muchos factores diferentes, incluyendo las propiedades biofísicas de la célula registrada, el tipo de tejido que se examina, el uso de pinza de corriente y/o voltaje, si los ambientes intra y/o extracelulares serán modulados en el experimentos, y lo más importante si se registrarán un solo canal o varios canales iónicos.
Electrofisiología Patch-clamp
El método más común utilizado para evaluar la función de los canales iónicos se conoce como la técnica electrofisiológica de patch-clamp que fue desarrollada en la década de 1970 por los premios Nobel Erwin Neher y Bert Sakmann. La técnica de patch-clamp permite a un investigador medir las propiedades biofísicas de los canales iónicos en escalas de tiempo de milisegundos. La abrazadera de parche requiere la formación inicial de un sello Giga-ohmios (GΩ) entre la membrana plasmática y la punta roma (0.5—2 μm de diámetro) de una micropipeta (electrodo) de vidrio o cuarzo pulido con calor. Una vez que se ha creado un sello Giga-ohmios, esta 'configuración celular unida "” (Figura\(\PageIndex{1}\).) mantiene la integridad de la membrana plasmática (es decir, el sello de membrana no se rompe) evitando que la solución intracelular dentro de la micropipeta dialice hacia la célula. Sin embargo, esto también restringe el acceso eléctrico al espacio intracelular celular, lo que resulta en una incapacidad para controlar el potencial de membrana de la célula. En esta configuración, solo se puede controlar directamente el potencial de membrana del parche relativo al potencial de reposo de la célula. Al alterar la magnitud de la resistencia del sello (un sello suelto frente a un sello hermético) y/o si el electrodo de grabación está sujeto a corriente frente a voltaje, la configuración unida a la celda se puede usar para medir corrientes de canal único, disparo espontáneo de células neuronales y potenciales sinápticos así como potenciales de acción evocados dentro de la célula. La otra ventaja principal de esta configuración es que aunque es limitada por las razones señaladas anteriormente, esta configuración es el punto de partida para la mayoría de los tipos de grabaciones de patch-clamp.
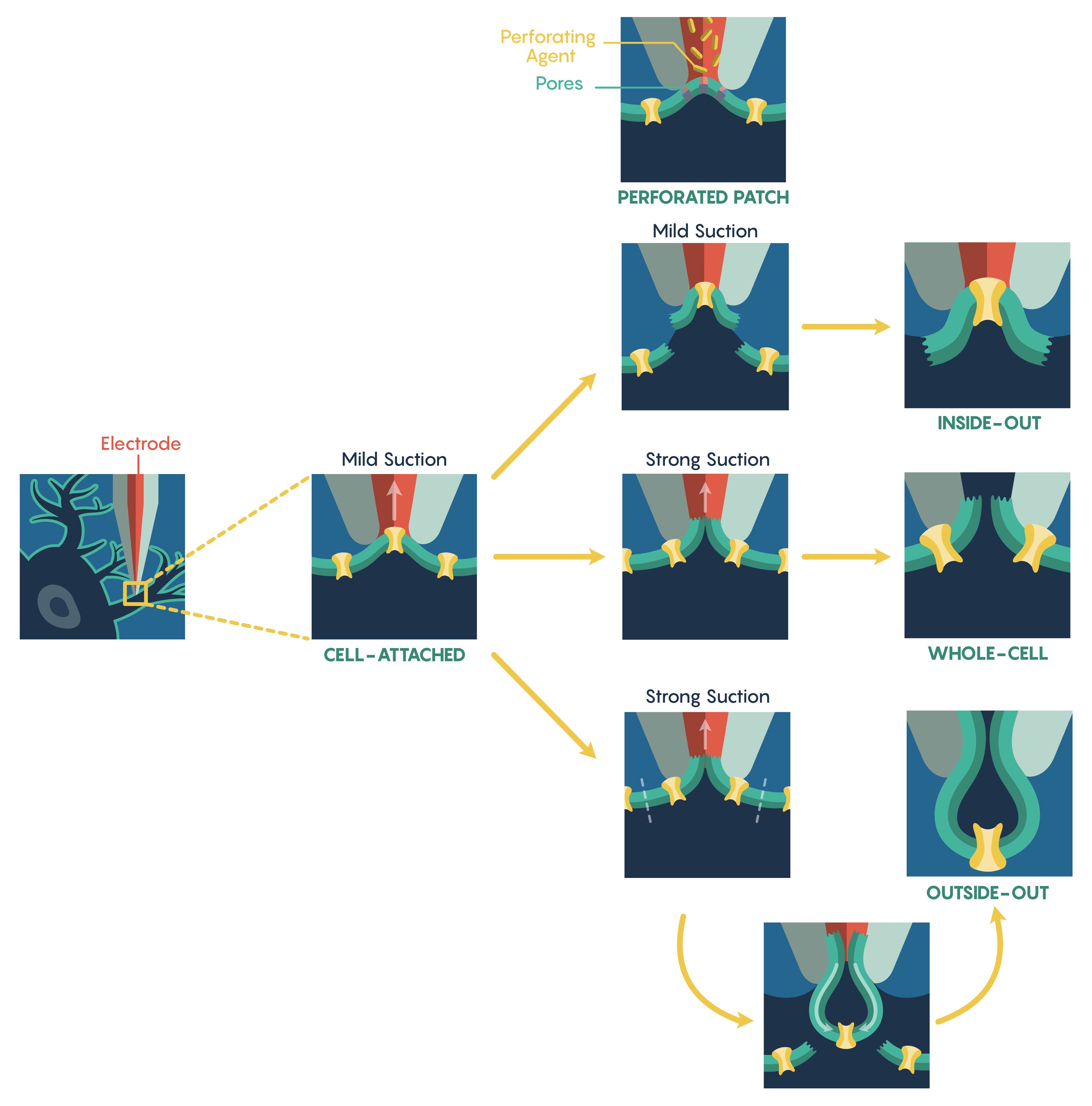
Figura\(\PageIndex{1}\). Métodos electrofisiológicos. El método de parche-clamp unido a la célula. Las configuraciones de parche perforado, de afuera y de adentro hacia afuera. Para mostrar diálisis potencial, el lumen de la pipeta y el citoplasma están representados por rojo y azul marino, respectivamente.
Para aumentar el acceso eléctrico al interior de la celda, se utilizan dos métodos diferentes. Primero, la solución interna de pipeta contiene agentes antibióticos o antifúngicos (por ejemplo, nistatina, gramicidina, anfotericina-B), estos agentes forman pequeños poros monovalentes permeables a iones que 'perforan' (Figura\(\PageIndex{1}\).) la membrana permitiendo el acceso a toda la célula. Es importante destacar que estos poros no permiten el paso de proteínas asegurando así que el contenido intracelular permanezca intacto preservando las vías de señalización intracelular. Sin embargo, esta técnica de parche perforado tiene varias limitaciones incluyendo mayor ruido eléctrico, pérdida de resolución de canal único e inestabilidad de parche. Adicionalmente, la creación de un parche perforado requiere un periodo de tiempo significativamente largo.
Un enfoque alternativo a la técnica de parche perforado es aplicar una succión fuerte, o transitorio de voltaje breve, después de la formación del sello Giga-ohm para romper la membrana plasmática intacta. Al romperse, se establece una continuidad eléctrica y física de baja resistencia entre la pipeta y el interior de la celda y esta nueva configuración se conoce como configuración de celda completa (Figura\(\PageIndex{1}\).). En consecuencia, esta configuración permite mediciones directas del potencial de membrana de la célula (vía pinza de corriente) y su manipulación (vía abrazadera de voltaje). Debido a la continuidad física entre el interior de la célula y la solución de pipeta, el contenido citosólico puede controlarse razonablemente. Además, a diferencia del parche perforado, las manipulaciones farmacológicas o iónicas tanto del entorno intracelular como extracelular pueden conducir a la eulicidación de corrientes de iones individuales. Sin embargo, esta continuidad física entre el lumen de la pipeta y el citosol también puede dializar y/o alterar la actividad de los sistemas endógenos de segundos mensajeros. Por lo tanto, los registros de células enteras son vulnerables a esta limitación y es crítico evaluar el 'deterioro' actual del sistema y las células dentro de este tipo de sistemas de grabación de células enteras.
También es posible crear variaciones 'libres de células' de técnicas de patch-clamp también existen. Por ejemplo, tras la formación de giga-sello, el electrodo puede retraerse suavemente tirando del parche de membrana hacia la solución de baño. Esta disposición, conocida como configuración de adentro hacia afuera (Figura\(\PageIndex{1}\).), permite la manipulación completa de la cara citoplásmica de la membrana plasmática a través de la perfusión del baño, característica que no es posible en la configuración celular unida. Como resultado, los parches de adentro hacia afuera permiten la manipulación del entorno inmediato de la cara de la membrana interna. Desafortunadamente, esta disposición sufre de la pérdida de vías de señalización intracelulares que actúan sobre los canales iónicos después de la escisión del parche; una consideración particularmente importante al examinar la actividad alterada del canal.
De manera similar, un parche externo (Figura\(\PageIndex{1}\).) también requiere la retracción suave del electrodo de parche desde la configuración de celda completa. Sin embargo, en esta situación, la retracción de la pipeta obliga a la membrana plasmática que rodea la punta del electrodo a desprenderse de la célula y volver a sellar formando un parche independiente de la célula cuya membrana extracelular está orientada hacia la solución de baño. Esto permite que un experimentador tenga un control completo sobre el ambiente intracelular y pueda intercambiar rápidamente diferentes fármacos fisiológicos o farmacológicos externos sobre el mismo parche.


