3.9: Enfoques genéticos para examinar el cerebro intacto y vivo
- Page ID
- 121906
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Etiquetado del cerebro vivo
Debido a la complejidad del cerebro de los mamíferos, sigue siendo un gran desafío descifrar los patrones de conectividad realizados en y por las neuronas recién nacidas a medida que se integran en los circuitos del cerebro adulto. Con importantes avances tanto en genética molecular como en microscopía óptica, nuestra capacidad para consultar no solo morfologías neuronales, sino también la composición molecular y celular de neuronas individuales y sus redes sinápticas asociadas se ha hecho posible.
Podría decirse que una de las contribuciones más influyentes a la neurociencia contemporánea ha sido el uso de proteínas fluorescentes (FP) y su expresión dirigida en neuronas vivas del tejido cerebral de mamíferos. La amplia gama de FP disponibles proporciona una caja de herramientas en constante expansión de reporteros vitales y etiquetas de expresión génica. Las aplicaciones de estas proteínas van desde indicadores vitales expresados a lo largo del citoplasma hasta etiquetas de fusión de proteínas subcelulares, que juntas pueden usarse para monitorear el proceso de integración de circuitos in vivo usando métodos electrofisiológicos y imágenes fluorescentes.
Más allá de simplemente marcar las células para su identificación, se han desarrollado otros métodos para explotar las propiedades vitales de los FP para investigar las propiedades neuronales. Por ejemplo, la phluorina supereclíptica, que fluoresce a pH neutro pero se apaga a pH ácido, puede usarse para monitorear el tráfico e intercambio de compartimentos intracelulares dentro de las neuronas. Esta variante permite la obtención de imágenes directas de la dinámica de membrana, exocitosis y endocitosis de receptores sinápticos, y liberación de neurotransmisores in vitro e in vivo. Más recientemente, un nuevo método denominado reconstitución de GFP a través de parejas sinápticas (GRASP) muestra promesa para revelar interacciones sinápticas entre neuronas en contacto. Al unir fragmentos de GFP divididos para separar las proteínas pre y possinápticas, se puede observar la reconstitución de la fluorescencia de GFP cuando las células genéticamente dirigidas forman pares sinápticos. Aunque esta tecnología se ha aplicado con éxito para revelar sinapsis de invertebrados, aún no se ha demostrado en roedores (Gordon y Scott, 2009).
El rango de reporteros FP para visualizar morfologías neuronales, dinámica celular y función sinapsis continúa expandiéndose. Sin embargo, quizás el factor más limitante para el uso de FP en neurociencia es nuestro conocimiento incompleto de la regulación génica neuronal. A menudo, los reporteros transgénicos no logran recapitular los patrones endógenos de expresión génica, o tales patrones son demasiado amplios para identificar subtipos neuronales con precisión celular.
Trazado de circuitos transsinápticos
Un objetivo importante para comprender los mecanismos del desarrollo neuronal, la formación de sinapsis y el cableado del circuito ha sido dilucidar los nodos y patrones de conectividad sináptica. Un ángulo creativo para abordar este desafío ha sido la incorporación de genes que codifican FP y proteínas de fusión FP en vectores virales neurotrópicos, que muestran la capacidad innata de infectar neuronas y diseminarse trans-sinápticamente por todo el sistema nervioso (Kuypers y Ugolini, 1990; Callaway, 2008).
Dos tipos de virus que se han empleado ampliamente para este propósito incluyen la rabia y el herpes. Los virus del herpes pertenecen a una familia de virus de ADN bicatenario, mientras que la rabia pertenece a una familia de virus ARN de cadena negativa (Voyles, 1993). Aunque evolutivamente diferentes, ambos están dotados de la capacidad única de unirse e infectar células neuronales. Esta infectividad específica de tipo celular se confiere a los virus a través de sus partículas maduras de cubierta envuelta, las cuales están hechas tanto de la membrana del huésped como de glicoproteínas codificadas viralmente. Las proteínas compuestas de la envoltura son los determinantes que median el reconocimiento de la membrana neuronal y la posterior infección neurona a neurona mediante la unión a los receptores de la superficie de la membrana.
Los virus del herpes se han utilizado para etiquetar circuitos neuronales durante años. Dos cepas de rastreo comunes son el virus del herpes simplex 1 (HSV-1; Lilley et al., 2001) y el virus de la pseudorrabia (PRV; Enquist, 2002). Ambas variantes se diseminaron predominantemente en una dirección retrógrada, y cada una se ha aplicado efectivamente para disecar conexiones de sinapsis y circuitos en el cerebro de roedores (Callaway, 2008). Sin embargo, una limitación para el uso de los virus del herpes para el análisis de circuitos es la propagación polisináptica. Debido a la vasta cohorte de tipos celulares dentro del tejido cerebral, el número de sinapsis formadas en cada una de esas células y el alto grado de interconectividad en los circuitos neuronales intactos, este enfoque aún plantea un desafío para diseccionar patrones precisos de conectividad neuronal. Para simplificar el análisis del circuito trans-sináptico, Wickersham et al. (2007b) idearon una estrategia inteligente de complementación de proteínas de cubierta que permite el rastreo monosináptico de conexiones neuronales utilizando un virus de la rabia pseudotipificado (RV). No confundir con el PRV (que como se indicó anteriormente es en realidad un virus del herpes), el pseudotipado de una partícula viral se refiere a modificar sintéticamente la envoltura viral para reconocer un receptor extraño que normalmente no está presente en las membranas de las neuronas de mamíferos. La estrategia se discutirá brevemente a continuación, y para mayor referencia también ver Wickersham et al. (2007a), Arenkiel y Ehlers (2009), Hasenstaub y Callaway (2010).
El gen RV que codifica su glicoproteína (denominada G) ha sido el objetivo principal para la modificación genética y la ingeniería de vectores RV. La eliminación de G del genoma del RV hace que el virus sea incapaz de generar partículas infecciosas e incompetente para la replicación. Sin embargo, incluso en ausencia del gen nativo de la glicoproteína, el RV sigue siendo capaz de expresar su genoma. Por lo tanto, G puede reemplazarse con secuencias que codifican FP o biomoléculas etiquetadas con FP para generar vectores RV para la expresión de indicadores vitales (Wickersham et al., 2007a). Para que estos virus de replicación incompetentes sean útiles para estudios de rastreo de circuitos, deben ser “armados” proporcionando una envoltura en trans propagando y empaquetando las partículas in vitro usando líneas celulares diseñadas para sintetizar la glicoproteína requerida.
Para realizar el rastreo de circuitos monosinápticos y dirigir el RV que expresa FP a los subconjuntos neuronales deseados, las partículas primero pueden pseudotipificarse con la proteína de cubierta extraña EnVA del virus de la leucosis del sarcoma aviar, que se une específicamente a una clase de proteínas de membrana aviar llamadas receptores TVA ( Barnard et al., 2006). El direccionamiento genético de subconjuntos neuronales para la expresión de TVA dirige la infección por RV solo a esas neuronas. Para facilitar el rastreo monosináptico, Wickersham et al. (2007a) agregaron un giro inteligente a este enfoque. Al introducir un plásmido que codifica la proteína G de RV de tipo silvestre, el virus desarmado que expresa EGFP ahora puede sufrir una ronda de infección posterior a parejas presinápticas de neuronas dirigidas a TV. Dado que solo la neurona inicialmente infectada contiene G, la propagación viral cesa después de una ronda de salto monosináptico. Incluir un plásmido que codifica una FP roja permite identificar la célula originalmente dirigida para la infección entre la red monosináptica de células marcadas con GFP (Figura\(\PageIndex{1}\)). Por supuesto, debe considerarse que el verdadero rastreo monosináptico depende de dirigirse a neuronas individuales para la expresión de G. Si, por ejemplo, las células acopladas sinápticamente albergan G, pero solo una de ellas sirve como célula fuente primaria de infección mediada por TV, entonces la propagación viral puede volverse multisináptica a través de rondas posteriores de empaquetamiento viral en parejas presinápticas. Por lo tanto, el control de rastreo monosináptico depende directamente de la precisión del direccionamiento neuronal para los componentes de rastreo de RV.
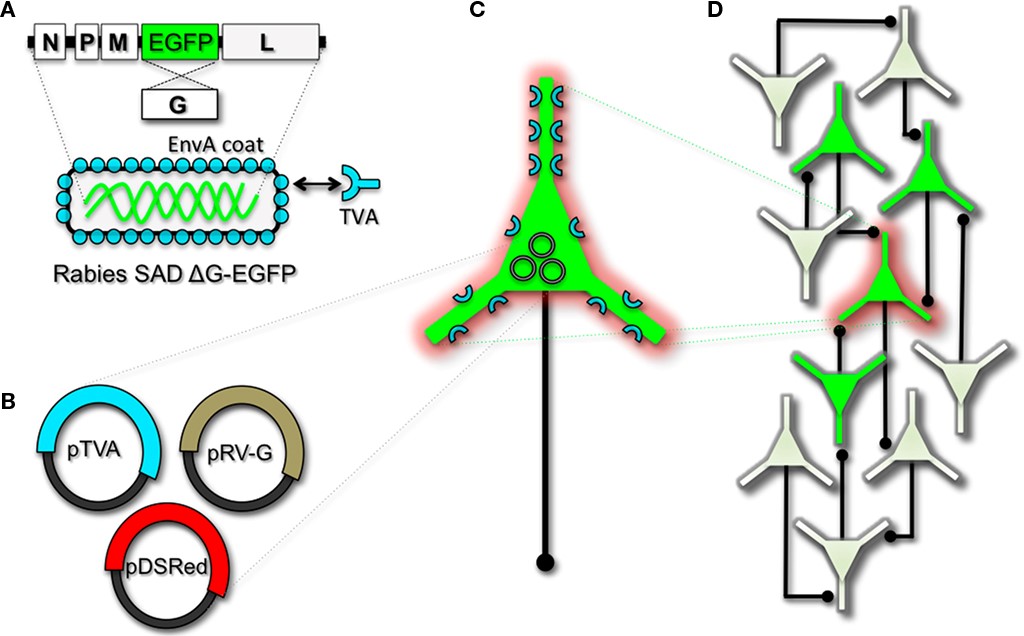
Figura\(\PageIndex{1}\). Ingeniería y pseudotipificación del virus de la rabia (RV) para el rastreo transneuronal. (A) El RV puede modificarse genéticamente para expresar EGFP reemplazando la secuencia genómica que codifica la proteína de la cubierta G. El RV mutante de deleción G genéticamente modificado debe propagarse in vitro para suministrar una proteína de cubierta. Por lo tanto, la partícula puede pseudotipificarse proporcionando una proteína de cubierta extraña tal como EnVA, que se origina a partir del virus de la leucosis aviar y se une específicamente a él a su receptor afín TVA. El RV pseudotipado con EnVA se puede usar para infectar selectivamente neuronas que han sido genéticamente dirigidas para la expresión de TVA. Al incluir construcciones adicionales que codifican la proteína de la cápside G de tipo silvestre y un “relleno celular” de color rojo (B), el RV modificado puede ser dirigido genéticamente a neuronas individuales para mapeo de circuitos restringidos y rastreo monosináptico (C). Dado que no existen receptores endógenos en el cerebro de los mamíferos para el ENVA, solo las neuronas que están programadas para expresar TVA son capaces de ser infectadas por los viriones pseudotipificados por EnVA. Debido a que la secuencia de la proteína G de tipo silvestre se ha eliminado del genoma del RV, G debe suministrarse por complementación para permitir la propagación trans-sináptica de las neuronas dirigidas a la infección. (D) La propagación viral cesa monosinápticamente debido a la ausencia de G en poblaciones neuronales no modificadas.
Esta nueva tecnología ahora hace factible diseccionar patrones complicados de conectividad neuronal con precisión sináptica (Stepien et al., 2010; Weible et al., 2010). Dirigirse a neuronas nacidas en adultos para el trazado de circuitos monosinápticos tiene cierta promesa para dilucidar los números, tipos y entradas sinápticas que podrían marcar el comienzo y/o promover la formación y mantenimiento de la integración de circuitos funcionales. Desafortunadamente, sin embargo, hay que aprender mucho sobre los mecanismos virales de infectividad, propagación trans-sináptica y replicación para hacer que los métodos de rastreo viral sean ampliamente aplicables para el análisis detallado de circuitos en todo el sistema nervioso. Por ejemplo, una limitación importante para el trazado de circuitos mediado por virus utilizando vectores de tipo VHS o RV es el inevitable deterioro de la salud de las células neuronales con el tiempo (Callaway, 2008). Mientras que las partículas de HSV muestran niveles rápidos y altos de expresión en 1—2 días, también muestran una fase de replicación de tipo lítico que induce pérdida neuronal dentro de 1—2 semanas. Aunque la mayoría de las neuronas parecen tolerar la infección por RV por períodos más largos de tiempo, eventualmente también muestran signos de disfunción y mala salud más allá de las 2 semanas. Además, no se sabe mucho con respecto al tropismo exacto para que los diversos virus infecten determinados subtipos de neuronas. Aunque es claro que las partículas virales pueden cruzar sinapsis axo-dendríticas, dendrodendríticas, glutamatérgicas y GABAérgicas (Willhite et al., 2006; Wickersham et al., 2007b; Stepien et al., 2010; Miyamichi et al., 2011; Rancz et al., 2011), no se han determinado las diferentes eficacias de transferencia. Debe existir una unión preferencial de partículas virales a diferentes tipos de proteínas presinápticas, lo que finalmente resultaría en una transferencia más eficiente de virus entre ciertos pares sinápticos. Esta información es actualmente desconocida, por lo que sigue siendo un desafío realizar de manera confiable análisis cuantitativo de circuitos imparciales utilizando virus durante periodos prolongados de tiempo.
Aunque los actuales métodos de rastreo de circuitos trans-sinápticos están en su infancia, con una mayor comprensión de los mecanismos virales, y un posterior “re-utillaje” de vectores existentes, uno puede imaginar fácilmente que esta vía experimental para el mapeo de circuitos intactos se volverá indispensable. Además, esta metodología tiene una promesa definitiva de abordar cuestiones pendientes en la neurogénesis adulta, que van desde la identificación de los tipos de conexiones que se realizan y rompen dinámicamente durante el desarrollo del circuito, hasta la exposición de la cohorte completa de tipos de entrada que se observan en circuitos maduros dentro del cerebro intacto.
Manipulación de la actividad celular y del circuito
La asignación de subconjuntos neuronales y sus redes asociadas ha sido invaluable para nuestra comprensión actual de las morfologías neuronales y la arquitectura de circuitos. Sin embargo, para comprender completamente los mecanismos celulares y moleculares que guían la formación de sinapsis de neuronas nacidas en adultos y la integración de circuitos, debemos ser capaces de sondear la conectividad neuronal. Los recientes avances en actuadores codificados genéticamente ofrecen ahora esta posibilidad. Tecnologías como la expresión heteróloga de receptores o canales, la optogenética y las toxinas sinápticas genéticamente codificadas están comenzando a permitir el mapeo de circuitos funcionales con precisión sináptica (Luo et al., 2008; Arenkiel y Ehlers, 2009; Figura \(\PageIndex{3}\)). Al dirigirse a tipos de células pre o possinápticas para manipulaciones de actividad, junto con imágenes funcionales y/o grabaciones electrofisiológicas, ahora es posible diseccionar genéticamente nodos de circuito monitoreando las respuestas de salida sintética evocadas. Algunos de los primeros esfuerzos para controlar genéticamente la producción neuronal se basaron en la expresión modificada por ingeniería genética de receptores heterólogos en neuronas que normalmente no muestran su presencia. Por ejemplo, la expresión de receptores opiáceos modificados en los cerebros de ratones transgénicos demostró que la introducción de ligandos exógenos sintéticos podría activar subconjuntos neuronales (Zhao et al., 2003). Hasta la fecha, numerosas variaciones sobre este tema han demostrado ser efectivas tanto para impulsar la excitabilidad neuronal como para la inhibición. Las estrategias complementarias a estos métodos han sido expresar genéticamente moléculas pequeñas para la inactivación de la transmisión sináptica (Karpova et al., 2005), o toxinas que interrumpen la transmisión sináptica (Harms et al., 2005; Ehlers et al. al., 2007).
Estrategias genéticas para marcar y manipular neuronas y circuitos
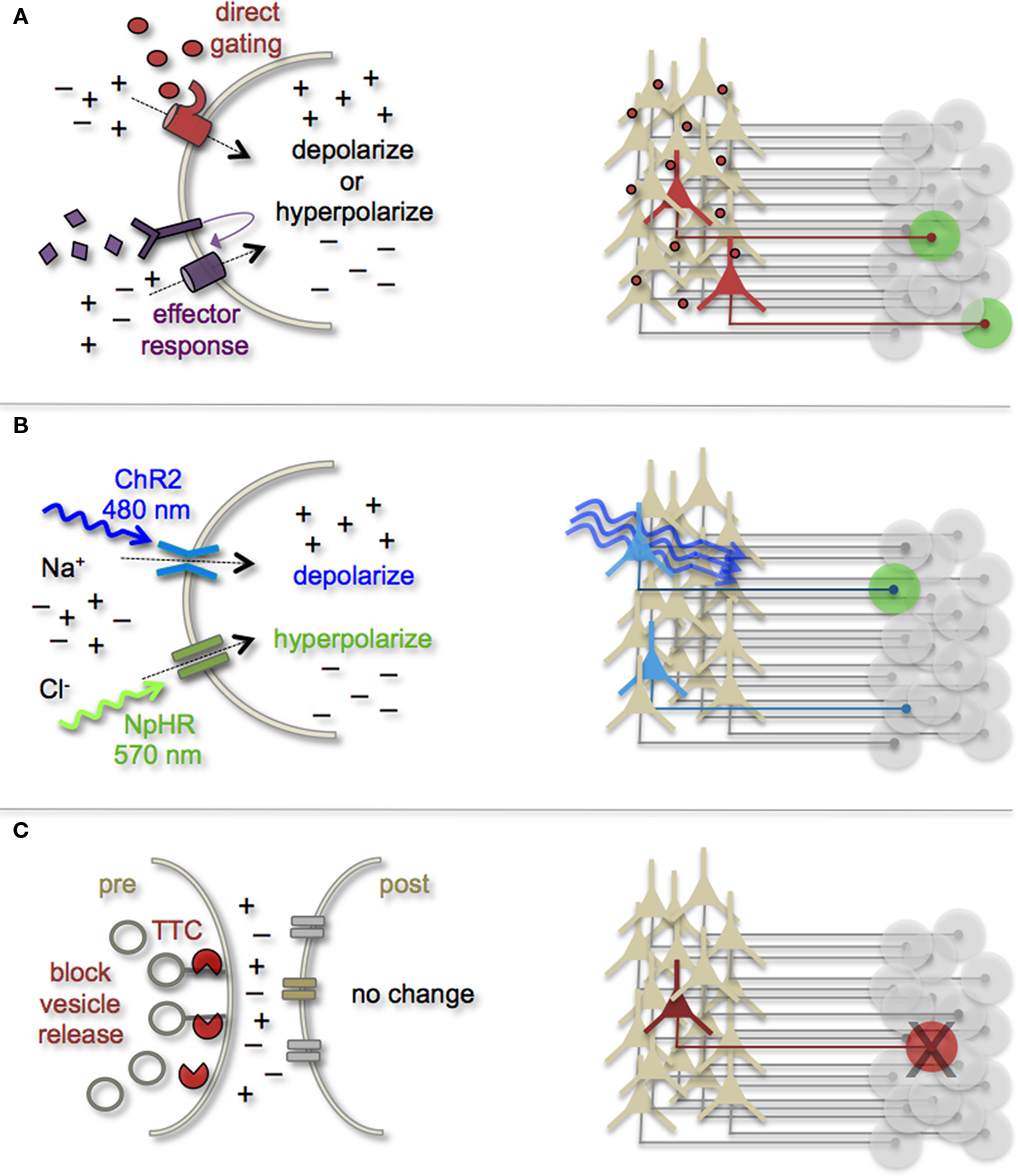
Figura\(\PageIndex{3}\). (A) Las neuronas pueden ser dirigidas para la expresión de receptores heterólogos. Estos receptores extraños pueden ser controlados directa o indirectamente mediante la aplicación de ligandos exógenos (representados como óvalos rojos y diamantes púrpuras). Izquierda: la activación del receptor heterólogo mediante la aplicación de ligandos sintéticos puede usarse para cambiar el equilibrio iónico de una neurona y así las propiedades de disparo. Derecha: dependiendo de las propiedades moleculares, los ligandos exógenos se diseminan de manera variable por el tejido cerebral. Todas las neuronas que expresan los receptores heterólogos son capaces de activarse e impulsar las respuestas de las células diana (representadas como círculos verdes). (B) La expresión de canales regulados por la luz se puede usar para modular el disparo neuronal con fotones. Izquierda: ChR-2 es un canal catiónico no selectivo que responde óptimamente a la luz azul. La fotoestimulación de este canal da como resultado corrientes internas positivas, despolarización y disparo neuronal. NpHR es una bomba de cloruro fotoactiva que responde de manera óptima a la luz amarilla verdosa. La fotoestimulación de esta proteína de bombeo da como resultado corrientes internas negativas, hiperpolarización y silenciamiento neuronal. Derecha: Los reporteros de fusión FP pueden ser utilizados para identificar células que expresan proteínas fotosensibles (representadas por coloración azul). Solo las neuronas que expresan los canales fotosensibles y reciben fotones muestran modulación activada por la luz, mientras que las dianas de circuito aguas abajo pueden monitorearse para detectar respuestas fotográficas possinápticas (coloración verde). (C) La expresión dirigida de toxinas sinápticas en neuronas puede usarse para bloquear la liberación de vesículas sinápticas e inhibir la neurotransmisión a dianas possinápticas. TTC, toxina tetánica.


