7.5: Lesiones de ADN
- Page ID
- 53051
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)La naturaleza robusta del ADN debido a sus dobles cadenas complementarias ya se ha observado varias veces. Consideramos ahora con más detalle los procesos de reparación que rescatan el ADN dañado. El ADN no es tan robusto como lo hacen los medios populares. De hecho, para tomar como ejemplo el libro y la película de gran éxito, Jurassic Park, aunque sin duda hay algo de ADN que se puede encontrar ya sea incrustado en parásitos ligados al ámbar, o quizás en tejidos blandos conservados (que se encuentran en lo profundo de un fémur fosilizado, Schweitzer et al, 2007). Es probable que esté muy degradado, y la reproducción precisa es imposible sin muchas muestras de las que trabajar.
El insulto más común al ADN de los organismos vivos es la depuración, en la que se hidroliza el enlace β-N-glicosídico entre una adenina o guanina y la desoxirribosa. En células de mamíferos, se estima en casi 10000 purinas por generación celular, y generalmente, la tasa promedio de pérdida a pH fisiológico y fuerza iónica, y a 37°C, es aproximadamente 3 x 10 -11 /seg. La despirimidación de los residuos de citosina y timina también puede ocurrir, pero hacerlo a un ritmo mucho más lento que la depuración. A pesar de la alta tasa de pérdida de estas bases, generalmente se remedian fácilmente mediante reparación por escisión de bases (BER), lo que se discute más adelante en esta sección. Por lo tanto, es raro que la depuración o despirimidinación conduzcan a la mutación.
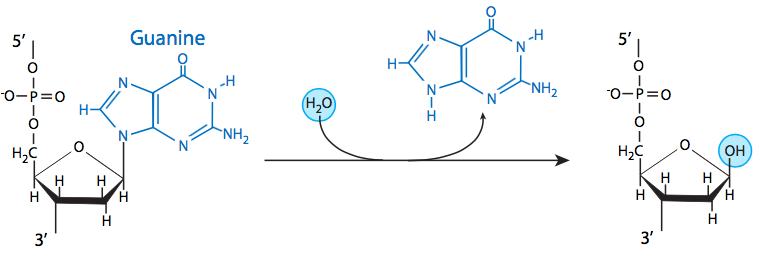
Tres de las cuatro bases de ADN, adenina, guanina y citosina, contienen grupos amina que pueden perderse en una variedad de reacciones dependientes del pH y la temperatura que convierten las bases en hipoxantina, xantina y uracilo, respectivamente. Esto a veces puede conducir a mutaciones permanentes ya que durante la replicación, sirven como molde para la síntesis de una cadena complementaria, y donde debe ir una guanina, por ejemplo (complementaria a la citosina), se puede insertar una adenina (porque complementa el uracilo, el producto de desaminación de la citosina).
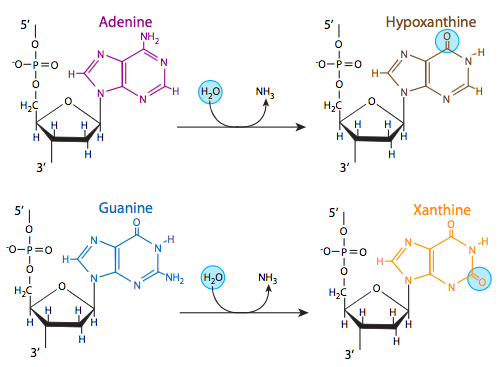
Otra desaminación, de la base modificada metilcitosina, también puede conducir a una mutación tras la replicación. Algunas citosinas pueden estar metiladas como parte de un proceso regulador para inactivar ciertos genes en eucariotas, o en procariotas como protección contra endonucleasas de restricción. Cuando la citosina metilada es desaminada, produce una timina, que cambia el nucleótido complementario (tras la replicación) de una guanina a una adenina. La desaminación de las citosinas ocurre casi al mismo ritmo que la depuración, pero la desaminación de otras bases no es tan generalizada: la desaminación de adeninas, por ejemplo, es 50 veces menos probable que la desaminación de la citosina.
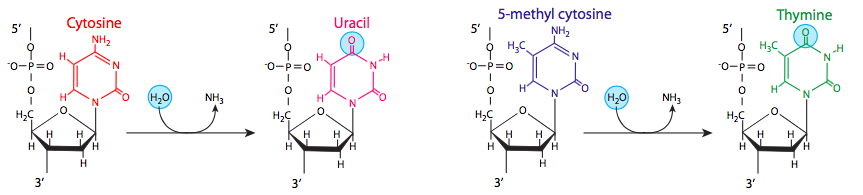
Timina buena, Uraclo mala. ¿Por qué se encuentra la timina en el ADN y no en el uracilo? Resulta que la frecuencia de desaminación de citosina puede dar una pista de por qué las células han dado un paso extra (literalmente, ya que el uracilo es un precursor en la biosíntesis de timina) para hacer un nuevo nucleótido “estándar” para el ADN cuando el uracilo funcionó bien para el ARN, presumiblemente la molécula genética más antigua. Considera esto: si el uracilo fuera estándar para el ADN, entonces las conversiones de desaminación muy frecuentes de C a U no serían captadas mediante la comprobación de errores en busca de bases que no son de ADN, y la tasa de mutación se dispararía. Afortunadamente, dado que T ha evolucionado para ser el compañero de apareamiento de bases estándar de la adenina en el ADN, el uracilo es rápidamente reconocido y eliminado por múltiples ADN glicosilasas de uracilo (más sobre eso más adelante en este capítulo), y la integridad de nuestras secuencias de ADN es mucho más segura.
Todas las bases de ADN pueden cambiar espontáneamente a un isómero tautomérico (amino a imino, keto a enol, etc), aunque el equilibrio se inclina fuertemente hacia una que hacia la otra. Cuando se presenta un tautero raro, se empareja de bases de manera diferente a su forma estructural más común: guaninas con timinas y adeninas con citosinas. Aquí de nuevo, una mutación puede propagarse durante la replicación del ADN.
El ADN dentro de una célula también debe enfrentarse a especies reactivas oxidativas (ROS) generadas por los procesos metabólicos de la célula. Estos incluyen oxígeno singlete, radicales peróxido y peróxido, así como radicales hidroxilo. aunque se piensa que los radicales peróxido de hidrógeno y peróxido no atacan directamente al ADN sino que generan radicales hidroxilo que sí. La mayoría de estas ROS se generan en las mitocondrias durante la fosforilación oxidativa y se filtran, aunque algunas pueden generarse en peroxisomas, o en algunas reacciones citosólicas. Dependiendo de qué parte del ADN se dirija, las ROS pueden causar una variedad de lesiones que incluyen roturas de cadenas y eliminación de bases.
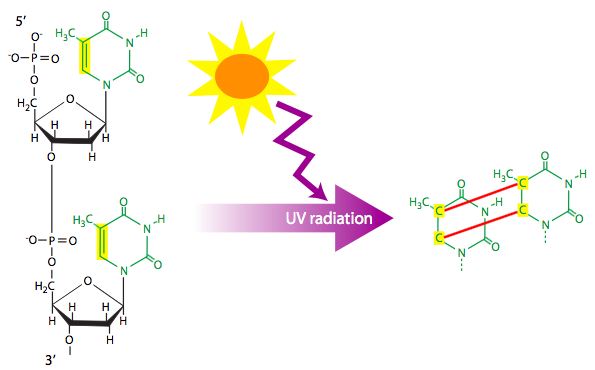
La radiación ionizante (por ejemplo, rayos X) y la radiación ultravioleta pueden causar lesiones en el ADN. La radiación ionizante suele ser una causa de roturas bicatenarias del ADN. Como se describe más adelante en el capítulo, el proceso de reparación de roturas bicatenarias necesariamente conduce a cierta pérdida de información, y potencialmente podría noquear a un gen. La radiación ultravioleta que golpea las timinas adyacentes puede hacer que reaccionen y formen un dímero de timina de ciclobutilo (cuatro carbonos unidos en circuito cerrado). El dímero tira cada timina hacia la otra, fuera de la alineación normal. Dependiendo de la forma estructural del dímero, esto es suficiente para frenar la máquina de replicación y detener la replicación. Sin embargo, algunos datos sugieren que el emparejamiento normal de bases con adenina puede ser posible bajo algunas condiciones, aunque, es probable que solo resulte un par de bases, y la base faltante podría conducir a una sustitución aleatoria o una deleción en la cadena recién sintetizada.
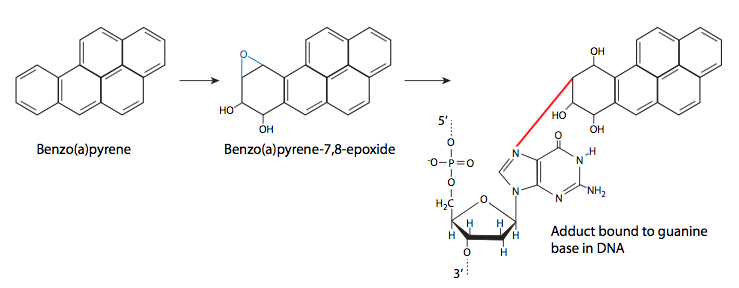
Finalmente, consideramos la formación de aductos químicos (grupos unidos covalentemente) en el ADN. Pueden provenir de una variedad de fuentes, incluyendo la oxidación de lípidos, el humo del cigarrillo y las toxinas fúngicas. Estos aductos se unen al ADN de diferentes maneras, por lo que también hay una variedad de efectos diferentes de los aductos. Algunos pueden ser aductos muy pequeños -muchos carcinógenos ambientales son agentes alquilantes, transfiriendo grupos metilo u otros grupos alquilo pequeños al ADN. Otros aductos son más grandes, pero también se unen covalentemente a una base nitrogenada de ADN. Ejemplos comunes son el benzo (a) pireno, un componente mutagénico principal del humo del cigarrillo, y la aflatoxina B1, producida por una variedad de hongos de la familia Aspergillus. El benzo (a) pireno se convierte en epóxido de benzo (a) pireno diol, que luego puede atacar el ADN. Cuando esto sucede, el anillo at pireno se intercala entre bases, provocando cambios estéricos que conducen a la deformación local del ADN y a la interrupción de la replicación normal del ADN.
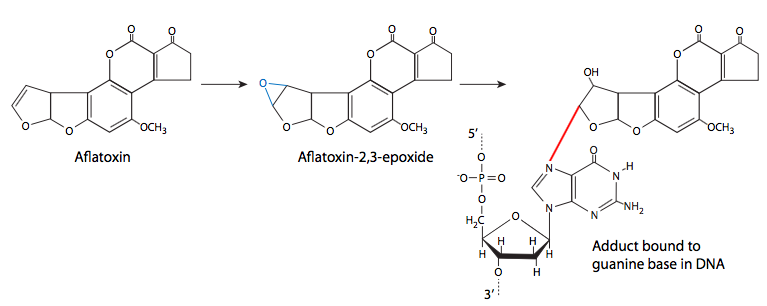
La aflatoxina B1 es la aflatoxina primaria producida por algunas especies (esp. flavus, parasiticus) de Aspergillus, un moho muy común que crece en el grano almacenado (así como detritus y otra materia vegetal muerta o moribunda). Además de infectar el grano, es un problema común con los cacahuetes almacenados. En niveles altos, la aflatoxina es agudamente tóxica, pero a niveles más bajos, tiene la propiedad insidiosa de ser imperceptible tóxica pero mutagénica. Al igual que el benzo (a) pireno, se metaboliza en un epóxido y luego reaccionará con el ADN para formar un aducto que puede interrumpir la replicación.
Algunos agentes alquilantes, particularmente los compuestos N-nitroso, se forman en las condiciones ácidas del estómago a partir de la nitrosación de nitritos naturales producidos a partir de alimentos (reducción de nitratos), o nitritos ambientales en el agua potable. Irónicamente, mientras que algunos agentes alquilantes pueden causar cánceres, otros se usan terapéuticamente como tratamientos anticancerosos, por ejemplo mitomicina, melfalán. La idea, como ocurre con muchos tratamientos contra el cáncer, es que aunque tales fármacos causan daños en el ADN tanto a las células no cancerosas como a las células cancerosas, la alta tasa de proliferación de células cancerosas les da menos posibilidades de reparación del ADN dañado, y por lo tanto mayor probabilidad de que el daño pueda detener la replicación y conducir a células muerte.
De manera similar, los agentes quimioterapéuticos reticulantes como el cisplatino (un átomo de platino unido a dos grupos cloruro y dos grupos amino) también se unen al ADN. Los grupos cloruro son desplazados primero por el agua y luego por otros grupos incluyendo sitios en el ADN. Aunque a veces se clasifica como un agente alquilante, obviamente no lo es, pero actúa de manera similar. Sin embargo, el cisplatino va un paso más allá que un simple agente alquilante, porque tiene otro sitio reactivo y, por lo tanto, puede reticular (unir covalentemente) otro nucleótido, posiblemente en otra cadena de ADN, haciendo una fuerte obstrucción a la replicación del ADN. El cisplatino también puede entrecruzar las proteínas con el ADN.
El benzo (a) pireno y la aflatoxina B1 no son mutágenos en sí mismos. Una vez que están en la célula, el metabolismo normal de estos compuestos conduce a la formación de epóxido de diol, que luego puede atacar al ADN. Aunque el 7-nitrógeno (N7) de la guanina es más nucleófilo y es un objetivo para la aflatoxina, la mayoría de los aductos de epóxido de benzo (a) pirenodiol se unen al 2-nitrógeno de los residuos de guanina.
Existen normas federales (20-300 partes por mil millones dependiendo del uso) para la aflatoxina en diversas formas de pienso animal a base de granos, especialmente los piensos a base de maíz, porque la toxina puede pasar a través del animal a la leche, así como permanecer en la carne. Además de los piensos, existen máximos federales para cacahuetes y productos de maní, nueces de Brasil, pistachos y otros alimentos (accionables a 20 ppb).
Pues bien, ¿qué puede hacer una célula pobre cuando su ADN está siendo constantemente asolado? Resulta que hay algunos muy buenos procesos de reparación que están constantemente trabajando en el ADN, escaneándolo en busca de defectos y, en lo posible, haciendo reparaciones. A menudo las reparaciones son perfectas, si la cadena complementaria está intacta, a veces se deben introducir mutaciones, y finalmente hay ocasiones en las que la reparación es imposible, y se desencadena la apoptosis para matar la célula y evitar la propagación del ADN dañado.


