12.7: Actina - Estructuras de Miosina en el Músculo
- Page ID
- 53371
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
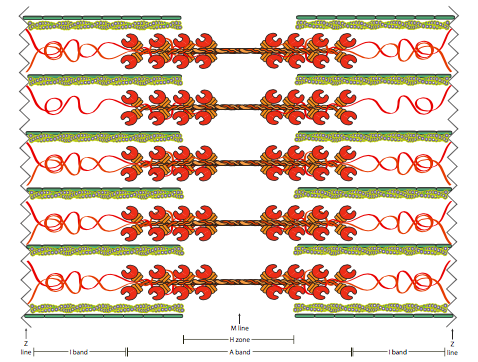
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Las proteínas motoras que transportan materiales a lo largo de los microfilamentos actuantes son similares en algunos aspectos, como el grupo de cabeza globular que se une e hidroliza ATP, pero diferentes en otras formas, como el movimiento catalizado por la hidrólisis de ATP. Gran parte de la f-actina y miosina en las células del músculo estriado y cardíaco se encuentra en una disposición peculiar diseñada para proporcionar una respuesta contráctil robusta en toda la longitud de la célula. El sarcómero es una disposición de fibras alternas de f-actina (también conocidas como “fibras delgadas” en base a su aparición en micrografías electrónicas) y miosina II (o “fibras gruesas”). Aunque normalmente no pensamos en la proteína motora como una fibra, en este caso las colas de las moléculas de miosina II se entrelazan para formar una fibra continua de moléculas de miosina. A medida que avanza el ciclo contráctil, las moléculas de miosina agarran las fibras de actina adyacentes y las mueven. En la Figura\(\PageIndex{11}\), se puede observar que se construye un sarcómero de manera que las fibras estacionarias de miosina se localizan centralmente, con dos conjuntos paralelos de fibras de actina intercaladas entre las fibras de miosina, a la izquierda y a la derecha del centro. Tenga en cuenta que las fibras de actina no cruzan la línea central, y que en el centro, las moléculas de miosina cambian de orientación. El efecto fisiológico de esto es que los filamentos de actina son todos tirados hacia adentro hacia el centro del sarcómero. El sarcómero a su vez, es simplemente uno de los muchos conectados entre sí para formar una miofibrilla. Las miofibrillas se extienden a lo largo de la célula muscular.

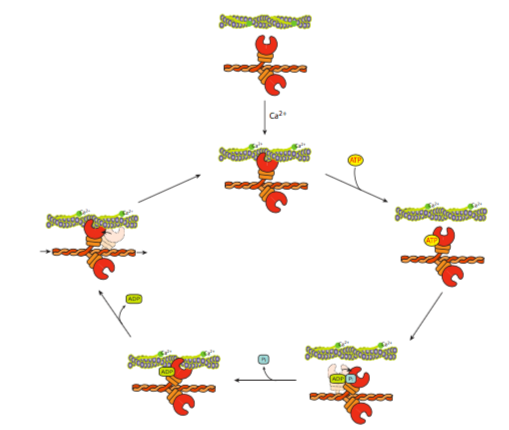
Cuando la cabeza de miosina está en su estado de reposo, está firmemente unida al filamento de actina. De hecho, el rigor mortis ocurre en animales muertos porque ya no se está haciendo ATP, y así los sarcómeros quedan encerrados en su lugar. El rigor comienza aproximadamente 2-3 horas después de la muerte en humanos, después de que se agotan las reservas de ATP. Cuando el cuerpo se relaja de nuevo en aproximadamente 3 días, se debe a la descomposición y descomposición de las proteínas actina y miosina. Sin embargo, mientras todavía son animales vivos, el ATP está generalmente disponible, y puede unirse a la cabeza de la miosina, haciendo que pierda afinidad por la f-actina, y suelte (Figura\(\PageIndex{12}\)). En este punto, no se ha producido ningún movimiento significativo. Sin embargo, una vez que el ATP se hidroliza, la cabeza de miosina puede volver a unirse a la f-actina un poco más abajo del filamento de lo que tenía originalmente. La energía liberada se almacena en la región del cuello. El ADP y el P i también están adheridos a la cabeza de miosina. El siguiente paso es que el P i deje caer la miosina, lo que lleva al golpe de potencia. El cuello de la miosina gira alrededor, lo que lleva a una translocación de la cabeza por aproximadamente 10 nm para la miosina II. La distancia de translocación varía según el tipo de miosina, pero aún no está claro si la longitud del cuello es proporcional al desplazamiento de la cabeza. Finalmente, el ADP cae de la cabeza de miosina, aumentando la afinidad de la cabeza por la f-actina.
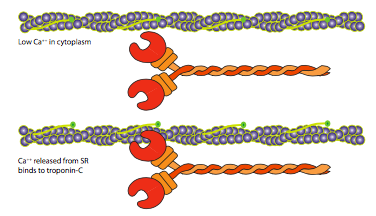
La estructura del sarcómero descrita en el primer párrafo era incompleta para situar claramente a los principales actores en sus roles. Existen otras proteínas en el sarcómero con importantes funciones estructurales y reguladoras. Uno de los componentes reguladores clave es la tropomiosina. Esta es una proteína fibrosa que se encuentra en el surco de un microfilamento de actina y bloquea el acceso al sitio de unión de la miosina. La tropomiosina se une al microfilamento junto con un complejo de troponina multisubunidad. Cuando Ca 2+ está disponible, puede unirse a la troponina-C, lo que lleva a un cambio conformacional que desplaza la posición de la tropomiosina para revelar el sitio de unión a la miosina. Este es el principal punto de control para la contracción muscular: recuerde que los niveles intracelulares de Ca 2+ se mantienen extremadamente bajos debido a que su función primaria está en la señalización intracelular. Una forma en que los niveles de Ca 2+ se mantienen tan bajos es bombearlo a un reservorio, como el retículo endoplásmico.
En las células musculares, existe una especialización de la ER llamada retículo sarcoplásmico (SR) que es rico en bombas de Ca 2+ y Ca 2+. Cuando se envía una señal desde una célula nerviosa controladora a la célula muscular, provoca una despolarización de la membrana celular muscular. Esto, en consecuencia, despolariza un conjunto de membranas llamadas túbulos transversales (túbulos T) que se encuentran directamente sobre partes del retículo sarcoplásmico. Hay proteínas en la superficie del túbulo t que interactúan directamente con un conjunto de proteínas del canal de Ca 2+, manteniendo el canal cerrado normalmente. Cuando se despolariza el túbulo t, las proteínas cambian de forma, lo que cambia la interacción con los canales de Ca 2+ en la SR, y les permite abrirse. Ca 2+ sale corriendo de la SR donde está disponible para troponina-c. La troponina-C unida a Ca 2+ desplaza la tropomiosina lejos del filamento de actina, y la cabeza de la miosina puede unirse a él. ATP puede unir la cabeza de la miosina para iniciar el ciclo de golpe de potencia, y listo, hemos controlado la contracción de las células musculares.
La SR es una especialización de parte del retículo endoplásmico, y contiene una alta concentración de iones Ca 2+ debido a que la membrana SR está incrustada con bombas de Ca 2+ (ATPasas) para mantener baja la concentración citoplásmica y secuestrar los iones Ca 2+ dentro de la SR. Esto está regulado por la fosforilación y [Ca 2+] a través de una proteína reguladora como el fosfolambano (en el músculo cardíaco). Fosfolamban es una proteína de membrana integral de la SR que normalmente se asocia e inhibe la bomba de Ca 2+. Sin embargo, cuando se fosforila, o a medida que aumentan los niveles citoplásmicos de Ca 2+, el fosfolambano se libera de la bomba de Ca 2+ y le permite funcionar.
Además de las “partes móviles”, también hay proteínas más estáticas, estructurales, en el sarcómero (Figura\(\PageIndex{11}\)). La titina es una proteína gigantesca (la más grande conocida, con casi 3 MDa), y puede pensarse como una especie de cordón elástico que se une a la fibra de miosina. Su propósito esencial es evitar que las fuerzas generadas por la miosina separen la fibra. La titina se envuelve alrededor de la fibra de miosina y se adhiere en múltiples puntos, con el más medial justo cerca del borde de la zona H. En la línea Z, la titina se une a un complejo de teletonina, que se une a las proteínas del disco Z (α-actinina antiparalela). La titina también interactúa con la obscurin en la región de la banda I, donde puede unir las miofibrillas a la SR, y en la región de la banda M puede interactuar con la proteína de unión a Ca 2+ calmodulina-1 y TRIM63, que se cree que actúa como un enlace entre la titina y el citoesqueleto de los microtúbulos. Existen múltiples isoformas de la titina a partir del empalme alternativo, con la mayor parte de la variación que viene en la región de la banda I.
Las alteraciones en la formación adecuada de la estructura de soporte a base de titina pueden ser una causa de miocardiopatía dilatada, y a partir de eso, insuficiencia cardíaca congestiva. Alrededor del 20-30% de los casos de miocardiopatía dilatada son familiares y se han mapeado mutaciones en la región N-terminal de la titina, donde la proteína interactúa con la teletonina. También se están investigando defectos en la titina con respecto a la enfermedad pulmonar obstructiva crónica y algunos tipos de distrofia muscular.
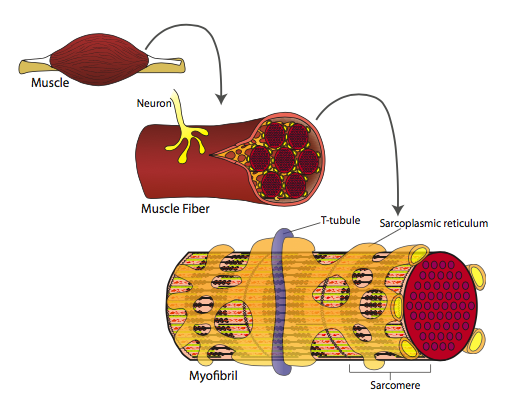
Por supuesto en un músculo real (Figura\(\PageIndex{14}\)), lo que sucede es que los nervios crecen en el músculo y hacen conexiones sinápticas con ellos. En estas conexiones sinápticas, la célula nerviosa libera neurotransmisores como la acetilcolina (ACh), que se unen a receptores (AChR) en la célula muscular. Esto luego abre canales iónicos en la membrana celular muscular, desencadenando un cambio de voltaje a través de esa membrana, lo que también afecta a la membrana cercana de los túbulos transversales posteriormente abriendo canales de Ca 2+ en la SR. La contracción de los sarcómeros puede entonces proceder como ya se describió anteriormente.