3.20: Apoptosis
- Page ID
- 56656
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
La apoptosis es un proceso de muerte celular programada que ocurre en organismos multicelulares. Hay dos formas en que las células mueren: (1) Son asesinadas por agentes lesivos o (2) son inducidas a suicidarse.
Muerte por lesión
Las células que están dañadas por lesiones, como por daños mecánicos o exposición a productos químicos tóxicos, experimentan una serie característica de cambios. Ellos (y sus orgánulos como las mitocondrias) se hinchan (porque se altera la capacidad de la membrana plasmática para controlar el paso de iones y agua). El contenido celular se escapa, lo que lleva a la inflamación de los tejidos circundantes.
Muerte por Suicidio
Células que son inducidas a suicidarse:
- encoger
- desarrollar burbujas como burbujas en su superficie
- tienen la cromatina (ADN y proteína) en su núcleo degradada
- tienen sus mitocondrias descomponen con la liberación de citocromo c
- romper en pequeños fragmentos envueltos en membrana
- liberar (al menos en células de mamífero) ATP y UTP
- Estos nucleótidos se unen a receptores en células fagocíticas errantes como macrófagos y células dendríticas y los atraen a las células moribundas (una señal de "find-me"”)
- El fosfolípido fosfatidilserina, que normalmente está oculto en la capa interna de la membrana plasmática, se expone en la superficie
- Esta señal de "comerme" está unida por otros receptores en los fagocitos que luego engullen los fragmentos celulares
- Las células fagocíticas secretan citocinas que inhiben la inflamación (por ejemplo, IL-10 y TGF-β)
El patrón de eventos en la muerte por suicidio es tan ordenado que el proceso suele llamarse muerte celular programada o PCD. La maquinaria celular de la muerte celular programada resulta ser tan intrínseca a la célula como, digamos, la mitosis. La muerte celular programada también se llama apoptosis. (Todavía no hay consenso sobre cómo pronunciarlo; algunos dicen APE oh TOE sis; algunos dicen uh POP tuh sis.)
¿Por qué debería suicidarse una célula?
Hay dos razones distintas.
1. La muerte celular programada es tan necesaria para un desarrollo adecuado como lo es la mitosis.
Ejemplos:
- La reabsorción de la cola de renacuajo en el momento de su metamorfosis en una rana ocurre por apoptosis.
- La formación de los dedos de las manos y pies del feto requiere la extracción, por apoptosis, del tejido entre ellos.
- El desprendimiento del revestimiento interno del útero (el endometrio) al inicio de la menstruación ocurre por apoptosis.
- La formación de las conexiones adecuadas (sinapsis) entre las neuronas en el cerebro requiere que las células excedentes sean eliminadas por apoptosis.
- La eliminación de las células T que de otro modo podrían montar un ataque autoinmune en el cuerpo ocurre por apoptosis.
- Durante la etapa pupal de los insectos que sufren metamorfosis completa, la mayoría de las células de la larva mueren por apoptosis proporcionando así los nutrientes para el desarrollo de las estructuras del adulto.
2. La muerte celular programada es necesaria para destruir células que representan una amenaza para la integridad del organismo.
Ejemplos:
- Células infectadas con virus
- Uno de los métodos por los cuales los linfocitos T citotóxicos (CTL) matan a las células infectadas por virus es induciendo apoptosis y algunos virus montan contramedidas para frustrarla.
- Células del sistema inmune
- A medida que las respuestas inmunes mediadas por células disminuyen, las células efectoras deben eliminarse para evitar que ataquen a los constituyentes del cuerpo. Los CTL inducen apoptosis entre sí e incluso en sí mismos. Los defectos en la maquinaria apoptótica se asocian con enfermedades autoinmunes como el lupus eritematoso sistémico y la artritis reumatoide.
- Células con daño en el ADN
- El daño a su genoma puede causar una célula
- para interrumpir el desarrollo embrionario adecuado que conduce a defectos congénitos
- para volverse canceroso.
- Células cancerosas
- La radiación y los químicos utilizados en la terapia contra el cáncer inducen apoptosis en algunos tipos de células cancerosas.
¿Qué hace que una célula decida suicidarse?
El equilibrio entre la retirada de señales positivas; es decir, señales necesarias para la supervivencia continua, y la recepción de señales negativas.
Retirada de señales positivas
La supervivencia continuada de la mayoría de las células requiere que reciban estimulación continua de otras células y, para muchas, una adhesión continuada a la superficie sobre la que están creciendo. Algunos ejemplos de señales positivas: factores de crecimiento para neuronas e Interleucina-2 (IL-2), un factor esencial para la mitosis de linfocitos
Recepción de señales negativas
- aumento de los niveles de oxidantes dentro de la célula
- daño al ADN por estos oxidantes u otros agentes como la luz ultravioleta, los rayos X y los fármacos quimioterapéuticos
- acumulación de proteínas que no pudieron plegarse adecuadamente en su estructura terciaria apropiada
- moléculas que se unen a receptores específicos en la superficie celular y señalan a la célula para iniciar el programa de apoptosis. Estos activadores de la muerte incluyen:
- Factor de necrosis tumoral alfa (TNF-α) que se une al receptor de TNF
- Linfotoxina (también conocida como TNF-β) que también se une al receptor de TNF
- Ligando Fas (FasL), una molécula que se une a un receptor de superficie celular llamado Fas (también llamado CD95)
Los Mecanismos de Apoptosis
Existen 3 mecanismos diferentes por los cuales una célula se suicida por apoptosis.
- Generado por señales que surgen dentro de la celda
- Desencadenado por activadores de muerte que se unen a receptores en la superficie celular:
- TNF-α
- Linfotoxina
- Ligando Fas (FasL)
- Desencadenado por especies peligrosas de oxígeno reactivo
Apoptosis desencadenada por señales internas
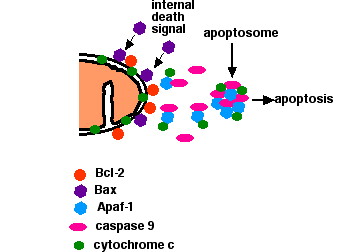
- En una célula sana, las membranas externas de sus mitocondrias muestran la proteína Bcl-2 en su superficie. Bcl-2 inhibe la apoptosis.
- Daño interno a la celda
- provoca que una proteína relacionada, Bax, migre a la superficie de la mitocondria donde inhibe el efecto protector de Bcl-2 y se inserta en la membrana mitocondrial externa perforando agujeros en ella y causando
- citocromo c para filtrarse.
- El citocromo c liberado se une a la proteína Apaf-1 (“factor activador de proteasa apoptótico-1").
- Usando la energía proporcionada por el ATP, estos complejos se agregan para formar apoptosomas. Los apoptosomas se unen y activan la caspasa-9. La caspasa-9 forma parte de una familia de más de una docena de caspasas. Todas son proteasas. Reciben su nombre porque escinden proteínas —principalmente entre sí— en residuos de ácido aspártico (Asp).
- La caspasa-9 escinde y, al hacerlo, activa otras caspasas (caspasa-3 y -7).
- La activación de estas caspasas “verdugo” crea una cascada expansiva de actividad proteolítica (más bien similar a la de la coagulación de la sangre y la activación del complemento) que conduce a
- digestión de proteínas estructurales en el citoplasma,
- degradación del ADN cromosómico
- fagocitosis de la célula
Apoptosis desencadenada por señales externas
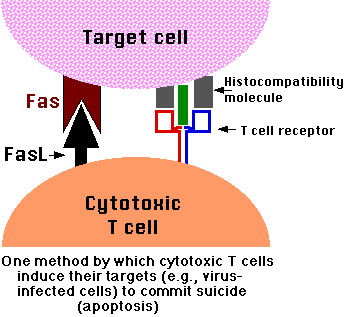
- Fas y el receptor de TNF son proteínas integrales de membrana con sus dominios receptores expuestos en la superficie de la célula
- La unión del activador complementario de la muerte (FasL y TNF respectivamente) transmite una señal al citoplasma que conduce a la activación de la caspasa 8
- La caspasa 8 (como la caspasa 9) inicia una cascada de activación de caspasa que conduce a la fagocitosis de la célula.
- Ejemplo: Cuando las células T citotóxicas reconocen (se unen a) su diana,
- Producen más FasL en su superficie.
- Esto se une con el Fas en la superficie de la célula diana conduciendo a su muerte por apoptosis.
Los primeros pasos en la apoptosis son reversibles, al menos en C. elegans. En algunos casos, la destrucción final de la célula está garantizada sólo con su engullido por un fagocito.
Apoptosis- I nducing F actor (AIF)
Las neuronas, y quizás otras células, tienen otra forma de autodestruirse que —a diferencia de los dos caminos descritos anteriormente— no utiliza caspasas. El factor inductor de apoptosis (AIF) es una proteína que normalmente se localiza en el espacio intermembrana de las mitocondrias. Cuando la célula recibe una señal que le dice que es hora de morir, el AIF se libera de las mitocondrias (como la liberación del citocromo c en la primera vía). Migra al núcleo y se une al ADN, lo que desencadena la destrucción del ADN y la muerte celular.
Apoptosis y Cáncer
Algunos virus asociados a los cánceres utilizan trucos para prevenir la apoptosis de las células que han transformado.
- Varios virus del papiloma humano (VPH) han sido implicados en causar cáncer de cuello uterino. Uno de ellos produce una proteína (E6) que se une e inactiva al promotor de apoptosis p53.
- Virus de Epstein-Barr (VEB), causa de mononucleosis y asociado a algunos linfomas
- produce una proteína similar a Bcl-2
- produce otra proteína que hace que la célula aumente su propia producción de Bcl-2. Ambas acciones hacen que la célula sea más resistente a la apoptosis (permitiendo así que una célula cancerosa continúe proliferando).
Incluso las células cancerosas producidas sin la participación de virus pueden tener trucos para evitar la apoptosis.
- Algunas leucemias y linfomas de células B expresan altos niveles de Bcl-2, bloqueando así las señales apoptóticas que pueden recibir. Los altos niveles son el resultado de una translocación del gen BCL-2 a una región potenciadora para la producción de anticuerpos.
- Las células de melanoma (el tipo más peligroso de cáncer de piel) evitan la apoptosis al inhibir la expresión del gen que codifica Apaf-1.
- Algunas células cancerosas, especialmente las células de cáncer de pulmón y colon, secretan niveles elevados de una molécula “señuelo” soluble que se une a FasL, taponándola para que no pueda unirse a Fas. Así, las células T citotóxicas (CTL) no pueden matar a las células cancerosas por el mecanismo mostrado anteriormente.
- Otras células cancerosas expresan altos niveles de FasL, y pueden matar cualquier célula T citotóxica (CTL) que intente matarlas porque los CTL también expresan Fas (pero están protegidos de su propio FasL).
Apoptosis en el Sistema Inmune
La respuesta inmune a un invasor extraño implica la proliferación de linfocitos, linfocitos T y/o B. Cuando su trabajo esté hecho, deben ser removidos dejando sólo una pequeña población de celdas de memoria. Esto se hace por apoptosis. Muy raramente los humanos se encuentran con defectos genéticos en la apoptosis. La más común es una mutación en el gen para Fas, pero ocasionalmente se observan mutaciones en el gen para FasL o incluso una de las caspasas. En todos los casos, el problema genético produce síndrome linfoproliferativo autoinmune o ALPS.
Características
- una acumulación de linfocitos en los ganglios linfáticos y el bazo agrandándolos en gran medida.
- la aparición de clones que son autorreactivos; es decir, atacar componentes “propios” que producen trastornos autoinmunes como
- anemia hemolítica
- trombocitopenia
- la aparición de linfoma — un clon canceroso de linfocitos.
En la mayoría de los pacientes con ALPS, la mutación está presente en la línea germinal; es decir, cada célula de su cuerpo la porta. En algunos casos, sin embargo, la mutación es somática; es decir, se ha producido en una célula precursora en la médula ósea. Estos pacientes posteriores son mosaicos genéticos —con algunos linfocitos que sufren apoptosis normalmente y otros que no. Estos últimos tienden a superar a los primeros y crecer hasta convertirse en la población principal en los ganglios linfáticos y la sangre.
Apoptosis y trasplantes de órganos
Desde hace muchos años se sabe que ciertas partes del cuerpo como la cámara anterior del ojo y los testículos son “sitios inmunológicamente privilegiados”. Los antígenos dentro de estos sitios no logran provocar una respuesta inmune. Resulta que las células en estos sitios difieren de las otras células del cuerpo en que expresan altos niveles de FasL en todo momento. Así, las células T reactivas a antígeno, que expresan Fas, serían destruidas cuando ingresen a estos sitios. (Este es el reverso del mecanismo descrito anteriormente.)
Este hallazgo plantea la posibilidad de una nueva forma de prevenir el rechazo del injerto. Si al menos algunas de las células de un riñón, hígado, corazón, etc. trasplantados pudieran hacerse expresar altos niveles de FasL, eso podría proteger al injerto del ataque de las células T del sistema inmune mediado por células del huésped. De ser así, entonces se reduciría o eliminaría la necesidad actual de tratamiento con fármacos inmunosupresores para el resto de la vida del receptor del trasplante. Hasta el momento, los resultados en experimentos con animales han sido mixtos. Los aloinjertos diseñados para expresar FasL han mostrado una mayor supervivencia para los riñones, pero no para corazones o islotes de Langerhans.
Apoptosis en Plantas
Las plantas, también, pueden activar un sistema de muerte celular programada; por ejemplo, en un intento de detener la propagación de la infección por virus. El mecanismo difiere del de los animales aunque también involucra una proteasa que —como las caspasas— escinde otras proteínas en los residuos Asp (y Asn). La activación de esta enzima destruye la vacuola central, a la que le sigue la desintegración del resto de la célula.


