11.5: Animales transgénicos
- Page ID
- 57190
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Un animal transgénico es aquel que porta un gen extraño que ha sido insertado deliberadamente en su genoma. El gen foráneo se construye usando metodología de ADN recombinante. Además del gen en sí, el ADN suele incluir otras secuencias para permitirle incorporarse al ADN del huésped y ser expresado correctamente por las células del huésped. Se han producido ovejas y cabras transgénicas que expresan proteínas extrañas en su leche. Los pollos transgénicos ahora son capaces de sintetizar proteínas humanas en el “blanco” de sus huevos. Estos animales eventualmente deberían demostrar ser valiosas fuentes de proteínas para la terapia humana.
En julio de 2000, investigadores del equipo que produjo Dolly reportaron el éxito en la producción de corderos transgénicos en los que el transgén había sido insertado en un sitio específico del genoma y funcionaba bien.
Los ratones transgénicos han proporcionado las herramientas para explorar muchas cuestiones biológicas.
Los ratones normales no pueden infectarse con el virus de la polio. Carecen de la molécula de superficie celular que, en los humanos, sirve como receptor para el virus. Por lo tanto, los ratones normales no pueden servir como un modelo económico y fácil de manipular para estudiar la enfermedad. Sin embargo, ratones transgénicos que expresan el gen humano para el receptor del virus de la polio
- puede ser infectado por el virus de la polio e incluso
- desarrollar parálisis y otros cambios patológicos característicos de la enfermedad en humanos.
Dos métodos para producir ratones transgénicos son ampliamente utilizados:
- células madre embrionarias transformadoras (células ES) que crecen en cultivo de tejidos con el ADN deseado
- inyectar el gen deseado en el pronúcleo de un óvulo de ratón fertilizado

Fig.11.4.1 Métodos para producir ratones transgénicos
El Método de Células Madre Embrionarias - Método 1
Las células madre embrionarias (células ES) se cosechan de la masa celular interna (ICM) de blastocistos de ratón. Se pueden cultivar en cultivo y conservar todo su potencial para producir todas las células del animal maduro, incluyendo sus gametos.
1. Haz tu ADN
Usando métodos de ADN recombinante, construir moléculas de ADN que contengan- el gen que deseas (por ejemplo, el gen de la insulina)
- ADN vector para permitir que las moléculas se inserten en moléculas de ADN hospedadoras
- secuencias promotoras y potenciadoras para permitir que el gen sea expresado por las células hospedadoras
2. Transformar células ES en cultivo
Exponer las células cultivadas al ADN para que algunas lo incorporen.3. Seleccionar para células transformadas satisfactoriamente
4. Inyectar estas células en la masa celular interna (ICM) de blastocistos de ratón.
5. Transferencia de embriones
- Preparar un ratón pseudopreñado (apareando un ratón hembra con un macho vasectomizado). El estímulo del apareamiento provoca los cambios hormonales necesarios para hacer que su útero sea receptivo.
- Transferir los embriones a su útero.
- Espero que se implanten con éxito y se conviertan en crías sanas (no más de un tercio de voluntad).
6. Prueba a su descendencia
- Retire un pequeño trozo de tejido de la cola y examine su ADN en busca del gen deseado. No más del 10— 20% lo tendrá, y serán heterocigotos para el gen.
7. Establecer una cepa transgénica
- Emparejar dos ratones heterocigotos y cribar su descendencia para el 1 de cada 4 que será homocigoto para el transgén.
- El apareamiento de estos hallará la cepa transgénica.
El Método Pronúcleo - Método 2
1. Prepara tu ADN como en el Método 1
2. Transformar huevos fertilizados
- Coseche óvulos recién fertilizados antes de que la cabeza del esperma se haya convertido en pronúcleo.
- Inyecte el pronúcleo masculino con su ADN.
- Cuando los pronúcleos se hayan fusionado para formar el núcleo del cigoto diploide, permita que el cigoto se divida por mitosis para formar un embrión de 2 células.
3. Implantar los embriones en una madre adoptiva pseudogestante y proceder como en el Método 1.

Esta imagen (cortesía de R. L. Brinster y R. E. Hammer) muestra un ratón transgénico (derecha) con un compañero de camada normal (izquierda). El ratón gigante se desarrolló a partir de un óvulo fertilizado transformado con una molécula de ADN recombinante que contenía:
- el gen de la hormona del crecimiento humano
- un promotor fuerte del gen del ratón
Los niveles de hormona del crecimiento en el suero de algunos de los ratones transgénicos fueron varios cientos de veces mayores que en los ratones control.
Inserción génica aleatoria frente a dirigida
Los primeros vectores utilizados para la inserción génica podrían, e hicieron, colocar el gen (de una a 200 copias del mismo) en cualquier parte del genoma. Sin embargo, si conoces parte de la secuencia de ADN que flanquea un gen en particular, es posible diseñar vectores que reemplacen a ese gen. El gen de reemplazo puede ser uno que- restaura la función en un animal mutante o
- noquea la función de un locus particular.
- el gen deseado
- neo r, un gen que codifica una enzima que inactiva el antibiótico neomicina y sus parientes, como el fármaco G418, que es letal para las células de mamíferos
- tk, un gen que codifica la timidina quinasa, una enzima que fosforila el análogo de nucleósido ganciclovir. La ADN polimerasa no discrimina contra el nucleótido resultante e inserta este nucleótido no funcional en el ADN recién replicante. Entonces el ganciclovir mata las células que contienen el gen tk
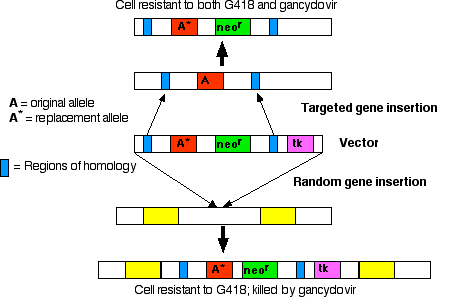
Paso 1
Tratar el cultivo de células ES con preparación de ADN vector.Resultados:
- La mayoría de las células no logran captar el vector; estas células se matarán si se exponen a G418.
- En algunas células: el vector se inserta aleatoriamente en el genoma. En la inserción aleatoria, todo el vector, incluido el gen tk, se inserta en el ADN del huésped. Estas células son resistentes a G418 pero muertas por el ganciclovir.
- En aún menos células: se produce recombinación homóloga. Los tramos de secuencia de ADN en el vector encuentran las secuencias homólogas en el genoma del huésped, y la región entre estas secuencias homólogas reemplaza a la región equivalente en el ADN del huésped.
Paso 2
Cultivar la mezcla de células en medio que contenga tanto G418 como ganciclovir.- Las células (la mayoría) que no lograron captar el vector son destruidas por G418.
- Las células en las que se insertó aleatoriamente el vector son destruidas por el ganciclovir (porque contienen el gen tk).
- Esto deja una población de células transformadas por recombinación homóloga (enriquecida varios miles de veces).
Paso 3
Inyéctelos en la masa celular interna de los blastocistos de ratón.
Ratones Knockout: ¿Qué nos enseñan?
Si el gen de reemplazo (A* en el diagrama) no es funcional (un alelo “nulo”), el apareamiento de los ratones transgénicos heterocigóticos producirá una cepa de "ratones knockout" homocigotos para el gen no funcional (ambas copias del gen en ese locus han sido “noqueadas”). Los ratones knockout son herramientas valiosas para descubrir la (s) función (es) de genes para los cuales las cepas mutantes no estaban disponibles previamente. Dos generalizaciones han surgido al examinar ratones knockout:
- Los ratones knockout a menudo sorprendentemente no se ven afectados por su deficiencia. Muchos genes resultan no ser indispensables. El genoma del ratón parece tener suficiente redundancia para compensar un solo par faltante de alelos.
- La mayoría de genes son pleiotrópicos. Se expresan en diferentes tejidos de diferentes maneras y en diferentes momentos de desarrollo.
Ratones knockout específicos de tejido
Si bien los genes “" domésticos "” se expresan en todos los tipos de células en todas las etapas del desarrollo, otros genes normalmente se expresan solo en ciertos tipos de células cuando se encienden por las señales apropiadas (por ejemplo, la llegada de una hormona).”
Para estudiar tales genes, cabría esperar que los métodos descritos anteriormente funcionaran. Sin embargo, resulta que los genes que solo se expresan en ciertos tejidos adultos pueden ser vitales durante el desarrollo embrionario. En tales casos, los animales no sobreviven el tiempo suficiente para que se estudie su gen knockout. Afortunadamente, ahora existen técnicas con las que se pueden hacer ratones transgénicos donde un gen particular es noqueado en un solo tipo de célula.
El sistema Cre/ loxP

Uno de los bacteriófagos que infecta E. coli, llamado P1, produce una enzima —denominada Cre— que corta su ADN en longitudes adecuadas para empaquetarse en partículas víricas frescas. Cre corta el ADN viral dondequiera que encuentre un par de secuencias designadas loxP. Todo el ADN entre los dos sitios loxP se elimina, y el ADN restante se vuelve a ligar entre sí (por lo que la enzima es una recombinasa). Usando el “Método 1" anterior, los ratones pueden hacerse transgénicos para
- el gen que codifica Cre unido a un promotor que se activará solo cuando esté unido por los mismos factores de transcripción que encienden los otros genes requeridos para la función o funciones únicas de ese tipo de célula;
- un gen “diana”, aquel cuya función se va a estudiar, flanqueado por secuencias loxP.
- esas celdas que
- recibir señales (por ejemplo, la llegada de una hormona o citocina)
- para activar la producción de los factores de transcripción necesarios
- activar los promotores de los genes cuyos productos son necesarios para ese tipo particular de célula
- Todas las demás células carecerán de los factores de transcripción necesarios para unirse al promotor Cre (y/o cualquier potenciador) por lo que el gen diana permanece intacto.
El resultado: un ratón con un gen particular noqueado en sólo ciertas células.
Ratones Knock-in
El sistema Cre/ loxP también se puede utilizar para
- eliminar las secuencias de ADN que bloquean la transcripción génica. El gen “diana” puede entonces encenderse en ciertas células o en ciertos momentos según lo desee el experimentador.
- reemplazar uno de los genes propios del ratón por un nuevo gen que el investigador desee estudiar.
Dichos ratones transgénicos se denominan ratones “knock-in”.
Ovinos y cabras transgénicos
Hasta hace poco, los transgenes introducidos en ovejas se insertaron aleatoriamente en el genoma y a menudo funcionaban mal. Sin embargo, en julio de 2000, se reportó el éxito en la inserción de un transgén en un locus génico específico. El gen fue el gen humano para alfa1-antitripsina, y dos de los animales expresaron grandes cantidades de la proteína humana en su leche.
Así se hizo.
Los fibroblastos de oveja (células de tejido conectivo) que crecen en cultivo de tejidos se trataron con un vector que contenía estos segmentos de ADN:
- 2 regiones homólogas al gen COL1A1 ovino. Este gen codifica colágeno Tipo 1. (Su ausencia en humanos provoca la enfermedad heredada osteogénesis imperfecta.)
Este locus fue elegido porque los fibroblastos secretan grandes cantidades de colágeno y así uno esperaría que el gen fuera fácilmente accesible en la cromatina.
- Un gen de resistencia a la neomicina para ayudar en el aislamiento de aquellas células que incorporaron exitosamente el vector.
- El gen humano que codifica alfa1-antitripsina.
Algunas personas heredan dos genes que no funcionan o que no funcionan mal para esta proteína. Su bajo nivel o ausencia resultante produce la enfermedad Deficiencia de Alfa1-Antitripsina (A1AD o Alfa1). Los síntomas principales son el daño a los pulmones (y a veces al hígado).
- Sitios promotores del gen de la beta-lactoglobulina. Estos promueven la expresión génica impulsada por hormonas en células productoras de leche.
- Sitios de unión para ribosomas para la traducción eficiente de los ARNm de beta-lactoglobulina.
- Fusionado con huevos de oveja enucleados e implantado en el útero de una oveja (oveja hembra)
- Varios embriones sobrevivieron hasta su nacimiento, y dos corderos jóvenes vivieron más de un año.
- Al tratarse con hormonas, estos dos corderos secretaban leche que contenía grandes cantidades de alfa1-antitripsina (650 µg/ml; 50 veces mayor que los resultados anteriores mediante inserción aleatoria del transgén).
El 18 de junio de 2003, la empresa que realizaba esta obra la abandonó por el gran gasto de construir una instalación para purificar la proteína de la leche de oveja. La purificación es importante porque incluso cuando el 99.9% puro, los pacientes humanos pueden desarrollar anticuerpos contra las pequeñas cantidades de proteínas de oveja que quedan.
Sin embargo, otra compañía, GTC Biotherapeutics, ha perseverado y en junio de 2006 obtuvo la aprobación preliminar para comercializar una proteína humana, la antitrombina, en Europa. Su proteína —la primera elaborada en un animal transgénico en recibir la aprobación reglamentaria para la terapia humana— fue secretada en la leche de cabras transgénicas.Pollos transgénicos
Los pollos crecen más rápido que las ovejas y las cabras y grandes cantidades se pueden cultivar en espacios cerrados. También sintetizan varios gramos de proteína en el “blanco” de sus huevos.Dos métodos han logrado producir pollos que portan y expresan genes extraños.
- Infección de embriones con un vector viral portador
- el gen humano para una proteína terapéutica
- secuencias promotoras que responderán a las señales para producir proteínas (por ejemplo, lisozima) en clara de huevo
- Transformar el esperma de gallo con un gen humano y los promotores apropiados y verificar si hay descendencia transgénica.
Los resultados preliminares de ambos métodos indican que puede ser posible que los pollos produzcan tanto como 0.1 g de proteína humana en cada huevo que ponen.
Esto no solo debería costar menos que producir proteínas terapéuticas en recipientes de cultivo, sino que los pollos probablemente agregarán los azúcares correctos a las proteínas glicosiladas, algo que E. coli no puede hacer.
Cerdos transgénicos
Los cerdos transgénicos también se han producido mediante la fertilización de óvulos normales con espermatozoides que han incorporado ADN extraño. Este procedimiento, llamado transferencia génica mediada por espermatozoides (SMGT) puede algún día ser capaz de producir cerdos transgénicos que pueden servir como fuente de órganos trasplantados para los humanos.
Primates transgénicos
En la edición del 28 de mayo de 2009 de Nature, científicos japoneses reportaron el éxito en la creación de titíes transgénicos. Los titíes son primates y por lo tanto nuestros parientes más cercanos (hasta ahora) para ser modificados genéticamente. En algunos casos, el transgén (para la proteína verde fluorescente) se incorporó a la línea germinal y se transmitió a la descendencia del animal. La esperanza es que estos animales transgénicos proporcionen el mejor modelo hasta ahora para estudiar enfermedades humanas y posibles terapias.


