15.4D: Receptores de antígeno
- Page ID
- 56817
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Tanto las células B como las células T tienen receptores de superficie para el antígeno. Cada célula tiene miles de receptores de una sola especificidad; es decir, con un sitio de unión para un epítopo particular. Los receptores de células T (TCR) permiten que la célula se una y, si hay señales adicionales, activarse y responder a un epítopo presentado por otra célula llamada célula presentadora de antígeno o APC. Los receptores de células B (BCR) permiten que la célula se una a y, si hay señales adicionales, activarse por y responder a un epítopo en moléculas de un antígeno soluble. La respuesta termina con descendientes de la célula B que segregan un gran número de una forma soluble de sus receptores. Se trata de anticuerpos.
Anticuerpos
Los anticuerpos son glicoproteínas. Están construidas de subunidades que contienen dos cadenas ligeras idénticas (cadenas L), cada una conteniendo aproximadamente 200 aminoácidos y dos cadenas pesadas idénticas (cadenas H), que son al menos el doble de largas que las cadenas ligeras. Los primeros 100 o más aminoácidos en el extremo N-terminal de ambas cadenas H y L varían mucho de anticuerpo a anticuerpo. T Estas son las regiones variables (V). A menos que sean miembros del mismo clon (y a menudo ni siquiera entonces), no es probable que dos células B secreten anticuerpos con la misma región variable. La variabilidad de la secuencia de aminoácidos en las regiones V es especialmente pronunciada en 3 regiones hipervariables. La estructura terciaria de los anticuerpos une las 3 regiones hipervariables tanto de las cadenas L como de la H. Juntos construyen el sitio de unión al antígeno contra el cual encaja el epítopo. Por esta razón, las regiones hipervariables también se denominan regiones determinantes de complementariedad (CDRs). Solo se encuentran algunas secuencias de aminoácidos diferentes en los terminales C de las cadenas H y L. Estas son las regiones constantes (C).
Los humanos producen dos tipos diferentes de regiones C para sus cadenas L produciendo cadenas L kappa (κ) y cadenas L lambda (λ). También hacen cinco tipos diferentes de regiones C para sus cadenas H produciendo:
- cadenas mu (µ) (la cadena H de los anticuerpos IgM)
- cadenas gamma (γ) (IgG)
- cadenas alfa (α) (IgA)
- cadenas delta (δ) (IgD)
- cadenas épsilon (ε) (IgE)
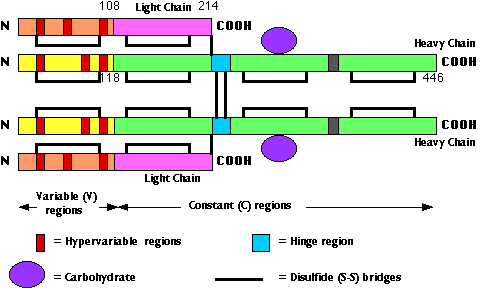
Las imágenes de arriba () representan la estructura plegada (terciaria) de una cadena L completa (lado derecho con líneas de conexión delgadas) y la región V más el primer tercio de la región C de una cadena pesada (lado izquierdo; líneas más oscuras). Cada círculo representa la ubicación en el espacio 3D de un carbono alfa. Los círculos rellenos en la parte superior son aminoácidos en las regiones determinantes hipervariables o complementarias (CDRs); forman el sitio que se une al antígeno.
Las moléculas de anticuerpo tienen dos funciones a realizar:
- reconocer y unirse a un epítopo en un antígeno
- desencadenar una respuesta útil al antígeno
La división del trabajo es:
- Las regiones V son responsables del reconocimiento de epítopos.
- Las regiones C son responsables de desencadenar una respuesta útil
Entonces, las regiones V detienen al culpable; las regiones C toman medidas.
Si las cadenas H de un anticuerpo (ver IgG arriba), se cortan en su región bisagra en el lado N-terminal de los enlaces disulfuro que mantienen juntas las cadenas H, se producen 3 fragmentos:
- 2 fragmentos Fab (“fragmento de unión a antígeno”) y
- 1 fragmento Fc (“fragmento cristalino” — porque la uniformidad de esta región permite que se formen cristales mientras que la gran diversidad de regiones V impide que se formen).
¿Por qué 5 tipos de cadenas pesadas? Proporcionar diferentes funciones efectoras.
| Clase | Cadena H | Cadena en L | Subunidades | mg/ml | Notas |
|---|---|---|---|---|---|
| IgG | gamma | kappa o lambda | H 2 L 2 | 6—13 | transferido a través de la placenta; cuatro subclases: IgG1-4 en humanos |
| IgM | mu | kappa o lambda | (H 2 L 2) 5 | 0.5—3 | primeros anticuerpos que aparecen después de la inmunización |
| IgA | alfa | kappa o lambda | (H 2 L 2) 2 | 0.6—3 | concentraciones mucho más altas en secreciones; dos subclases |
| IgD | delta | kappa o lambda | H 2 L 2 | <0.14 | función incierta |
| IgE | épsilon | kappa o lambda | H 2 L 2 | <0.0004 | se une a basófilos y mastocitos sensibilizándolos para ciertas reacciones alérgicas |
“mg/ml" da la concentración que normalmente se encuentra en el suero humano. Las subclases de IgG e IgA están codificadas por diferentes segmentos génicos de la región C.
Si una célula secretora de anticuerpos se vuelve cancerosa, crecerá hasta convertirse en un clon que secreta su única clase de molécula. La enfermedad se llama mieloma múltiple.


