15.7A: Reproducción Sexual
- Page ID
- 56705
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
La reproducción sexual es la formación de un nuevo individuo tras la unión de dos gametos. En humanos y en la mayoría de otras plantas eucariotas, así como en animales, los dos gametos difieren en estructura (“anisogamia”) y son aportados por diferentes padres. Los gametos necesitan motilidad para poder reunirse y unirse y alimentarse para nutrir al embrión en desarrollo. En los animales (y algunas plantas), estas dos necesidades bastante contrastantes son satisfechas por anisogametos: espermatozoides que son móviles (y pequeños) y huevos que contienen alimentos.
Órganos Sexuales del Hombre Humano
El sistema reproductivo del macho tiene dos funciones principales: (1) producción de esperma y (2) entrega de estos al tracto reproductivo de la hembra. La producción de esperma - espermatogénesis - se lleva a cabo en los testículos. Cada testículo está lleno de túbulos seminíferos (tendidos de extremo a extremo, se extenderían más de 20 metros) donde ocurre la espermatogénesis.

Espermatogénesis
Las paredes de los túbulos seminíferos consisten en espermatogonia diploide, células madre que son las precursoras de los espermatozoides. La espermatogonia se divide por mitosis para producir más espermatogonia o diferenciarse en espermatocitos. La meiosis de cada espermatocito produce 4 espermátidas haploides. Este proceso tarda más de tres semanas en completarse. Entonces las espermátidas se diferencian en espermatozoides, perdiendo la mayor parte de su citoplasma en el proceso.

Por simplicidad, la figura muestra el comportamiento de un solo par de cromosomas homólogos con un solo cruce. Con 22 pares de autosomas y un promedio de dos cruces entre cada par, la variedad de combinaciones de genes en espermatozoides es muy grande.
Esperma
Los espermatozoides son poco más que núcleos flagelados. Cada uno consiste en una cabeza, que tiene un acrosoma en su punta y contiene un conjunto haploide de cromosomas en un estado compacto e inactivo, una pieza media que contiene mitocondrias y un solo centíolo, y una cola que es un flagelo. Esta micrografía electrónica (cortesía del Dr. Don W. Fawcett y Susumu Ito) muestra el espermatozoide de un murciélago. Obsérvese la disposición ordenada de las mitocondrias. Suministran el ATP para impulsar el movimiento de látigo de la cola.
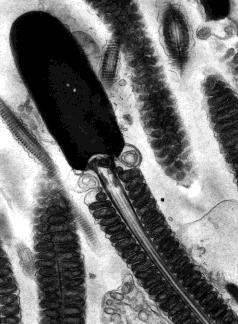
Un macho adulto fabrica más de 100 millones de espermatozoides cada día. Estos se mueven gradualmente hacia el epidídimo donde experimentan una mayor maduración. El ambiente ácido en el epidídimo mantiene inactivos los espermatozoides maduros. Además de hacer espermatozoides, el testículo es una glándula endocrina. Su principal hormona, la testosterona, es responsable del desarrollo de las características sexuales secundarias de los hombres como la barba, la voz profunda y la forma corporal masculina. La testosterona también es esencial para hacer espermatozoides. La testosterona se produce en las células intersticiales (también llamadas células de Leydig) que se encuentran entre los túbulos seminíferos.
LH
Las células intersticiales son, a su vez, las dianas de una hormona a menudo llamada hormona estimulante de células intersticiales (ICSH). Es un producto del lóbulo anterior de la glándula pituitaria. Sin embargo, la ICSH es idéntica a la hormona luteinizante (LH) que se encuentra en las hembras, y prefiero llamarla LH.
FSH
La hormona folículo estimulante (también llamada así por su papel en las mujeres) actúa directamente sobre la espermatogonia para estimular la producción de esperma (ayudada por la LH necesaria para la síntesis de testosterona).
Órganos Sexuales de la Mujer Humana
La responsabilidad del mamífero hembra para la reproducción exitosa es considerablemente mayor que la del macho.

Ella debe
- fabricar huevos
- estar equipado para recibir esperma del macho
- proporcionar un ambiente propicio para la fertilización y la implantación
- nutrir al bebé en desarrollo no solo antes del nacimiento sino también después
Oogénesis
La formación de óvulos se realiza en los ovarios. A diferencia de los machos, los pasos iniciales en la producción de óvulos ocurren antes del nacimiento. Las células madre diploides llamadas oogonia se dividen por mitosis para producir más oogonias y ovocitos primarios. Para cuando el feto tenga 20 semanas de edad, el proceso alcanza su pico y se han formado todos los ovocitos que alguna vez poseerá (~4 millones de ellos) (*). Para cuando ella nace, sólo quedan alrededor de 1 millón de estos (los otros eliminados por la apoptosis). Cada uno ha comenzado los primeros pasos de la primera división meiótica parándose en la etapa diploteno de la meiosis I.
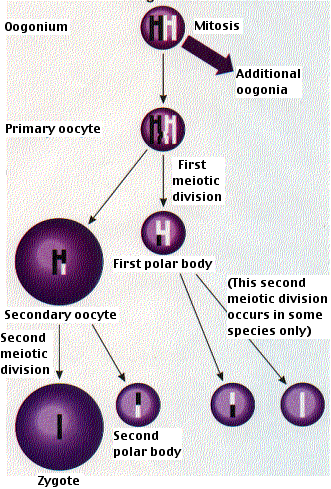
No se produce más desarrollo hasta años después cuando la niña llega a madurar sexualmente. Entonces los ovocitos primarios reinician su desarrollo, generalmente uno a la vez y una vez al mes. El ovocito primario crece mucho más y completa la meiosis I, formando un ovocito secundario grande y un pequeño cuerpo polar que recibe poco más de un conjunto de cromosomas. Qué cromosomas terminan en el óvulo y cuáles en el cuerpo polar es enteramente una cuestión de azar.
En los humanos (y la mayoría de los vertebrados), el primer cuerpo polar no pasa a la meiosis II, pero el ovocito secundario sí procede hasta la metafase de la meiosis II y luego se detiene.
Sólo si se produce la fecundación se completará alguna vez la meiosis II. La entrada de los espermatozoides reinicia el ciclo celular descomponiendo el MPF (factor promotor de fase M) y activando el complejo promotor de la anafasa (APC). La finalización de la meiosis II convierte el ovocito secundario en un óvulo o cigoto fertilizado (y también un segundo cuerpo polar). Al igual que en el diagrama para la espermatogénesis, el comportamiento de los cromosomas se simplifica enormemente.
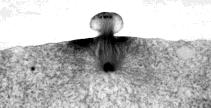
La fotomicrografía (cortesía de Turtox) muestra la formación de cuerpos polares durante la ovogénesis en el pez blanco. Incluso teniendo en cuenta el hecho de que los huevos de peces son más grandes que los huevos de mamíferos, se puede ver fácilmente cómo el cuerpo polar obtiene poco más de un conjunto de cromosomas.
Estos eventos tienen lugar dentro de un folículo, una envoltura llena de líquido de células que rodean el óvulo en desarrollo. El folículo de maduración también sirve como glándula endocrina. Sus células producen una mezcla de hormonas esteroides conocidas colectivamente como estrógeno. El estrógeno es responsable del desarrollo de las características sexuales secundarias de una mujer madura, e.g.
- un ensanchamiento de la pelvis
- desarrollo de los senos
- crecimiento del vello alrededor de los genitales y en las axilas
- desarrollo de tejido adiposo que conduce a los contornos corporales más redondeados de las mujeres adultas.
El estrógeno sigue secretándose a lo largo de los años reproductivos de las mujeres Durante este periodo, juega un papel esencial en el ciclo menstrual mensual.
Ovulación
La ovulación ocurre aproximadamente dos semanas después del inicio de la menstruación. En respuesta a una repentina oleada de LH, el folículo se rompe y descarga un ovocito secundario. Esto se barre hacia el extremo abierto de la trompa de Falopio y comienza a moverse lentamente hacia abajo por ella.
Cópula y Fertilización
Para que ocurra la fecundación, los espermatozoides deben depositarse en la vagina dentro de unos (5) días antes o el día de la ovulación. La transferencia de esperma se realiza por cópula. La excitación sexual dilata las arteriolas suministrando sangre al pene. La sangre se acumula en tres senos cilíndricos esponjosos que discurren longitudinalmente a través del pene. La presión resultante hace que el pene se agrandara y se erija y así sea capaz de penetrar en la vagina. El movimiento del pene hacia adelante y hacia atrás dentro de la vagina provoca que la tensión sexual aumente hasta el punto de la eyaculación. La contracción de las paredes de cada conducto deferente impulsa a los espermatozoides a lo largo. El líquido es agregado a los espermatozoides por las vesículas seminales, las glándulas de Cowper y la glándula prostática. Estos fluidos proporcionan
- una fuente de energía (fructosa)
- un ambiente alcalino para activar los espermatozoides
- tal vez de otras maneras proporcionar un ambiente químico óptimo para ellos
La mezcla de espermatozoides y fluidos accesorios se llama semen. Pasa a través de la uretra y es expulsado a la vagina. Los cambios fisiológicos ocurren tanto en la hembra como en el masculino en respuesta a la excitación sexual, aunque estos no son tan evidentes. En contraste con el macho, sin embargo, tales respuestas no son un requisito previo para que se produzca la cópula y la fertilización. Una vez depositados dentro de la vagina, los espermatozoides proceden en su viaje hacia y a través del útero y suben a las trompas de Falopio. Es aquí donde la fertilización puede ocurrir si está presente un “óvulo” (estrictamente hablando, sigue siendo un ovocito secundario hasta después de completar la meiosis II).
Aunque los espermatozoides pueden nadar varios milímetros cada segundo, su viaje hacia y a través de las trompas de Falopio puede ser asistido por la contracción muscular de las paredes del útero y las trompas. El viaje está plagado de una gran mortalidad. Una eyaculación humana promedio contiene más de cien millones de espermatozoides, pero solo unas pocas docenas completan el viaje, llegando a los 15 minutos de la eyaculación. Y de estos, sólo uno logrará fertilizar el óvulo.
Los espermatozoides nadan hacia el óvulo por quimiotaxis siguiendo un gradiente de progesterona secretada por las células que rodean el óvulo. La progesterona abre los canales de CatSper (“esperma catiónico”) en la membrana plasmática que rodea la porción anterior de la cola del esperma. Esto permite una afluencia de iones Ca 2+ lo que hace que el flagelo lata más rápida y vigorosamente. La fertilización comienza con la unión de una cabeza espermática a la capa de glicoproteína del óvulo (llamada zona pelúcida). La exocitosis del acrosoma en la punta de la cabeza espermática libera enzimas que digieren un camino a través de la zona y permiten que la cabeza espermática se una a la membrana plasmática del óvulo. La unión está mediada por la unión de dos proteínas de membrana:
- Izumo1 en la superficie del esperma
- Juno, su receptor en la superficie del huevo
La fusión de sus respectivas membranas permite que todo el contenido de los espermatozoides sea aspirado al citosol del óvulo. A pesar de que las mitocondrias del esperma ingresan al óvulo, casi siempre son destruidas por la autofagia y no aportan sus genes al embrión. Por lo que el ADN mitocondrial humano casi siempre se hereda solo de las madres. En momentos, las enzimas liberadas del citosol del óvulo actúan sobre la zona haciéndola impermeable a otros espermatozoides que llegan. Pronto el núcleo del espermatozoide exitoso se agranda en el pronúcleo masculino. Al mismo tiempo, el óvulo (ovocito secundario) completa la meiosis II formando un segundo cuerpo polar y el pronúcleo femenino.
Los pronúcleos macho y hembra se mueven uno hacia el otro mientras duplican su ADN en fase S. Sus sobres nucleares se desintegran. Se forma un huso (siguiendo la replicación del centríolo del esperma), y se ensambla un conjunto completo de díadas en él. El óvulo o cigoto fertilizado ya está listo para su primera mitosis. Cuando se hace esto, se forman 2 células cada una con un conjunto diploide de cromosomas.
En erizos de mar, el bloqueo a la entrada adicional de esperma y la fusión de los pronúcleos son desencadenados por el óxido nítrico generado en el óvulo por el acrosoma espermático.
Embarazo
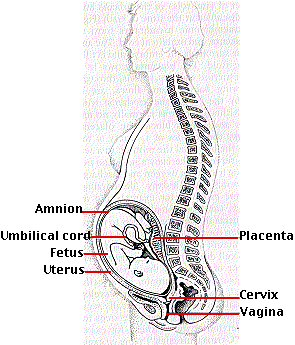
El desarrollo comienza mientras el óvulo fertilizado aún se encuentra dentro de la trompa de Falopio. Las repetidas divisiones mitóticas producen una bola sólida de células llamada mórula. Además, la mitosis y cierta migración de las células convierten esta en una bola hueca de células llamada blastocisto. Aproximadamente una semana después de la fecundación, el blastocisto se incrusta en la pared engrosada del útero, un proceso llamado implantación, y se establece el embarazo.
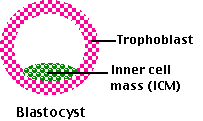
Fig.15.7.1.7 Blastocisto
El blastocisto produce dos colecciones principales de células:
- Tres o cuatro blastocistos se desarrollan en la masa celular interna, la cual formará 3 membranas extraembrionarias: amnios, saco vitelino y (un vestigial) alantois y en aproximadamente 2 meses, se convierten en el feto y, en última instancia, en el bebé.
- Las 100 células restantes forman el trofoblasto, que se convertirá en el corión que pasará a formar la mayor parte de la placenta. Todas las membranas extraembrionarias juegan un papel vital durante el desarrollo pero serán descartadas al momento del nacimiento.
La placenta crece fuertemente fusionada a la pared del útero. Sus vasos sanguíneos, suministrados por el corazón fetal, están literalmente bañados en la sangre de la madre. Aunque normalmente no hay mezcla de los dos suministros de sangre, la placenta sí facilita la transferencia de una variedad de materiales entre el feto y la madre como
- recibir comida
- recibir oxígeno y descargar dióxido de carbono
- descarga de urea y otros desechos
- recibir anticuerpos (principalmente de la clase IgG). Estos permanecen por semanas después del nacimiento, protegiendo al bebé de las enfermedades a las que es inmune la madre.
Pero la placenta no es simplemente un dispositivo de transferencia. Utilizando materias primas de la sangre de la madre, sintetiza grandes cantidades de proteínas y también algunas hormonas. La actividad metabólica de la placenta es casi tan grande como la del propio feto. El cordón umbilical conecta al feto con la placenta. Recibe sangre desoxigenada de las arterias ilíacas del feto y devuelve sangre oxigenada al hígado y a la vena cava inferior.

Debido a que sus pulmones no están funcionando, la circulación en el feto difiere drásticamente de la del bebé después del nacimiento. Mientras que dentro del útero, la sangre bombeada por el ventrículo derecho evita los pulmones al fluir a través del foramen oval y el conducto arterioso.
Aunque la sangre en la placenta está en estrecho contacto con la sangre de la madre en el útero, normalmente no se produce la mezcla de su sangre. Sin embargo, algunas de las células sanguíneas del feto suelen escapar a la circulación de la madre, donde se sabe que sobreviven desde hace décadas. Esto plantea la posibilidad de hacer el diagnóstico prenatal de trastornos genéticos mediante el muestreo de la sangre de la madre en lugar de tener que depender de los procedimientos más invasivos de amniocentesis y muestreo de vellosidades coriónicas (CVS).
Fragmentos de ADN fetal (~ 300 pb de largo) de células apoptóticas de la placenta también se encuentran en el plasma de la madre tan pronto como 5 semanas después de la implantación. Estos pueden ser probados para diversas formas de aneuploidía, por ejemplo, la trisomía 21 del síndrome de Down. Mucho más raro es la fuga de células sanguíneas de la madre al feto. Sin embargo, sí ocurre. Algunas mujeres embarazadas con leucemia o linfoma han transferido la malignidad a su feto. Algunos bebés también han adquirido melanoma por el paso transplacentario de estas células altamente malignas de su madre.
Durante los primeros 2 meses de embarazo, se está formando la estructura básica del bebé. Esto implica la división celular, la migración celular y la diferenciación de las células en los muchos tipos que se encuentran en el bebé. Durante este periodo, el bebé en desarrollo -llamado embrión- es muy sensible a cualquier cosa que interfiera con los pasos involucrados. La infección vírica de la madre, por ejemplo, por el virus de la rubéola (“sarampión alemán”) o la exposición a ciertos químicos puede causar malformaciones en el embrión en desarrollo. Tales agentes se llaman teratógenos (“formadores de monstruo”). El tranquilizante, talidomida, tomado por muchas mujeres europeas embarazadas entre 1954 y 1962, resultó ser un potente teratógeno y fue responsable del nacimiento de varios miles de bebés deformados.
Después de aproximadamente dos meses, se han formado todos los sistemas del bebé, al menos de manera rudimentaria. A partir de entonces, el desarrollo del feto, como ahora se le llama, es principalmente una cuestión de crecimiento y modificaciones estructurales menores. El feto es menos susceptible a los teratógenos que el embrión. El embarazo implica una compleja interacción de hormonas.
La placenta es un aloinjerto
Uno de los mayores misterios sin resolver en inmunología es cómo la placenta sobrevive durante 9 meses sin ser rechazada por el sistema inmunológico de la madre. Cada célula de la placenta porta el genoma del padre (un conjunto haploide de sus cromosomas); incluyendo uno de sus cromosomas #6 donde se localizan los genes para los antígenos mayores de histocompatibilidad (HLA).
Una excepción parcial: ninguno de los genes del cromosoma X del padre se expresa. Si bien la inactivación del cromosoma X es aleatoria en las células del feto, NO es aleatoria en las células del trofoblasto. En cada célula del trofoblasto —y sus descendientes— es el cromosoma X paterno el que se inactiva. Pero esto no resuelve nuestro problema porque los genes para todos los antígenos principales de histocompatibilidad se encuentran en el cromosoma 6, el cual no está inactivado.
Así, la placenta es inmunológicamente tan extraña para la madre como lo sería un trasplante de riñón. Sin embargo, prospera. A pesar de medio siglo de investigación, el mecanismo para este estatus inmunológicamente privilegiado sigue siendo incierto. Pero una cosa está clara - La madre no es intrínsecamente tolerante a los antígenos del padre. Ella rechazará puntualmente un trasplante de piel del padre. Ella desarrolla anticuerpos contra sus antígenos de histocompatibilidad expresados por el feto. De hecho, las mujeres que han dado a luz varios hijos del mismo padre suelen ser excelentes fuentes de suero anti-HLA para su uso en la tipificación de tejidos. Entonces, ¿qué explica el fenómeno? Algunas posibilidades:
- La placenta no expresa antígenos de histocompatibilidad de clase II.
- Tampoco expresa los antígenos de histocompatibilidad clase I fuertemente inmunogénicos (HLA-A, HLA-B). Sí expresa HLA-C, pero esto sólo es débilmente inmunogénico.
- Las células de la placenta secretan progesterona, que es inmunosupresora.
- En ratas de laboratorio los embriones (y el endometrio de la madre) secretan la hormona liberadora de corticotropina (CRH). Esta hormona induce la expresión del ligando Fas (FasL) en las células de la placenta. Las células T activadas expresan Fas por lo que cualquier célula T amenazante se suicidaría por apoptosis cuando se encuentran con FasL en su diana.
- En ratones de laboratorio las células de la placenta degradan el aminoácido triptófano. El triptófano es esencial para la función de las células T. Cuando los ratones son tratados con un inhibidor de la enzima degradante de TRP, sus fetos son abortados rápidamente por la acción de los linfocitos de la madre. (D. H. Munn, et. al., Science, 281: 1191, 21 ago 1998.)
- En ratones, la expresión de genes que codifican citocinas necesarias para atraer células T efectoras (por ejemplo, CTL) en un tejido se suprime en las células de la placenta.
- Quizás lo más importante de todo es el aumento de la producción en la madre de células T reguladoras inmunosupresoras (Treg).
- El agotamiento de células Treg en ratones preñados conduce a un aborto espontáneo mientras
- la inyección de células Treg en ratones que de otra manera son propensos al aborto les permite llevar sus fetos a término.
- En humanos, el número de células Treg aumenta durante el embarazo (tanto en el feto como en la madre).
El 25 de julio de 2013 Louise Brown celebró su 35 cumpleaños. Ella fue la primera de lo que hoy suman unos cuatro millones (a nivel mundial) de “bebés probetas”; es decir, se desarrolló a partir de un óvulo que fue fertilizado fuera del cuerpo de su madre -el proceso denominado fertilización in vitro (FIV). La FIV implica
- Recolección de huevos maduros de la madre. Este no es un proceso fácil. La madre debe someterse a tratamientos hormonales para producir múltiples óvulos, los cuales luego deben ser retirados (bajo anestesia) de sus ovarios.
- Recolección de esperma del padre. La recolección generalmente no es un problema, pero a menudo los espermatozoides son defectuosos en su capacidad para fertilizar (por lo que prepara el escenario para ICSI).
- Mezclar espermatozoides y óvulos en un recipiente de cultivo (“in vitro”).
- Cultivar los óvulos fertilizados durante varios días hasta que se hayan desarrollado al menos hasta la etapa de 8 células.
- Colocar dos o más de estos en el útero de la madre (que sus tratamientos hormonales han preparado para la implantación).
- Mantener los dedos cruzados ya que solo alrededor de un tercio de los intentos dan como resultado un embarazo exitoso.
Inyección Intracitoplasmática de Esperma (ICSI)
La FIV exitosa asume la disponibilidad de espermatozoides sanos. Pero muchos casos de infertilidad surgen por defectos en el esperma del padre. A menudo estos pueden superarse inyectando directamente un solo esperma en el óvulo. En Estados Unidos hoy en día, unos dos tercios de los procedimientos ART emplean ICSI (aunque hasta la mitad de estos no involucran infertilidad masculina).
Transferencia Ooplásmica
La infertilidad en algunos casos puede provenir de defectos en el citoplasma del óvulo de la madre. Para eludir estos, el citoplasma se puede extraer del óvulo de una mujer joven y sana (“óvulo de donante”) e inyectarse junto con un solo espermatozoide en el óvulo de la futura madre. Aunque algunos niños sanos han nacido después de la transferencia ooplásmica, el jurado aún está fuera de su seguridad, y no está aprobado para su uso en Estados Unidos. Un motivo de preocupación es que la transferencia ooplásmica da como resultado un óvulo que porta tanto las mitocondrias de la madre como las mitocondrias del donante (en condiciones normales fertilización, todas las mitocondrias en el esperma del padre se destruyen en el óvulo). Esta condición llamada heteroplasmia crea un niño que tiene dos genomas de ADN mitocondriales diferentes en todas sus células.

Fig.15.7.1.9 transferencia ooplásmica
En casos raros, pero importantes, el defecto en el citoplasma de la futura madre es el resultado de que ella tiene mitocondrias con un gen mutante. La transferencia ooplásmica no ayuda en estos casos porque el óvulo fertilizado aún contendrá una preponderancia de las mitocondrias defectuosas de la madre. Pero tres técnicas elaboradas en animales de laboratorio muestran la promesa de ser adaptadas para ayudar a esas mujeres a producir jóvenes saludables.
Tres posibles formas de prevenir la transmisión de enfermedades mitocondriales
Transferencia de Husillo Materno
Investigadores en Oregón informaron en la edición del 17 de septiembre de 2009 de Nature que habían podido producir 4 monos rhesus sanos sin mitocondrias de su madre biológica.
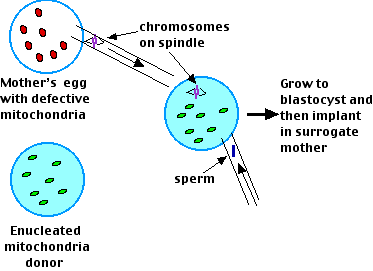
Su procedimiento:
- Retire el huso con todos sus cromosomas adheridos del ovocito de la madre en la metafase II de la meiosis. Lograron hacer esto sin que ninguna de sus mitocondrias se retirara también.
- Enuclear el ovocito del donante de mitocondrias y luego insertar los cromosomas de la madre —todavía unidos al huso— en él. Después inyectar un esperma del padre.
- Permita que el óvulo fertilizado se convierta en un blastocisto.
- Implante esto en el útero de una madre sustituta.
- El resultado: 4 bebés sanos cada uno con los genes nucleares de su madre y su padre pero ninguna de las mitocondrias de su madre.
Transferencia Pronuclear
En este procedimiento,
- Un óvulo que contiene mitocondrias mutantes es fertilizado por FIV.
- Los dos pronúcleos se extraen y se inyectan en un óvulo fertilizado con mitocondrias sanas y cuyos pronúcleos propios han sido removidos.
- Permita que el huevo se convierta en un blastocisto.
- Implante esto en el útero.
Ambos procedimientos (1) y (2) están bajo investigación para su uso en humanos.
Transferencia de Cuerpo Polar
Tanto el primer cuerpo polar (formado antes de la fertilización) como el segundo cuerpo polar (formado después de la fertilización) contienen un genoma equivalente al del ovocito secundario y cigoto respectivamente. Sin embargo, contienen pocas, si las hay, mitocondrias. En ratones, la transferencia de cualquiera de los cuerpos polares a un óvulo receptor enucleado (con mitocondrias sanas) produce ratones jóvenes con pocas, si alguna, de las mitocondrias de la madre donante con su ADNmt defectuoso. Entonces en ratones, al menos, esta técnica produce descendencia con menos heteroplasmia que las otras dos técnicas.
Si alguna de estas técnicas se puede aplicar a los humanos (hay obstáculos de seguridad y regulación aún por superar), permitiría a las mujeres portadoras de mitocondrias defectuosas dar a luz bebés libres de la dolencia.
El lado positivo del arte
- Ha permitido que unos cuatro millones de parejas previamente infértiles tengan hijos.
- Permite el tamizaje (en una célula extraída de la mórula de 8 células) para detectar la presencia de trastornos genéticos, evitando así iniciar un embarazo si se encuentra algún trastorno.
- Uno puede usar esperma congelado permitiendo la paternidad para un hombre que ya no es capaz de proporcionar esperma fresco.
- Debido a que se crean varias mórulas, los extras se pueden congelar, almacenar y usar más tarde
- si el intento inicial falla (la futura madre aún debe recibir hormonas para preparar su útero para la implantación y la tasa de éxito es menor con las mórulas descongeladas).
- Cuando la normativa lo permita, los extras pueden ser utilizados como fuente de células madre embrionarias (ES).
La desventaja de ART
- Aunque mejora, la tasa de éxito sigue siendo suficientemente baja (~ 35%) para que el proceso muchas veces tenga que repetirse (lo que es físicamente exigente además de ser muy costoso).
- Debido a que generalmente se transfieren varias morulas, los nacimientos múltiples son comunes (alrededor del 50%), y como suele ser el caso de los nacimientos múltiples, los bebés nacen temprano y pesan menos (~un tercio de todos los bebés ART en Estados Unidos nacen temprano). Para reducir el número de gemelos, trillizos, etc., más centros ART están recurriendo a la “transferencia de un solo embrión” (SET). Algunos centros ART encuentran que pueden aumentar la tasa de éxito y así confiar más en el SET cultivando las mórulas durante 5—6 días, en lugar de los 2—3 días habituales, antes de transferirlas (a estas alturas se han convertido en blastocistos) a la madre.
- El riesgo de defectos congénitos puede incrementarse ligeramente (de ~ 6% en embarazos “normales” a ~ 8% en embarazos ART).
- Los procedimientos de TAR en animales experimentales a menudo resultan en una falla en la correcta impresión genética. Queda por ver si esto va a plantear un problema para los humanos.
Nacimiento y Lactancia
Exactamente lo que provoca el inicio del trabajo de parto aún no se comprende completamente. Probablemente una variedad de controles hormonales integrados están en el trabajo. Un creciente cuerpo de evidencia implica un aumento en el nivel de ADN fetal en la sangre de la madre como desencadenante del inicio del parto. El primer resultado del trabajo de parto es la apertura del cuello uterino. Con continuas contracciones poderosas, el amnios se rompe y el líquido amniótico (las “aguas”) fluye a través de la vagina. El bebé lo sigue, y se puede cortar su cordón umbilical. Los pulmones del lactante se expanden y comienza a respirar. Esto requiere un cambio importante en el sistema circulatorio. El flujo sanguíneo a través del cordón umbilical, el conducto arterioso y el foramen oval cesa, y comienza el patrón adulto de flujo sanguíneo a través del corazón, la aorta y las arterias pulmonares. En algunos lactantes, el cambio es incompleto y el flujo sanguíneo a través de las arterias pulmonares es inadecuado. Una de las causas es no sintetizar suficiente óxido nítrico (NO). Poco después del bebé, se expulsa la placenta y los restos del cordón umbilical (la “placenta”).
Al momento del nacimiento, y durante unos días después, los senos de la madre contienen un líquido llamado calostro. Es rico en calorías y proteínas, incluyendo anticuerpos que proporcionan inmunidad pasiva para el recién nacido. Tres o cuatro días después del parto, las mamas comienzan a secretar leche.
- Su síntesis es estimulada por la hormona hipofisaria prolactina (PRL).
- Su liberación es estimulada por un aumento en el nivel de oxitocina cuando el bebé comienza a amamantar.
- La leche también contiene un péptido inhibidor. Si los senos no están completamente vaciados, el péptido se acumula e inhibe la producción de leche. Esta acción autocrina iguala así la oferta con la demanda.
Control de la natalidad
En la siguiente tabla se resumen los diversos métodos anticonceptivos disponibles y en uso en la actualidad.
| Método | Popularidad | Tasa de Embarazo |
|---|---|---|
| Planificación familiar natural (ritmo) | 1% | 25 |
| Condón masculino | 16% | 17 |
| Anticonceptivos orales (“la píldora”) | 28% | 0.3—8.7* |
| Dispositivos intrauterinos (DIU) | 8.5% | 0.1—1.0* |
| Implantes, por ejemplo, Implanon® | ~ 1% | 0.05—1.0* |
| Inyecciones DMPA | ~ 3.5% | 6.7 |
| Esterilización macho y hembra | 37% | << 1% |
| Ninguno | 85 | |
| * El menor valor se encuentra en condiciones ideales; es decir, entre mujeres altamente motivadas que reciben una buena atención médica. | ||


