17.2I: Ozono
- Page ID
- 57095
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
El ozono es una forma altamente activa de oxígeno (O 3 en lugar de O 2). El ozono se produce cuando una chispa eléctrica pasa a través del aire, y esto explica el olor característico que desprenden algunos motores eléctricos. El ozono presenta dos problemas biológicos muy diferentes: demasiado a niveles bajos de la atmósfera (la troposfera); demasiado poco a grandes altitudes (la estratosfera).
Ozono en la Troposfera
El ozono se produce por la reacción de la luz solar, el oxígeno y los gases de escape de los automóviles (que contienen hidrocarburos y óxidos de nitrógeno). El ozono es en gran parte responsable de las molestias asociadas con el smog fotoquímico. Esta forma de smog, desde hace mucho tiempo familiar para la gente de la cuenca de Los Ángeles, es ahora común donde la luz solar y el aire estancado ocurren en áreas urbanas (la Ciudad de México es un ejemplo dramático con niveles de ozono que a menudo superan las 100 ppb y a veces se elevan por encima de 350 ppb). Los altos niveles de ozono durante la acumulación de smog pueden causar dificultades a las personas con dolencias respiratorias como enfisema y asma. El ozono también daña las plantas y puede ser un factor importante en el daño que está ocurriendo a los bosques en Europa y América del Norte.
Ozono en la estratosfera
Si bien a menudo tenemos demasiado ozono a nuestro alrededor, la concentración de ozono alta en la estratosfera (que comienza aproximadamente 7 millas [11 km] hacia arriba, donde los aviones de pasajeros cruzan) ha disminuido en las últimas dos décadas. El monitoreo satelital de la estratosfera, que comenzó en 1978, ha revelado un marcado declive. El declive más grave ocurre sobre la Antártida en primavera (octubre) cuando una caída precipitada en el ozono provoca un agujero de ozono. La figura (cortesía de la NASA) muestra un mapa del agujero de ozono medido sobre la Antártida el 5 de octubre de 1987 por un dispositivo transportado en el satélite Nimbus 7. Se dibujan las puntas de América del Sur (cuadrante superior derecho) y África (inferior derecha), al igual que el contorno de Australia y Nueva Zelanda (inferior izquierda).

La unidad Dobson es una medida del número de moléculas de ozono en una columna vertical de la atmósfera. Se puede ver que la concentración de ozono disminuye en círculos concéntricos cada vez más pequeños con la lectura más baja centrada sobre el Polo Sur. A pesar de un aumento anómalo en octubre de 2015 (atribuido a una erupción volcánica en Chile), el agujero se ha ido reduciendo constantemente en los últimos 14 años. Esto es probablemente el resultado de la eliminación gradual de la fabricación y uso de clorofluorocarbonos.
El Escudo de Ozono
La difusión de este aire empobrecido en ozono puede explicar los descensos más graduales y prolongados que se están viendo en latitudes medias. De 1978-1990, los niveles promedio de ozono disminuyeron 8% en Europa y alrededor de 5% en Estados Unidos. Esto es ominoso porque el ozono protege la superficie terrestre de gran parte de la radiación ultravioleta que llega a la tierra desde el sol. Los rayos ultravioleta pueden causar cáncer de piel, cataratas y pueden deprimir el sistema inmunológico.
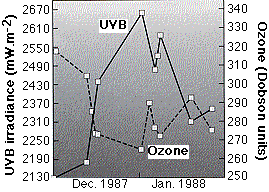
La gráfica (de C. R. Roy, et. al., en Nature 347: 235, 1990) muestra mediciones de la intensidad de la luz ultravioleta y la concentración de ozono en varios días soleados en Melbourne, Australia durante diciembre de 1987 y enero de 1988. Cuando los niveles de ozono eran bajos, la luz ultravioleta era más intensa y viceversa. La caída del ozono, que duró alrededor de un mes, probablemente fue causada por el aire empobrecido de ozono que se desplazó desde el agujero de ozono sobre el Polo Sur. La mayor parte de la luz ultravioleta que llega a la tierra es ultravioleta “B” (UV-B), que incluye longitudes de onda de 280 a 320 nm.
Clorofluorocarbonos (CFC)
Los clorofluorocarbonos (CFC) son gases sintéticos en los que los átomos de hidrógeno del metano son reemplazados por átomos de flúor y cloro (por ejemplo, CHF 2 Cl, CFCl 3, CF 2 Cl 2). Estos gases son no inflamables, no tóxicos y muy estables. Fueron ampliamente utilizados en la industria como refrigerantes (por ejemplo, en refrigeradores y aires acondicionados), solventes, propelentes en latas de aerosol (ahora prohibidas en algunos países), y en la fabricación de espumas plásticas. Los CFC escapan al aire de todos estos usos (por ejemplo, de unidades de refrigeración con fugas y desechadas). Su inercia química, que hace que los CFC sean tan deseables para la industria, también los convierte en una amenaza para la atmósfera. Una vez en la atmósfera, pueden tardar entre 60 y 100 años en descomponerse y desaparecer. Mientras tanto, representan una amenaza para el escudo de ozono.
Aunque parte del reciente agotamiento del ozono en la estratosfera probablemente se debió a causas naturales (erupciones volcánicas, menos manchas solares), algunas probablemente sean causadas por clorofluorocarbonos (CFC). No obstante, un acuerdo multinacional elaborado en 1987 -el Protocolo de Montreal- estableció un cronograma para reducir el uso de estos materiales. Y, de hecho, el monitoreo muestra que la concentración de CFC en la estratosfera ha ido disminuyendo desde mediados de los 90.
Los CFC han sido reemplazados en gran medida por hidrofluorocarbonos (HFC) en aires acondicionados y refrigeradores. Los HFC no destruyen el ozono sino que son potentes gases de efecto invernadero. Si bien el agujero de ozono sobre la Antártida aún persiste, hay señales de recuperación de los niveles de ozono en latitudes medias (donde vivimos). El hecho de que esta tendencia continúe puede depender de la contribución al agotamiento del ozono por el óxido nitroso.


