18.9: El origen de la vida
- Page ID
- 57334
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Para dar cuenta del origen de la vida en nuestra tierra requiere resolver varios problemas:
- Cómo se crearon las moléculas orgánicas que definen la vida, por ejemplo, aminoácidos, nucleótidos.
- Cómo estos se ensamblaron en macromoléculas, por ejemplo, proteínas y ácidos nucleicos, un proceso que requirió catalizadores.
- Cómo estos fueron capaces de reproducirse.
- Cómo estos fueron ensamblados en un sistema delimitado de su entorno (es decir, una celda).
Varias teorías abordan cada uno de estos problemas. En cuanto al primer problema, se han propuesto cuatro escenarios. Moléculas orgánicas:
- se sintetizaron a partir de compuestos inorgánicos en la atmósfera,
- llovió sobre la tierra desde el espacio exterior,
- se sintetizaron en respiraderos hidrotermales en el fondo oceánico,
- se sintetizaron cuando cometas o asteroides golpearon la tierra primitiva.
Escenario 1: Experimento de Miller
Stanley Miller, estudiante de posgrado en bioquímica, construyó el aparato que se muestra en la Figura\(\PageIndex{1}\). Lo llenó de agua (H 2 O), metano (CH 4), amoníaco (NH 3) e hidrógeno (H 2), pero sin oxígeno. Hipótesis que esta mezcla se asemejaba a la atmósfera de la tierra primitiva. La mezcla se mantuvo circulando por ebullición continua y luego condensando el agua. Los gases pasaron a través de una cámara que contenía dos electrodos con una chispa que pasaba entre ellos.

Al final de una semana, Miller utilizó la cromatografía en papel para demostrar que el matraz ahora contenía varios aminoácidos así como algunas otras moléculas orgánicas. Sin embargo, ahora se piensa que la atmósfera de la tierra primitiva no era rica en metano y amoníaco, ingredientes esenciales en los experimentos de Miller. En los años transcurridos desde la obra de Miller, se han probado muchas variantes de su procedimiento. Prácticamente todas las pequeñas moléculas que están asociadas con la vida se han formado:
- 17 de los 20 aminoácidos utilizados en la síntesis de proteínas, y todas las purinas y pirimidinas utilizadas en la síntesis de ácidos nucleicos.
- Pero la síntesis abiótica de ribosa -y por lo tanto de nucleótidos- ha sido mucho más difícil. Sin embargo, el éxito en la síntesis de ribonucleótidos de pirimidina en condiciones que podrían haber existido en la tierra primitiva se reportó en la edición del 14 de mayo de 2009 de Nature.
- Y en 2015, químicos en Cambridge Inglaterra dirigidos por John Sutherland informaron que habían podido sintetizar precursores de 12 de los 20 aminoácidos y dos (de los cuatro) ribonucleótidos utilizados por la vida así como glicerol-1-fosfato, un precursor de los lípidos. Crearon todas estas moléculas utilizando únicamente cianuro de hidrógeno (HCN) y sulfuro de hidrógeno (H 2 S) irradiados con luz ultravioleta en presencia de catalizadores minerales.
Escenario 2: Moléculas del Espacio Exterior
Los astrónomos, mediante espectroscopia infrarroja, han identificado una variedad de moléculas orgánicas en el espacio interestelar, incluyendo metano (CH 4), metanol (CH 3 OH), formaldehído (HCHO), cianoacetileno (HC 3 N) (que en experimentos de descarga por chispas es un precursor de la pirimidina citosina), hidrocarburos aromáticos policíclicos, así como bloques de construcción inorgánicos tales como dióxido de carbono (CO 2), monóxido de carbono (CO), amoníaco (NH 3), sulfuro de hidrógeno (H 2 S) y cianuro de hidrógeno (HCN).
Ha habido varios reportes de producir aminoácidos y otras moléculas orgánicas en laboratorios tomando una mezcla de moléculas conocidas por estar presentes en el espacio interestelar como amoníaco (NH 3), monóxido de carbono (CO), metanol (CH 3) OH) y agua (H 2 O), cianuro de hidrógeno (HCN) y exponerlo a una temperatura cercana a la del espacio (cerca del cero absoluto) y radiación ultravioleta intensa (UV). Tanto si las moléculas que formaron la vida terrestre llegaron aquí del espacio como si no, no cabe duda de que la materia orgánica llueve continuamente sobre la tierra (estimada en 30 toneladas por día).
Alternativamente, las moléculas orgánicas pueden ser transportadas a la Tierra a través de meteoritos como se demostró con el Meteorito Murchison que cayó cerca de Murchison, Australia el 28 de septiembre de 1969. Este meteorito resultó contener una variedad de moléculas orgánicas incluyendo: purinas y pirimidinas, polioles - compuestos con grupos hidroxilo en una cadena principal de 3 a 6 carbonos como glicerol y ácido glicérico (los azúcares son polioles) y los aminoácidos enumerados en la Tabla\(\PageIndex{1}\). Los aminoácidos y sus proporciones relativas fueron bastante similares a los productos formados en los experimentos de Miller.

Meteorito Murchison en el Museo Nacional de Historia Natural (Washington). (CC SA-BY 3.0 ;:Basilicofresco).
| Glicina | Ácido glutámico |
| Alanina | Isovalina |
| Valina | Norvalina |
| Prolina | N-metilalanina |
| Ácido aspártico | N-etilglicina |
La pregunta es ¿si estas moléculas identificadas en el meteorito de Murchison eran simplemente contaminantes terrestres que se metieron en el meteorito después de que cayó a la tierra? Probablemente no:
- Algunas de las muestras se recolectaron el mismo día en que cayó y posteriormente se manejaron con mucho cuidado para evitar la contaminación.
- Los polioles contenían los isótopos carbono-13 e hidrógeno-2 (deuterio) en mayores cantidades que las que se encuentran aquí en la tierra.
- Las muestras carecían de ciertos aminoácidos que se encuentran en todas las proteínas terrenales.
- Solo los aminoácidos L ocurren en las proteínas terrenales, pero los aminoácidos en el meteorito contienen formas D y L (aunque las formas L fueron ligeramente más prevalente).
Escenario 3: Respiraderos hidrotermales de aguas profundas
Algunos respiraderos hidrotermales de aguas profundas descargan grandes cantidades de hidrógeno, sulfuro de hidrógeno y dióxido de carbono a temperaturas de alrededor de 100°C (estos no son “fumadores negros”). Estos gases burbujean a través de cámaras ricas en sulfuros de hierro (FeS, FeS 2). Estos pueden catalizar la formación de moléculas orgánicas simples como el acetato. (Y la vida hoy depende de las enzimas que tienen átomos de Fe y S en sus sitios activos).
Escenario 4: Síntesis de laboratorio de nucleobases en condiciones que imitan el impacto de asteroides o cometas en la Tierra primitiva
Investigadores de la República Checa reportaron en 2014 que habían logrado la síntesis abiótica de adenina (A), guanina (G), citosina (C) y uracilo (U), las cuatro bases que se encuentran en el ARN (¿un inicio de ARN?) y tres de los cuatro encontrados en el ADN. Esto lo lograron bombardeando una mezcla de formamida y arcilla con potentes pulsos láser que imitaban la temperatura y presión esperadas cuando un gran meteorito golpea la tierra. La formamida es una sustancia simple, CH 3 NO, que se cree que fue abundante en la tierra primitiva y que contiene los cuatro elementos fundamentales para toda la vida.
Ensamblaje de polímeros
Otro problema es cómo se podrían ensamblar los polímeros -la base de la vida misma-.
- En solución, la hidrólisis de un polímero en crecimiento pronto limitaría el tamaño que podría alcanzar.
- La síntesis abiótica produce una mezcla de enantiómeros L y D. Cada uno inhibe la polimerización del otro. (Entonces, por ejemplo, la presencia de D aminoácidos inhibe la polimerización de L aminoácidos (los que componen las proteínas aquí en la tierra).
Esto ha llevado a una teoría de que los primeros polímeros se ensamblaron sobre superficies sólidas y minerales que los protegían de la degradación, y en el laboratorio se han sintetizado polipéptidos y polinucleótidos (moléculas de ARN) que contienen aproximadamente ~50 unidades en superficies minerales (por ejemplo, arcilla).
¿Un comienzo de ARN?
Todo el metabolismo depende de las enzimas y, hasta hace poco, cada enzima ha resultado ser una proteína. Pero las proteínas se sintetizan a partir de información codificada en ADN y traducida al ARNm. Entonces aquí hay un dilema de pollo y huevo. La síntesis de ADN y ARN requiere proteínas. Por lo tanto, las proteínas no se pueden hacer sin ácidos nucleicos y los ácidos nucleicos no se pueden hacer sin proteínas. El descubrimiento de que ciertas moléculas de ARN tienen actividad enzimática proporciona una posible solución. Estas moléculas de ARN —llamadas ribozimas— incorporan tanto las características requeridas de la vida: el almacenamiento de información como la capacidad de actuar como catalizadores.
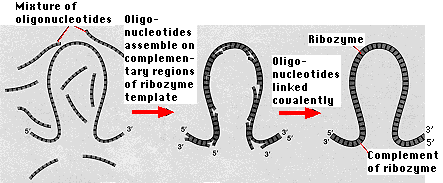
Si bien aún no se ha encontrado ribozima en la naturaleza que pueda replicarse, se han sintetizado ribozimas en el laboratorio que pueden catalizar el ensamblaje de oligonucleótidos cortos en complementos exactos de sí mismos. “La ribozima sirve tanto como el molde sobre el que se ensamblan longitudes cortas de ARN (“" oligonucleótidos "” siguiendo las reglas de emparejamiento de bases como el catalizador para unir covalentemente estos oligonucleótidos.”
En principio, las funciones mínimas de la vida podrían haber comenzado con el ARN y solo más tarde las proteínas se apoderaron de la maquinaria catalítica del metabolismo y el ADN tomó el relevo como repositorio del código genético. Varios otros fragmentos de evidencia apoyan esta noción de un “mundo ARN” original:
- Muchos de los cofactores que desempeñan tantos papeles en la vida se basan en la ribosa; por ejemplo:
- ATP
- NAD
- MODA
- coenzima A
- AMP cíclico
- GTP
- En la célula, todos los desoxirribonucleótidos se sintetizan a partir de precursores de ribonucleótidos.
- Muchas bacterias controlan la transcripción y/o traducción de ciertos genes con moléculas de ARN, no moléculas de proteína.
¿Reproducción?
Quizás la forma más temprana de reproducción fue una simple fisión del agregado creciente en dos partes, cada una con idénticos sistemas metabólicos y genéticos intactos.
¿
Para funcionar, la maquinaria de la vida debe estar separada de su entorno, alguna forma de fluido extracelular (ECF). Esta función es proporcionada por la membrana plasmática. Las membranas plasmáticas actuales están hechas de una doble capa de fosfolípidos. Solo son permeables a moléculas pequeñas sin carga como H 2 O, CO 2 y O 2. Se necesitan transportadores transmembrana especializados para que los iones, las moléculas hidrofílicas y orgánicas cargadas (por ejemplo, aminoácidos y nucleótidos) pasen dentro y fuera de la célula.
Sin embargo, el mismo laboratorio de Szostak que produjo el hallazgo descrito anteriormente reportado en la edición del 3 de julio de 2008 de Nature de que los ácidos grasos, alcoholes grasos y monoglicéridos -todas moléculas que pueden sintetizarse bajo condiciones prebióticas- también pueden formar bicapas lipídicas y éstas pueden espontáneamente ensamblar en vesículas encerradas.
A diferencia de las vesículas de fosfolípidos,
- admitir desde el medio externo moléculas cargadas como nucleótidos
- admitir desde el medio externo moléculas hidrofílicas como la ribosa
- crecer por autoensamblaje
- son impermeables a, y por lo tanto retienen, polímeros como oligonucleótidos.
Estos trabajadores cargaron sus vesículas sintéticas con una sola cadena corta de desoxicitidina (dC) estructurada para proporcionar un molde para su replicación. Cuando las vesículas se colocaron en un medio que contenía dG (químicamente modificado), estos nucleótidos ingresaron a las vesículas y se ensamblaron en una cadena de Gs complementaria a la cadena molde de Cs. Aquí, entonces, hay un sistema simple que es un modelo plausible para la creación de las primeras células a partir de la primitiva “sopa” de moléculas orgánicas.
De organismos unicelulares a multicelulares
Esta transición es probablemente la más fácil de entender.
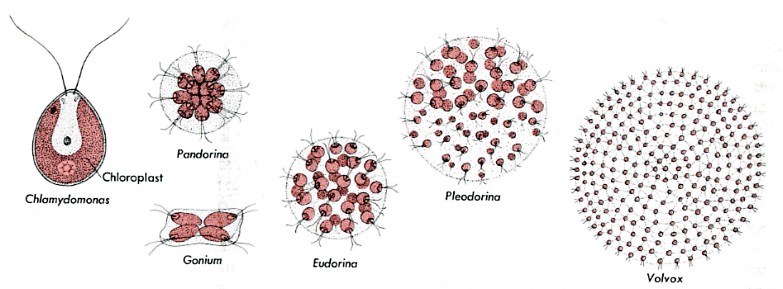
Varias algas verdes flageladas coloniales proporcionan una pista. Estas especies se llaman coloniales porque están compuestas simplemente por racimos de células independientes. Si se aísla una sola célula de Gonium, Pandorina o Eudorina del resto de la colonia, se alejará nadando pareciéndose bastante a una célula de Chlamydomonas. Entonces, al sufrir mitosis, formará una nueva colonia con el número característico de células en esa colonia.
(Las cifras no están dibujadas a escala. Sus tamaños van desde Chlamydomonas que tiene aproximadamente 10 µm de diámetro -poco más grande que un glóbulo rojo humano- hasta Volvox cuya esfera es de unos 350 µm de diámetro, visible a simple vista.)
La situación en Pleodorina y Volvox es diferente. En estos organismos, algunas de las células de la colonia (la mayoría en Volvox) no son capaces de vivir de manera independiente. Si se aísla una célula no reproductiva de una colonia Volvox, no podrá reproducirse por mitosis y eventualmente morirá. ¿Qué ha pasado? De alguna manera, hasta ahora poco clara, Volvox ha cruzado la línea separando los organismos coloniales simples de los verdaderamente multicelulares. A diferencia de Gonium, Volvox no puede considerarse simplemente una colonia de células individuales. Se trata de un solo organismo cuyas células han perdido su capacidad de vivir de forma independiente. Si un número suficiente de ellos se daña, toda la esfera de las células morirá.
¿Qué ha ganado Volvox? Al renunciar a su independencia, las células de Volvox se han convertido en especialistas. Ya no todas las células llevan a cabo todas las funciones de la vida (como en las formas coloniales); en cambio, ciertas células se especializan para llevar a cabo ciertas funciones mientras dejan otras funciones a otros especialistas. En Volvox este proceso no va más allá de tener ciertas células especializadas para la reproducción mientras que otras, incapaces de reproducirse, satisfacen las necesidades de fotosíntesis y locomoción.
En organismos multicelulares más complejos, el grado de especialización se lleva mucho más allá. Cada celda tiene una o dos funciones precisas para llevar a cabo. Depende de otras células para llevar a cabo todas las demás funciones necesarias para mantener la vida del organismo y así la suya propia.
La especialización y división del trabajo entre células es el resultado de su historia de diferenciación. Uno de los grandes problemas en biología es cómo surge la diferenciación entre las células, todas las cuales habiendo surgido por la mitosis, comparten los mismos genes.
Se han secuenciado los genomas tanto de Chlamydomonas como de Volvox. Aunque uno es unicelular, el otro multicelular, no sólo tienen aproximadamente el mismo número de genes que codifican proteínas (14,516 en Chlamydomonas, 14,520 en Volvox) sino que la mayoría de estos son homólogos. Volvox tiene sólo 58 genes que no tienen parientes en Chlamydomonas y aún menos ARNm únicos.
En algún momento, muchos de nosotros habríamos esperado que un organismo multicelular como Volvox con sus células diferenciadas y su complejo ciclo de vida hubiera tenido muchos más genes que un organismo unicelular como Chlamydomonas. Pero eso resulta no ser el caso.
¿Cómo explicar esta aparente paradoja? Mi conjetura es que así como lo hemos visto en la evolución de los animales, estamos viendo aquí que la evolución de la complejidad orgánica no es tanto una cuestión de la evolución de nuevos genes sino más bien de la evolución de los cambios en los elementos de control (promotores y potenciadores) que dictan cómo y dónde se encuentran los se expresará el kit de herramientas básicas de genes eucariotas.
La evidencia es convincente de que todos estos organismos son parientes cercanos; es decir, pertenecen al mismo clado. Ilustran cómo las formas coloniales podrían surgir de las unicelulares y las formas multicelulares de las coloniales.
¿El último ancestro común universal (LUCA)?
 Los 3 reinos de la vida contemporánea —arqueas, bacterias y eucariotas— comparten muchas similitudes de sus sistemas metabólicos y genéticos. Presumiblemente estos estuvieron presentes en un organismo que era ancestral a estos grupos: el “LUCA”. Aunque actualmente no hay suficientes datos para describir LUCA, la genómica comparativa y la proteómica revelan una relación más estrecha entre arqueas y eucariotas que cualquiera de las acciones con la bacteria. Excepto, por supuesto, por las mitocondrias y cloroplastos que los eucariotas obtuvieron de los endosimbiontes bacterianos. Aún es incierto si los endosimbiontes se adquirieron antes o después de que un linaje de arqueas hubiera adquirido un núcleo -y así comenzó el linaje de eucariotas-.
Los 3 reinos de la vida contemporánea —arqueas, bacterias y eucariotas— comparten muchas similitudes de sus sistemas metabólicos y genéticos. Presumiblemente estos estuvieron presentes en un organismo que era ancestral a estos grupos: el “LUCA”. Aunque actualmente no hay suficientes datos para describir LUCA, la genómica comparativa y la proteómica revelan una relación más estrecha entre arqueas y eucariotas que cualquiera de las acciones con la bacteria. Excepto, por supuesto, por las mitocondrias y cloroplastos que los eucariotas obtuvieron de los endosimbiontes bacterianos. Aún es incierto si los endosimbiontes se adquirieron antes o después de que un linaje de arqueas hubiera adquirido un núcleo -y así comenzó el linaje de eucariotas-.
¿Creando Vida?
Cuando me dirigí a la universidad (en 1949), escribí un ensayo especulando sobre la posibilidad de que algún día pudiéramos crear un organismo vivo a partir de ingredientes no vivos. Para cuando terminé mis estudios formales en biología —habiendo aprendido de la increíble complejidad de hasta el organismo más simple— concluí que tal hazaña nunca se podría lograr.
Ahora no estoy tan segura.
Varios avances recientes sugieren que podemos estar acercándonos a crear vida. (Pero tenga en cuenta que estos ejemplos representan manipulaciones de laboratorio que no necesariamente reflejan lo que pudo haber sucedido cuando la vida apareció por primera vez).
Ejemplos:
- La capacidad de crear vesículas encerradas en la membrana que pueden absorber pequeñas moléculas y ensamblarlas en polímeros que permanecen dentro de la “célula”.
- La capacidad de ensamblar ribosomas funcionales —las estructuras que convierten la información codificada en el genoma en las proteínas que manejan la vida— a partir de sus componentes.
- En 2008, científicos del Instituto J. Craig Venter (JCVI) informaron (en Science 29 de febrero de 2008) que habían logrado sintetizar un cromosoma bacteriano completo —que contenía 582,970 pares de bases— a partir de desoxinucleótidos individuales. Ya se conocía la secuencia completa del genoma de Mycoplasma genitalium. Usando esta información, sintetizaron unos 10,000 oligonucleótidos cortos (cada uno de aproximadamente 50 pb de largo) que representan todo el genoma del genitalium y luego -paso a paso- los ensamblaron en fragmentos cada vez más largos hasta que finalmente habían hecho toda la molécula circular de ADN que es el genoma.
¿Podría colocarse esto en el citoplasma de una célula viva y ejecutarla?
El mismo equipo demostró en el año anterior (ver Ciencia 3 de agosto de 2007) que podían insertar un cromosoma completo de una especie de micoplasma en el citoplasma de una especie relacionada y, en su momento, el receptor perdió su propio cromosoma (quizás destruido por enzimas de restricción codificadas por el cromosoma donante) y comenzó a expresar el fenotipo del donante. En definitiva, habían cambiado una especie por otra. Pero el cromosoma donante fue hecho por la bacteria donante, no sintetizada en el laboratorio. Sin embargo, no debe haber ningún obstáculo serio para lograr el mismo trasplante de genoma con un cromosoma sintetizado químicamente.
¡Lo han hecho! El mismo equipo informó el 20 de mayo de 2010 en el Science Express en línea que habían trasplantado con éxito un genoma completamente sintético —basado en el de Mycoplasma mycoides — a la especie relacionada Mycoplasma capricolum. La cepa receptora creció bien y pronto adquirió el fenotipo del donante de M. mycoides.
- En la edición del 4 de abril de 2014 de Science (Annaluru, N. et al. ), un gran grupo de investigadores -entre ellos muchos estudiantes universitarios de la Universidad Johns Hopkins- informaron que habían reemplazado con éxito el cromosoma 3 natural en Saccharomyces cerevisiae (que tiene 16 cromosomas) con un cromosoma totalmente sintético.
Su procedimiento:
- Sintetizar químicamente oligonucleótidos de 69 a 79 nt que representan todos los tramos de la secuencia conocida del cromosoma 9 (que contiene 316,617 pares de bases) excepto ciertas secuencias como transposones, muchos intrones y genes de ARN de transferencia. Además, se incluyeron nuevas secuencias no nativas como sitios loxP para ayudar a futuras manipulaciones del genoma.
- Coser estos juntos en bloques de ~750 pares de bases. Este paso fue realizado in vitro por estudiantes universitarios inscritos en la clase “Build A Genome” en Johns Hopkins.
- Introdúzcalos en células de levadura que las ligaron en tramos de ADN que contenían 2-4 mil pares de bases.
- Introducir estos paso a paso en las células de levadura para que reemplacen las porciones equivalentes del cromosoma nativo.
- El resultado: una cepa de levadura que crece igual de bien con su nuevo cromosoma artificial (que ahora solo contiene 272,871 pares de bases) como lo hacía antes.


