12.2: Características y Rasgos
- Page ID
- 59719
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Habilidades para Desarrollar
- Explicar la relación entre genotipos y fenotipos en sistemas genéticos dominantes y recesivos
- Desarrollar un cuadrado Punnett para calcular las proporciones esperadas de genotipos y fenotipos en un cruce monohíbrido
- Explicar el propósito y los métodos de una prueba cruzada
- Identificar patrones de herencia no mendeliana como dominancia incompleta, codominancia, letales recesivos, alelos múltiples y vinculación sexual
Las siete características que Mendel evaluó en sus plantas de guisante se expresaron cada una como una de dos versiones, o rasgos. La expresión física de las características se logra a través de la expresión de genes transportados en cromosomas. La composición genética de los guisantes consiste en dos copias similares u homólogas de cada cromosoma, una de cada progenitor. Cada par de cromosomas homólogos tiene el mismo orden lineal de genes. Es decir, los guisantes son organismos diploides en que tienen dos copias de cada cromosoma. Lo mismo es cierto para muchas otras plantas y para prácticamente todos los animales. Los organismos diploides utilizan la meiosis para producir gametos haploides, los cuales contienen una copia de cada cromosoma homólogo que se unen en la fertilización para crear un cigoto diploide.
Para los casos en los que un solo gen controla una sola característica, un organismo diploide tiene dos copias genéticas que pueden o no codificar la misma versión de esa característica. Las variantes génicas que surgen por mutación y existen en las mismas localizaciones relativas en cromosomas homólogos se denominan alelos. Mendel examinó la herencia de genes con solo dos formas alélicas, pero es común encontrar más de dos alelos para cualquier gen dado en una población natural.
Fenotipos y Genotipos
Dos alelos para un gen dado en un organismo diploide se expresan e interactúan para producir características físicas. Los rasgos observables expresados por un organismo son referidos como su fenotipo. La composición genética subyacente de un organismo, que consiste en alelos tanto físicamente visibles como no expresados, se llama su genotipo. Los experimentos de hibridación de Mendel demuestran la diferencia entre fenotipo y genotipo. Cuando las plantas de reproducción real en las que un progenitor tenía vainas amarillas y otro tenía vainas verdes fueron fertilizadas cruzadamente, todas las crías híbridas F 1 tenían vainas amarillas. Es decir, las crías híbridas fueron fenotípicamente idénticas al progenitor de reproducción real con vainas amarillas. Sin embargo, sabemos que el alelo donado por el progenitor con vainas verdes no se perdió simplemente porque reapareció en algunas de las crías F 2. Por lo tanto, las plantas F 1 deben haber sido genotípicamente diferentes de las parentales con vainas amarillas.
Las plantas P 1 que Mendel utilizó en sus experimentos fueron cada una homocigótica para el rasgo que estaba estudiando. Los organismos diploides que son homocigotos en un gen o locus dado tienen dos alelos idénticos para ese gen en sus cromosomas homólogos. Las plantas parentales de guisantes de Mendel siempre se criaron verdaderas porque ambos gametos producidos portaban el mismo rasgo. Cuando las plantas P 1 con rasgos contrastantes fueron fertilizadas cruzadamente, todas las crías fueron heterocigóticas para el rasgo contrastante, lo que significa que su genotipo reflejó que tenían diferentes alelos para el gen que se estaba examinando.
Alelos Dominantes y Recesivos
Nuestra discusión sobre los organismos homocigóticos y heterocigóticos nos lleva a explicar por qué las crías heterocigóticas F 1 eran idénticas a uno de los progenitores, en lugar de expresar ambos alelos. En las siete características de la planta de guisante, uno de los dos alelos contrastantes fue dominante y el otro recesivo. Mendel llamó al alelo dominante el factor unitario expresado; el alelo recesivo se denominó factor unitario latente. Ahora sabemos que estos llamados factores unitarios son en realidad genes en pares de cromosomas homólogos. Para un gen que se expresa en un patrón dominante y recesivo, los organismos homocigotos dominantes y heterocigóticos se verán idénticos (es decir, tendrán diferentes genotipos pero el mismo fenotipo). El alelo recesivo solo se observará en individuos homocigotos recesivos (Cuadro\(\PageIndex{1}\)).
| Rasgos Dominantes | Rasgos Recesivos |
|---|---|
| Acondroplasia | Albinismo |
| Braquidactilia | Fibrosis quística |
| Enfermedad de Huntington | Distrofia muscular de Duchenne |
| Síndrome de Marfan | Galactosemia |
| Neurofibromatosis | Fenilcetonuria |
| Pico de la viuda | Anemia falciforme |
| Pelo lanoso | Enfermedad de Tay-Sachs |
Existen varias convenciones para referirse a genes y alelos. A los efectos de este capítulo, abreviaremos los genes utilizando la primera letra del rasgo dominante correspondiente del gen. Por ejemplo, el violeta es el rasgo dominante para el color de la flor de una planta de guisante, por lo que el gen del color de la flor se abreviaría como V (tenga en cuenta que se acostumbra poner en cursiva las designaciones de genes). Además, usaremos letras mayúsculas y minúsculas para representar alelos dominantes y recesivos, respectivamente. Por lo tanto, nos referiríamos al genotipo de una planta de guisante dominante homocigótica con flores violetas como VV, una planta de guisante recesiva homocigótica con flores blancas como vv, y una planta de guisante heterocigótica con flores violetas como Vv.
El enfoque de Punnett Square para un cruce monohíbrido
Cuando la fertilización ocurre entre dos padres de reproducción verdadera que difieren en una sola característica, el proceso se llama cruce monohíbrido, y las crías resultantes son monohíbridos. Mendel realizó siete cruces monohíbridos que involucraron rasgos contrastantes para cada característica. A partir de sus resultados en las generaciones F 1 y F 2, Mendel postuló que cada progenitor en el cruce monohíbrido aportó uno de los dos factores unitarios pareados a cada descendencia, y cada combinación posible de factores unitarios era igualmente probable.
Para demostrar un cruce monohíbrido, considere el caso de plantas de guisante de reproducción real con semillas de guisantes amarillas versus verdes. El color dominante de la semilla es amarillo; por lo tanto, los genotipos parentales fueron YY para las plantas con semillas amarillas y yy para las plantas con semillas verdes, respectivamente. Se puede dibujar un cuadrado Punnett, ideado por el genetista británico Reginald Punnett, que aplique las reglas de probabilidad para predecir los posibles resultados de un cruce genético o apareamiento y sus frecuencias esperadas. Para preparar un cuadrado Punnett, todas las combinaciones posibles de los alelos parentales se listan a lo largo de la parte superior (para uno de los padres) y del lado (para el otro progenitor) de una cuadrícula, representando su segregación meiótica en gametos haploides. Después se hacen las combinaciones de óvulo y esperma en las cajas de la tabla para mostrar qué alelos se están combinando. Cada caja representa entonces el genotipo diploide de un cigoto, o óvulo fertilizado, que podría resultar de este apareamiento. Debido a que cada posibilidad es igualmente probable, las relaciones genotípicas se pueden determinar a partir de un cuadrado de Punnett. Si se conoce el patrón de herencia (dominante o recesivo), también se pueden inferir las proporciones fenotípicas. Para un cruce monohíbrido de dos padres de reproducción real, cada progenitor aporta un tipo de alelo. En este caso, solo es posible un genotipo. Todas las crías son Yy y tienen semillas amarillas (Figura\(\PageIndex{1}\)).
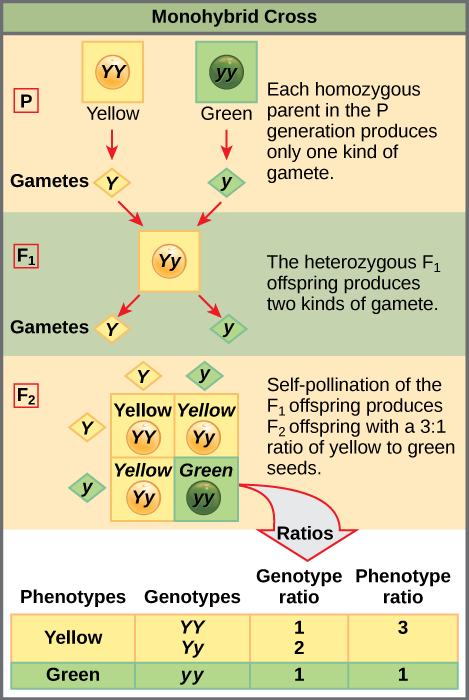
Un autocruce de una de las crías heterocigóticas Yy se puede representar en un cuadrado Punnett de 2 × 2 porque cada padre puede donar uno de dos alelos diferentes. Por lo tanto, la descendencia puede tener potencialmente una de cuatro combinaciones de alelos: YY, Yy, Yy o yy (Figura\(\PageIndex{1}\)). Observe que existen dos formas de obtener el genotipo Yy: una Y del óvulo y una y del esperma, o una y del óvulo y una Y del esperma. Ambas posibilidades deben ser contadas. Recordemos que las características de la planta de guisante de Mendel se comportaron de la misma manera en cruces recíprocos. Por lo tanto, las dos posibles combinaciones heterocigóticas producen descendencia genotípica y fenotípicamente idéntica a pesar de que sus alelos dominantes y recesivos derivan de diferentes progenitores. Se agrupan entre sí. Debido a que la fertilización es un evento aleatorio, esperamos que cada combinación sea igualmente probable y que la descendencia presente una relación de genotipos YY: Yy: yy de 1:2:1 (Figura\(\PageIndex{1}\)). Además, debido a que las crías YY e Yy tienen semillas amarillas y son fenotípicamente idénticas, aplicando la regla de probabilidad de suma, esperamos que la descendencia presente una relación fenotípica de 3 amarillo:1 verde. De hecho, trabajando con tamaños de muestra grandes, Mendel observó aproximadamente esta relación en cada generación F 2 resultante de cruces para rasgos individuales.
Mendel validó estos resultados realizando un cruce F 3 en el que se autocruzó las plantas F 2 que expresan dominante y recesiva. Cuando se autocruzó las plantas que expresaban semillas verdes, todas las crías tenían semillas verdes, confirmando que todas las semillas verdes tenían genotipos homocigóticos de yy. Cuando se autocruzó las plantas F 2 que expresaban semillas amarillas, encontró que un tercio de las plantas se reproducían verdaderas, y dos tercios de las plantas se segregaban en una proporción 3:1 de semillas amarillas: verdes. En este caso, las plantas de reproducción real tenían genotipos homocigotos (YY), mientras que las plantas segregantes correspondían al genotipo heterocigótico (Yy). Cuando estas plantas se autofertilizaron, el resultado fue igual que el cruce autofertilizante F 1.
El cruce de prueba distingue el fenotipo dominante
Más allá de predecir la descendencia de un cruce entre padres homocigotos o heterocigotos conocidos, Mendel también desarrolló una manera de determinar si un organismo que expresaba un rasgo dominante era un heterocigoto o un homocigoto. Llamado el cruce de prueba, esta técnica sigue siendo utilizada por los criadores de plantas y animales. En un cruce de prueba, el organismo que expresa dominante se cruza con un organismo homocigótico recesivo por la misma característica. Si el organismo que expresa dominante es un homocigoto, entonces todas las crías F 1 serán heterocigotos que expresen el rasgo dominante (Figura\(\PageIndex{2}\)). Alternativamente, si el organismo que expresa dominante es un heterocigoto, la descendencia F1 exhibirá una relación 1:1 de heterocigotos y homocigotos recesivos (Figura\(\PageIndex{2}\)). El cruce de prueba valida además el postulado de Mendel de que pares de factores unitarios se segregan por igual.
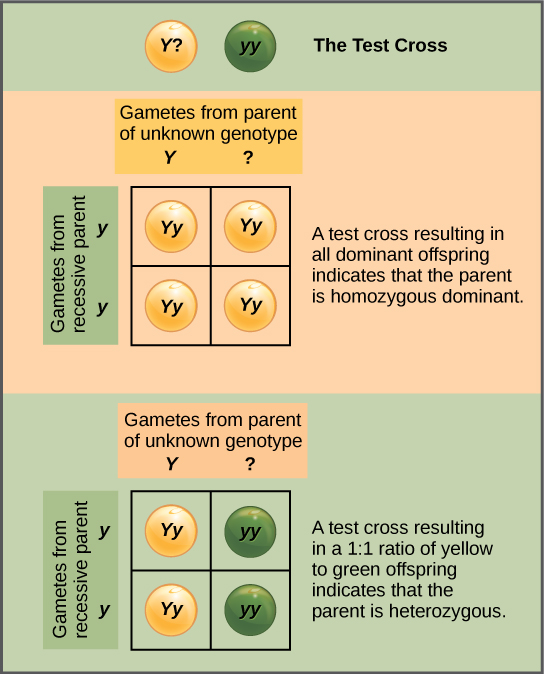
Ejercicio
En las plantas de guisante, los guisantes redondos (R) son dominantes a los arrugados (r). Se realiza un cruce de prueba entre una planta de guisante con guisantes arrugados (genotipo rr) y una planta de genotipo desconocido que tiene guisantes redondos. Terminas con tres plantas, todas las cuales tienen arvejas redondas. A partir de estos datos, ¿se puede decir si la planta madre del guisante redondo es homocigótica dominante o heterocigótica? Si la planta madre del guisante redondo es heterocigota, ¿cuál es la probabilidad de que una muestra aleatoria de 3 guisantes progenie sea redonda?
- Contestar
-
No se puede estar seguro de si la planta es homocigótica o heterocigótica ya que el conjunto de datos es demasiado pequeño: por casualidad, las tres plantas podrían haber adquirido solo el gen dominante aunque esté presente el recesivo. Si el progenitor redondo del guisante es heterocigoto, existe una octava probabilidad de que una muestra aleatoria de tres guisantes progenie sea redonda.
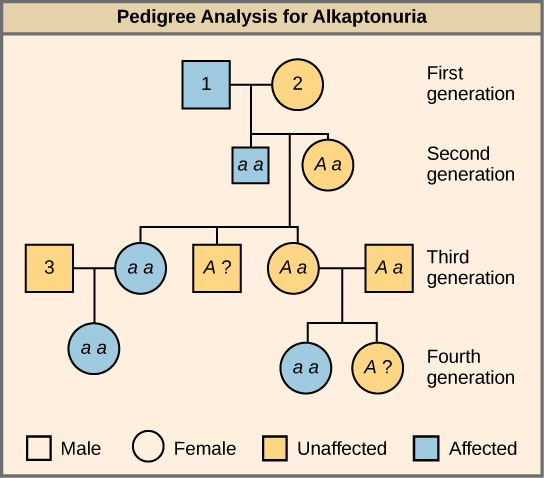
Muchas enfermedades humanas son heredadas genéticamente. Una persona sana en una familia en la que algunos miembros padecen un trastorno genético recesivo puede querer saber si tiene el gen causante de la enfermedad y qué riesgo existe de transmitir el trastorno a su descendencia. Por supuesto, hacer un cruce de prueba en humanos es poco ético y poco práctico. En cambio, los genetistas utilizan el análisis de pedigrí para estudiar el patrón de herencia de las enfermedades genéticas humanas (Figura\(\PageIndex{3}\)).
Ejercicio
¿Cuáles son los genotipos de los individuos etiquetados 1, 2 y 3?
- Contestar
-
El individuo 1 tiene el genotipo aa. El individuo 2 tiene el genotipo Aa. El individuo 3 tiene el genotipo Aa.
Alternativas al dominio y la recesividad
Los experimentos de Mendel con plantas de guisante sugirieron que: (1) existen dos “unidades” o alelos para cada gen; (2) los alelos mantienen su integridad en cada generación (sin mezcla); y (3) en presencia del alelo dominante, el alelo recesivo está oculto y no contribuye al fenotipo. Por lo tanto, los alelos recesivos pueden ser “portados” y no expresados por individuos. Tales individuos heterocigóticos a veces se denominan “portadores”. Otros estudios genéticos en otras plantas y animales han demostrado que existe mucha más complejidad, pero que los principios fundamentales de la genética mendeliana siguen siendo ciertos. En las secciones a seguir, consideramos algunas de las extensiones del Mendelismo. Si Mendel hubiera elegido un sistema experimental que exhibiera estas complejidades genéticas, es posible que no hubiera entendido lo que significaban sus resultados.
Dominio Incompleto
Los resultados de Mendel, que los rasgos se heredan como pares dominantes y recesivos, contradicen la visión en ese momento de que la descendencia exhibía una mezcla de los rasgos de sus padres. Sin embargo, el fenotipo heterocigoto ocasionalmente parece ser intermedio entre los dos progenitores. Por ejemplo, en la boca de dragón, Antirrhinum majus (Figura\(\PageIndex{4}\)), un cruce entre un progenitor homocigótico con flores blancas (C W C W) y un progenitor homocigótico con flores rojas (C R C R) producirá descendencia con rosa flores (C R C W). (Tenga en cuenta que se utilizan diferentes abreviaturas genotípicas para las extensiones mendelianas para distinguir estos patrones de dominancia simple y recesividad). Este patrón de herencia se describe como dominancia incompleta, denotando la expresión de dos alelos contrastantes de manera que el individuo exhibe un fenotipo intermedio. El alelo de las flores rojas es incompletamente dominante sobre el alelo de las flores blancas. Sin embargo, aún se pueden predecir los resultados de un autocruzamiento heterocigoto, al igual que con los cruces mendelianos dominantes y recesivos. En este caso, la relación genotípica sería de 1 C R C R:2 C R C W:1 C W C W, y la relación fenotípica sería 1:2:1 para rojo:rosa:blanco.

Codominancia
Una variación sobre la dominancia incompleta es la codominancia, en la que ambos alelos para una misma característica se expresan simultáneamente en el heterocigoto. Un ejemplo de codominancia son los grupos sanguíneos MN de humanos. Los alelos M y N se expresan en forma de un antígeno M o N presente en la superficie de los glóbulos rojos. Los homocigotos (L M L M y L N L N) expresan el alelo M o N, y los heterocigotos (L M L N) expresan ambos alelos por igual. En un autocruce entre heterocigotos que expresan un rasgo codominante, los tres posibles genotipos de crías son fenotípicamente distintos. Sin embargo, aún se aplica la relación genotípica 1:2:1 característica de un cruce monohíbrido mendeliano.
Alelos múltiples
Mendel implicaba que solo podían existir dos alelos, uno dominante y otro recesivo para un gen dado. Ahora sabemos que se trata de una simplificación exagerada. Aunque los humanos individuales (y todos los organismos diploides) solo pueden tener dos alelos para un gen dado, pueden existir múltiples alelos a nivel poblacional de tal manera que se observen muchas combinaciones de dos alelos. Nótese que cuando existen muchos alelos para un mismo gen, la convención es denotar el fenotipo o genotipo más común entre los animales salvajes como el tipo silvestre (a menudo abreviado “+”); esto se considera el estándar o norma. Todos los demás fenotipos o genotipos se consideran variantes de este estándar, lo que significa que se desvían del tipo silvestre. La variante puede ser recesiva o dominante al alelo de tipo silvestre.
Un ejemplo de alelos múltiples es el color del pelaje en conejos (Figura\(\PageIndex{5}\)). Aquí existen cuatro alelos para el gen c. La versión de tipo silvestre, C + C +, se expresa como pelaje marrón. El fenotipo de chinchilla, c ch c ch, se expresa como pelaje blanco de punta negra. El fenotipo del Himalaya, c h c h, tiene pelaje negro en las extremidades y pelaje blanco en otras partes. Finalmente, el fenotipo albino, o “incoloro”, cc, se expresa como pelaje blanco. En casos de alelos múltiples, pueden existir jerarquías de dominancia. En este caso, el alelo de tipo salvaje es dominante sobre todos los demás, la chinchilla es incompletamente dominante sobre el Himalaya y el albino, y el Himalaya es dominante sobre el albino. Esta jerarquía, o serie alélica, se reveló al observar los fenotipos de cada posible descendencia heterocigota.
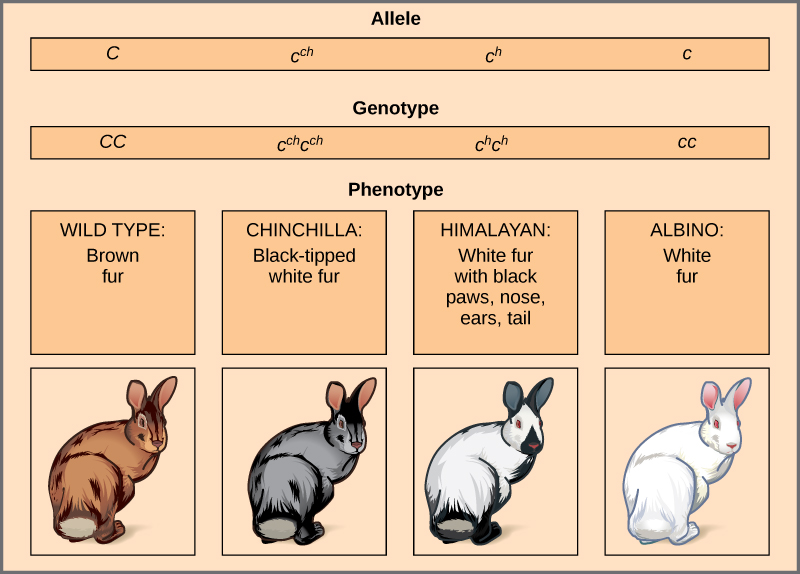
La dominancia completa de un fenotipo de tipo silvestre sobre todos los demás mutantes a menudo ocurre como un efecto de “dosificación” de un producto génico específico, de tal manera que el alelo de tipo silvestre suministra la cantidad correcta de producto génico mientras que los alelos mutantes no pueden. Para las series alélicas en conejos, el alelo de tipo silvestre puede suministrar una dosis dada de pigmento de piel, mientras que los mutantes suministran una dosis menor o ninguna en absoluto. Curiosamente, el fenotipo del Himalaya es el resultado de un alelo que produce un producto génico sensible a la temperatura que solo produce pigmento en las extremidades más frías del cuerpo del conejo.
Alternativamente, un alelo mutante puede ser dominante sobre todos los demás fenotipos, incluyendo el tipo silvestre. Esto puede ocurrir cuando el alelo mutante de alguna manera interfiere con el mensaje genético de manera que incluso un heterocigoto con una copia de alelo de tipo silvestre expresa el fenotipo mutante. Una forma en la que el alelo mutante puede interferir es potenciando la función del producto génico de tipo silvestre o cambiando su distribución en el cuerpo. Un ejemplo de esto es la mutación Antennapedia en Drosophila (Figura\(\PageIndex{6}\)). En este caso, el alelo mutante expande la distribución del producto génico, y como resultado, el heterocigoto de Antennapedia desarrolla patas en su cabeza donde deberían estar sus antenas.

Conexión de evolución: Alelos Múltiples confieren Resistencia a Fármacos en el Parásito de Malaria
La malaria es una enfermedad parasitaria en humanos que se transmite por mosquitos hembra infectados, incluyendo Anopheles gambiae (Figura\(\PageIndex{7}\) a), y se caracteriza por fiebre cíclica alta, escalofríos, síntomas similares a la gripe y anemia severa. Plasmodium falciparum y P. vivax son los agentes causantes más comunes de la malaria, y P. falciparum es el más mortal (Figura\(\PageIndex{7}\) b). Cuando se trata rápida y correctamente, la malaria por P. falciparum tiene una tasa de mortalidad de 0.1 por ciento. Sin embargo, en algunas partes del mundo, el parásito ha evolucionado resistencia a los tratamientos de malaria de uso común, por lo que los tratamientos palúdicos más efectivos pueden variar según la región geográfica.

En el sudeste asiático, África y Sudamérica, P. falciparum ha desarrollado resistencia a los fármacos antipalúdicos cloroquina, mefloquina y sulfadoxina-pirimetamina. P. falciparum, que es haploide durante la etapa vital en la que es infeccioso para los humanos, ha evolucionado múltiples alelos mutantes farmacorresistentes del gen dhps. Diferentes grados de resistencia a la sulfadoxina están asociados con cada uno de estos alelos. Al ser haploide, P. falciparum solo necesita un alelo farmacorresistente para expresar este rasgo.
En el sudeste asiático, diferentes alelos resistentes a sulfadoxina del gen dhps se localizan en diferentes regiones geográficas. Este es un fenómeno evolutivo común que ocurre porque los mutantes farmacorresistentes surgen en una población y se cruzan con otros aislados de P. falciparum en las proximidades. Los parásitos resistentes a la sulfadoxina causan considerables dificultades humanas en regiones donde este medicamento es ampliamente utilizado como remedio contra la malaria de venta libre. Como es común con patógenos que se multiplican a grandes números dentro de un ciclo de infección, P. falciparum evoluciona relativamente rápido (más de una década más o menos) en respuesta a la presión selectiva de los fármacos antipalúdicos de uso común. Por esta razón, los científicos deben trabajar constantemente para desarrollar nuevos medicamentos o combinaciones de medicamentos para combatir la carga mundial de malaria. 1
Rasgos ligados a X
En los humanos, así como en muchos otros animales y algunas plantas, el sexo del individuo está determinado por los cromosomas sexuales. Los cromosomas sexuales son un par de cromosomas no homólogos. Hasta ahora, solo hemos considerado patrones de herencia entre cromosomas no sexuales, o autosomas. Además de 22 pares homólogos de autosomas, las hembras humanas tienen un par homólogo de cromosomas X, mientras que los machos humanos tienen un par de cromosomas XY. Aunque el cromosoma Y contiene una pequeña región de similitud con el cromosoma X para que puedan emparejarse durante la meiosis, el cromosoma Y es mucho más corto y contiene muchos menos genes. Cuando un gen que se examina está presente en el cromosoma X, pero no en el cromosoma Y, se dice que está ligado a X.
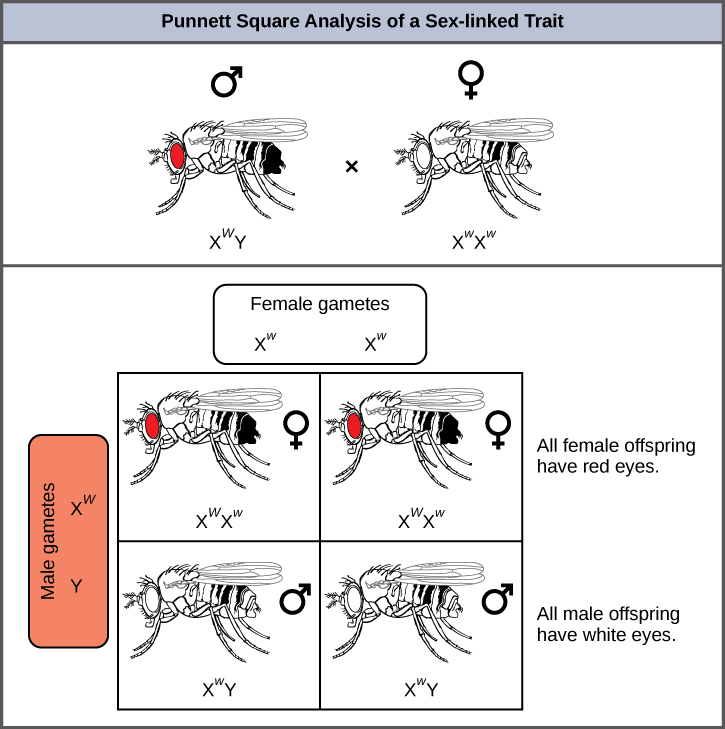
El color de ojos en Drosophila fue uno de los primeros rasgos ligados al cromosoma X en ser identificados. Thomas Hunt Morgan mapeó este rasgo al cromosoma X en 1910. Al igual que los humanos, los machos de Drosophila tienen un par de cromosomas XY y las hembras son XX. En las moscas, el color de ojos de tipo silvestre es rojo (X W) y es dominante al color de ojos blanco (X w) (Figura\(\PageIndex{8}\)). Debido a la ubicación del gen del color de los ojos, los cruces recíprocos no producen las mismas proporciones de descendencia. Se dice que los machos son hemicigóticos, porque tienen un solo alelo para cualquier característica ligada a X. La hemicigosidad hace que las descripciones de dominancia y recesividad sean irrelevantes para los machos XY. Los machos de Drosophila carecen de una segunda copia alélica en el cromosoma Y; es decir, su genotipo solo puede ser X W Y o X w Y. En contraste, las hembras tienen dos copias alélicas de este gen y pueden ser X W X W , X W X w, o X w X w.

En un cruce ligado a X, los genotipos de las crías F 1 y F 2 dependen de si el rasgo recesivo fue expresado por el macho o la hembra en la generación P 1. Con respecto al color de ojos de Drosophila, cuando el macho P 1 expresa el fenotipo de ojo blanco y la hembra es homocigota de ojos rojos, todos los miembros de la generación F 1 presentan ojos rojos (Figura\(\PageIndex{9}\)). Las hembras F 1 son heterocigóticas (X W X w), y los machos son todos X W Y, habiendo recibido su cromosoma X de la hembra P 1 dominante homocigótica y su cromosoma Y del macho P 1. Un cruce posterior entre la hembra X W X w y el macho X W Y produciría solo hembras de ojos rojos (con X W X W o X W X w) y machos de ojos rojos y blancos (con genotipos X W Y o X w Y). Ahora, considere un cruce entre una hembra homocigótica de ojos blancos y un macho con ojos rojos. La generación F 1 exhibiría solo hembras heterocigóticas de ojos rojos (X W X w) y solo machos de ojos blancos (X w Y). La mitad de las hembras F 2 serían de ojos rojos (X W X w) y la mitad serían de ojos blancos (X w X w). De igual manera, la mitad de los machos F 2 serían de ojos rojos (X W Y) y la mitad serían de ojos blancos (X w Y).
Ejercicio
¿Qué proporción de descendencia resultaría de un cruce entre un macho de ojos blancos y una hembra heterocigoto para el color de ojos rojos?
- Contestar
-
La mitad de la descendencia femenina sería heterocigótica (X W X w) con ojos rojos, y la mitad sería homocigótica recesiva (X w X w) con ojos blancos. La mitad de la descendencia masculina sería dominante hemicigótica (X W Y) con el rojo sí, y la mitad sería hemicigótica recesiva (X w Y) con ojos blancos.
Los descubrimientos en genética de la mosca de la fruta se pueden aplicar a la genética humana. Cuando una madre femenina es homocigótica para un rasgo recesivo ligado al X, pasará el rasgo al 100 por ciento de su descendencia. Su descendencia masculina está, por lo tanto, destinada a expresar el rasgo, ya que heredarán el cromosoma Y de su padre. En humanos, los alelos para ciertas afecciones (algunas formas de daltonismo, hemofilia y distrofia muscular) están ligados al cromosoma X. Se dice que las hembras heterocigóticas para estas enfermedades son portadoras y pueden no exhibir ningún efecto fenotípico. Estas hembras pasarán la enfermedad a la mitad de sus hijos y pasarán el estado de portadora a la mitad de sus hijas; por lo tanto, los rasgos recesivos ligados al cromosoma X aparecen con mayor frecuencia en hombres que en mujeres.
En algunos grupos de organismos con cromosomas sexuales, el género con los cromosomas sexuales no homólogos es el femenino más que el masculino. Este es el caso de todas las aves. En este caso, los rasgos vinculados al sexo tendrán más probabilidades de aparecer en la hembra, en la que son hemicigóticos.
Trastornos vinculados al sexo humano
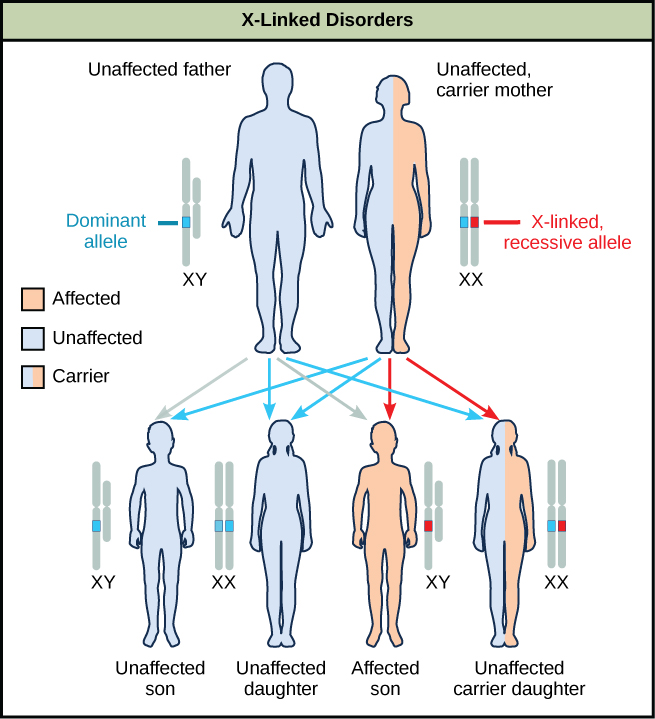
Los estudios de vinculación sexual en el laboratorio de Morgan proporcionaron los fundamentos para comprender los trastornos recesivos ligados al cromosoma X en humanos, que incluyen daltonismo rojo-verde y hemofilia de tipos A y B. Debido a que los machos humanos necesitan heredar solo un alelo X mutante recesivo para ser afectados, los trastornos ligados al cromosoma X se observan desproporcionadamente en los machos. Las hembras deben heredar alelos ligados al X recesivos de ambos padres para expresar el rasgo. Cuando heredan un alelo mutante ligado al X recesivo y un alelo de tipo silvestre ligado al X dominante, son portadores del rasgo y normalmente no se ven afectados. Las hembras portadoras pueden manifestar formas leves del rasgo debido a la inactivación del alelo dominante localizado en uno de los cromosomas X. Sin embargo, las portadoras femeninas pueden aportar el rasgo a sus hijos, lo que resulta en que el hijo exhiba el rasgo, o pueden aportar el alelo recesivo a sus hijas, resultando en que las hijas sean portadoras del rasgo (Figura\(\PageIndex{10}\)). Aunque existen algunos trastornos recesivos ligados a Y, normalmente se asocian con infertilidad en varones y por lo tanto no se transmiten a generaciones posteriores.
Enlace al aprendizaje
Mira este video para conocer más sobre los rasgos vinculados al sexo.
Letalidad
Una gran proporción de genes en el genoma de un individuo son esenciales para la supervivencia. Ocasionalmente, un alelo no funcional para un gen esencial puede surgir por mutación y transmitirse en una población siempre que los individuos con este alelo también tengan una copia funcional de tipo silvestre. El alelo de tipo silvestre funciona a una capacidad suficiente para sostener la vida y, por lo tanto, se considera dominante sobre el alelo no funcional. Sin embargo, considere dos progenitores heterocigóticos que tienen un genotipo de mutante de tipo salvado/no funcional para un hipotético gen esencial. En una cuarta parte de sus crías, esperaríamos observar individuos homocigóticos recesivos para el alelo no funcional. Debido a que el gen es esencial, estos individuos podrían no desarrollar la fertilización pasada, morir en el útero, o morir más tarde en la vida, dependiendo de qué etapa de la vida requiera este gen. Un patrón de herencia en el que un alelo sólo es letal en la forma homocigótica y en el que el heterocigoto puede ser normal o tener algún fenotipo alterado no letal se denomina letal recesivo.
Para los cruces entre individuos heterocigotos con un alelo letal recesivo que causa la muerte antes del nacimiento cuando son homocigotos, solo se observarían homocigotos y heterocigotos de tipo silvestre. Por lo tanto, la relación genotípica sería 2:1. En otros casos, el alelo letal recesivo también podría exhibir un fenotipo dominante (pero no letal) en el heterocigoto. Por ejemplo, el alelo Curly letal recesivo en Drosophila afecta la forma del ala en la forma heterocigota pero es letal en el homocigoto.
Una sola copia del alelo de tipo silvestre no siempre es suficiente para el funcionamiento normal o incluso la supervivencia. El patrón de herencia letal dominante es aquel en el que un alelo es letal tanto en el homocigoto como en el heterocigoto; este alelo sólo puede transmitirse si el fenotipo de letalidad ocurre después de la edad reproductiva. Los individuos con mutaciones que resultan en alelos letales dominantes no logran sobrevivir incluso en la forma heterocigota. Los alelos letales dominantes son muy raros porque, como cabría esperar, el alelo solo dura una generación y no se transmite. Sin embargo, así como el alelo letal recesivo podría no manifestar inmediatamente el fenotipo de muerte, los alelos letales dominantes también podrían no expresarse hasta la edad adulta. Una vez que el individuo alcanza la edad reproductiva, el alelo puede transmitirse sin saberlo, resultando en una muerte retrasada en ambas generaciones. Un ejemplo de esto en humanos es la enfermedad de Huntington, en la que el sistema nervioso se desgasta gradualmente (Figura\(\PageIndex{11}\)). Las personas heterocigóticas para el alelo dominante de Huntington (Hh) inevitablemente desarrollarán la enfermedad fatal. No obstante, la aparición de la enfermedad de Huntington puede no ocurrir hasta los 40 años, momento en el que las personas afligidas ya pueden haber pasado el alelo al 50 por ciento de sus crías.
Resumen
Cuando se cruzan individuos de reproducción verdadera u homocigotos que difieren por cierto rasgo, todos los descendientes serán heterocigotos para ese rasgo. Si los rasgos se heredan como dominantes y recesivos, la descendencia F 1 exhibirá el mismo fenotipo que el homocigoto parental para el rasgo dominante. Si estas crías heterocigóticas son autocruzadas, la descendencia F 2 resultante será igualmente probable que herede gametos portadores del rasgo dominante o recesivo, dando lugar a descendencia de los cuales una cuarta parte son homocigóticos dominantes, la mitad son heterocigóticos y una cuarta parte son homocigóticos recesivos. Debido a que los individuos homocigotos dominantes y heterocigóticos son fenotípicamente idénticos, los rasgos observados en la descendencia F 2 exhibirán una relación de tres dominantes a uno recesivo.
Los alelos no siempre se comportan en patrones dominantes y recesivos. La dominancia incompleta describe situaciones en las que el heterocigoto exhibe un fenotipo que es intermedio entre los fenotipos homocigóticos. La codominancia describe la expresión simultánea de ambos alelos en el heterocigoto. Aunque los organismos diploides sólo pueden tener dos alelos para un gen dado, es común que más de dos alelos de un gen existan en una población. En los humanos, como en muchos animales y algunas plantas, las hembras tienen dos cromosomas X y los machos tienen un cromosoma X y un cromosoma Y. Se dice que los genes que están presentes en el cromosoma X pero no en el cromosoma Y están ligados a X, de tal manera que los machos solo heredan un alelo para el gen, y las hembras heredan dos. Por último, algunos alelos pueden ser letales. Los alelos letales recesivos solo son letales en homocigotos, pero los alelos letales dominantes también son fatales en heterocigotos.
Notas al pie
- 1 Sumiti Vinayak, et al., “Origen y Evolución del Plasmodium falciparum Resistente a Sulfadoxina”, Biblioteca Pública de Ciencia Patógenos 6, núm. 3 (2010): e1000830, doi:10.1371/journal.ppat.1000830.
Glosario
- alelo
- variaciones genéticas que surgen por mutación y existen en las mismas ubicaciones relativas en cromosomas homólogos
- autosomas
- cualquiera de los cromosomas no sexuales
- codominancia
- en un heterocigoto, expresión completa y simultánea de ambos alelos para una misma característica
- letal dominante
- patrón de herencia en el que un alelo es letal tanto en el homocigoto como en el heterocigoto; este alelo solo puede transmitirse si el fenotipo de letalidad ocurre después de la edad reproductiva
- genotipo
- composición genética subyacente, que consiste en alelos tanto físicamente visibles como no expresados, de un organismo
- hemicigótico
- presencia de un solo alelo para una característica, como en el ligamiento X; la hemicigosidad hace irrelevantes las descripciones de dominancia y recesividad
- heterocigótico
- que tiene dos alelos diferentes para un gen dado en el cromosoma homólogo
- homocigotos
- que tiene dos alelos idénticos para un gen dado en el cromosoma homólogo
- dominio incompleto
- en un heterocigoto, expresión de dos alelos contrastantes de manera que el individuo muestre un fenotipo intermedio
- monohíbrido
- resultado de un cruce entre dos padres de crianza verdadera que expresan diferentes rasgos por una sola característica
- fenotipo
- rasgos observables expresados por un organismo
- Cuadrado Punnett
- representación visual de un cruce entre dos individuos en el que los gametos de cada individuo se denotan a lo largo de la parte superior y lateral de una cuadrícula, respectivamente, y los posibles genotipos cigóticos se recombinan en cada caja de la cuadrícula
- letal recesivo
- patrón de herencia en el que un alelo solo es letal en la forma homocigótica; el heterocigoto puede ser normal o tener algún fenotipo alterado, no letal
- vinculado al sexo
- cualquier gen en un cromosoma sexual
- prueba cruzada
- cruce entre un individuo de expresión dominante con un genotipo desconocido y un individuo homocigótico recesivo; los fenotipos de descendencia indican si el progenitor desconocido es heterocigoto u homocigótico para el rasgo dominante
- Vinculado a X
- presente en el cromosoma X, pero no en el cromosoma Y


