2.5: Átomos, isótopos, iones y moléculas - Las conchas de electrones y el modelo de Bohr
- Page ID
- 57669
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
- Construir un átomo según el modelo de Bohr
Conchas de electrones y el modelo Bohr
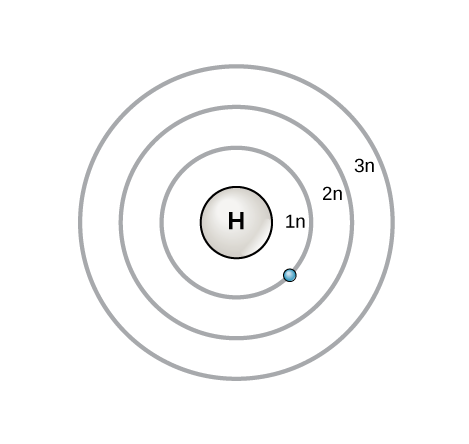
Como se discutió anteriormente, existe una conexión entre el número de protones en un elemento, el número atómico que distingue a un elemento de otro, y el número de electrones que tiene. En todos los átomos eléctricamente neutros, el número de electrones es el mismo que el número de protones. Cada elemento, cuando es eléctricamente neutro, tiene un número de electrones igual a su número atómico.
Un modelo temprano del átomo fue desarrollado en 1913 por el científico danés Niels Bohr (1885—1962). El modelo de Bohr muestra el átomo como un núcleo central que contiene protones y neutrones con los electrones en orbitales circulares a distancias específicas del núcleo. Estas órbitas forman capas de electrones o niveles de energía, que son una forma de visualizar el número de electrones en las diversas conchas. Estos niveles de energía son designados por un número y el símbolo “n”. Por ejemplo, 1n representa el primer nivel de energía ubicado más cercano al núcleo.
Los electrones llenan los proyectiles orbitales en un orden consistente. En condiciones estándar, los átomos llenan primero las conchas internas (más cercanas al núcleo), lo que a menudo resulta en un número variable de electrones en la capa más externa. La capa más interna tiene un máximo de dos electrones, pero las dos siguientes capas de electrones pueden tener cada una un máximo de ocho electrones. Esto se conoce como la regla del octeto que establece que, con la excepción de la capa más interna, los átomos son más estables energéticamente cuando tienen ocho electrones en su caparazón de valencia, la capa de electrones más externa. Ejemplos de algunos átomos neutros y sus configuraciones de electrones se muestran en. Como se muestra, el helio tiene una capa electrónica externa completa, con dos electrones llenando su primera y única capa. De manera similar, el neón tiene una cubierta externa completa de 2n que contiene ocho electrones. En contraste, el cloro y el sodio tienen siete y un electrones en sus capas externas, respectivamente. Teóricamente, serían más estables energéticamente si siguieran la regla del octeto y tuvieran ocho.
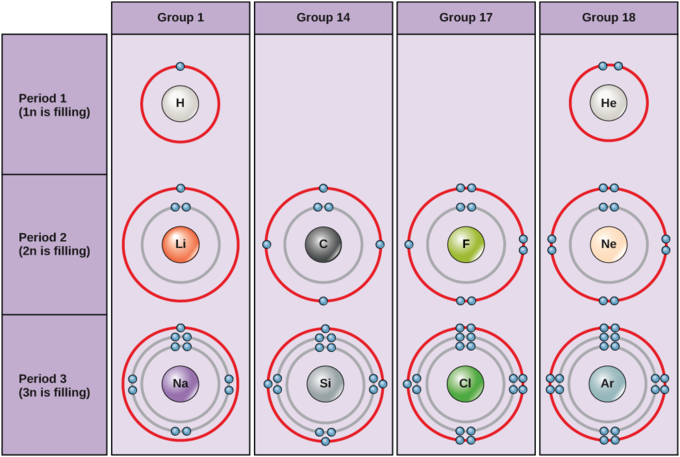
Un átomo puede ganar o perder electrones para lograr una capa de valencia completa, la configuración electrónica más estable. La tabla periódica está dispuesta en columnas y filas en función del número de electrones y dónde se encuentran estos electrones, proporcionando una herramienta para entender cómo se distribuyen los electrones en la capa externa de un átomo. Como se muestra en, el grupo de 18 átomos helio (He), neón (Ne) y argón (Ar) todos tienen capas externas de electrones llenos, lo que hace innecesario que ganen o pierdan electrones para lograr la estabilidad; son altamente estables como átomos individuales. Su no reactividad ha dado lugar a que se les nombre los gases inertes (o gases nobles). En comparación, los elementos del grupo 1, incluyendo hidrógeno (H), litio (Li) y sodio (Na), todos tienen un electrón en sus conchas más externas. Esto significa que pueden lograr una configuración estable y una capa externa llena al donar o perder un electrón. Como resultado de perder un electrón cargado negativamente, se convierten en iones cargados positivamente. Cuando un átomo pierde un electrón para convertirse en un ion cargado positivamente, esto se indica con un signo más después del símbolo del elemento; por ejemplo, Na +. Los elementos del grupo 17, entre ellos el flúor y el cloro, tienen siete electrones en sus conchas más externas; tienden a llenar esta concha al obtener un electrón de otros átomos, convirtiéndolos en iones cargados negativamente. Cuando un átomo gana un electrón para convertirse en un ion cargado negativamente esto se indica con un signo menos después del símbolo del elemento; por ejemplo, F-. Así, las columnas de la tabla periódica representan el estado potencial compartido de las capas externas de electrones de estos elementos que es responsable de sus características químicas similares.
Puntos Clave
- En el modelo Bohr del átomo, el núcleo contiene la mayor parte de la masa del átomo en sus protones y neutrones.
- Orbitando el núcleo cargado positivamente están los electrones cargados negativamente, que aportan poco en términos de masa, pero son eléctricamente equivalentes a los protones en el núcleo.
- En la mayoría de los casos, los electrones llenan primero los orbitales de menor energía, seguidos por el siguiente orbital de mayor energía hasta que esté lleno, y así sucesivamente hasta que se hayan colocado todos los electrones.
- Los átomos tienden a ser más estables con una capa exterior completa (una que, después de la primera, contiene 8 electrones), conduciendo a lo que comúnmente se llama la “regla del octeto”.
- Las propiedades de un elemento están determinadas por sus electrones más externos, o aquellos en el orbital de mayor energía.
- Los átomos que no tienen capas externas completas tenderán a ganar o perder electrones, resultando en una capa externa completa y, por lo tanto, estabilidad.
Términos Clave
- regla del octeto: Una regla que establece que los átomos pierden, ganan o comparten electrones para tener una capa de valencia completa de 8 electrones. (El hidrógeno está excluido porque puede contener un máximo de 2 electrones en su caparazón de valencia).
- cáscara de electrones: Los estados colectivos de todos los electrones en un átomo que tiene el mismo número cuántico principal (visualizado como una órbita en la que se mueven los electrones).


