2.19: Carbono - Hidrocarburos
- Page ID
- 57695
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
- Discutir el papel de los hidrocarburos en biomacromoléculas
Hidrocarburos
Los hidrocarburos son moléculas orgánicas que constan enteramente de carbono e hidrógeno, como el metano (CH 4). Los hidrocarburos se utilizan a menudo como combustibles: el propano en una parrilla de gas o el butano en un encendedor. Los muchos enlaces covalentes entre los átomos en los hidrocarburos almacenan una gran cantidad de energía, que se libera cuando estas moléculas se queman (oxidan). El metano, un excelente combustible, es la molécula de hidrocarburo más simple, con un átomo de carbono central unido a cuatro átomos de hidrógeno diferentes. La geometría de la molécula de metano, donde los átomos residen en tres dimensiones, está determinada por la forma de sus orbitales de electrones. El carbono y los cuatro átomos de hidrógeno forman una forma conocida como tetraedro, con cuatro caras triangulares; por esta razón, se describe que el metano tiene geometría tetraédrica.
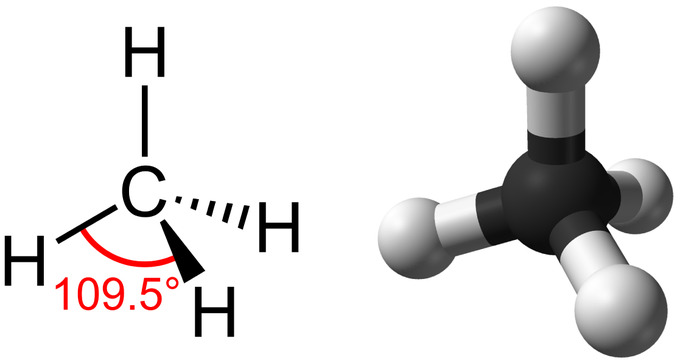
Como columna vertebral de las grandes moléculas de los seres vivos, los hidrocarburos pueden existir como cadenas lineales de carbono, anillos de carbono o combinaciones de ambos. Además, los enlaces carbono-carbono individuales pueden ser enlaces covalentes simples, dobles o triples; cada tipo de enlace afecta la geometría de la molécula de una manera específica. Esta forma tridimensional o conformación de las grandes moléculas de la vida (macromoléculas) es fundamental para su funcionamiento.
Cadenas de hidrocarburos
Las cadenas hidrocarbonadas están formadas por enlaces sucesivos entre átomos de carbono y pueden ser ramificadas o no ramificadas. La geometría general de la molécula se ve alterada por las diferentes geometrías de enlaces covalentes simples, dobles y triples. Los hidrocarburos etano, eteno y etino sirven como ejemplos de cómo los diferentes enlaces carbono-carbono afectan la geometría de la molécula. Los nombres de las tres moléculas comienzan con el prefijo “eth-”, que es el prefijo para dos hidrocarburos de carbono. Los sufijos “-ane”, “-eno” y “-yne” se refieren a la presencia de enlaces carbono-carbono simples, dobles o triples, respectivamente. Así, propano, propeno y propinosiguen el mismo patrón con tres moléculas de carbono, butano, buteno y butinopara cuatro moléculas de carbono, y así sucesivamente. Los enlaces dobles y triples cambian la geometría de la molécula: los enlaces simples permiten la rotación a lo largo del eje del enlace, mientras que los dobles enlaces conducen a una configuración plana y los enlaces triples a uno lineal. Estas geometrías tienen un impacto significativo en la forma que una molécula en particular puede asumir.

Anillos de Hidrocarburos
Los hidrocarburos discutidos hasta el momento han sido hidrocarburos alifáticos, los cuales consisten en cadenas lineales de átomos de carbono. Otro tipo de hidrocarburo, los hidrocarburos aromáticos, consiste en anillos cerrados de átomos de carbono. Las estructuras de anillo se encuentran en los hidrocarburos, a veces con la presencia de dobles enlaces, lo que se puede observar comparando la estructura del ciclohexano con el benceno. El anillo de benceno está presente en muchas moléculas biológicas incluyendo algunos aminoácidos y la mayoría de los esteroides, que incluye el colesterol y las hormonas estrógeno y testosterona. El anillo de benceno también se encuentra en el herbicida 2,4-D. El benceno es un componente natural del petróleo crudo y ha sido clasificado como carcinógeno. Algunos hidrocarburos tienen porciones tanto alifáticas como aromáticas; el betacaroteno es un ejemplo de tal hidrocarburo.

Puntos Clave
- Los hidrocarburos son moléculas que contienen solo carbono e hidrógeno.
- Debido a los patrones de unión únicos del carbono, los hidrocarburos pueden tener enlaces simples, dobles o triples entre los átomos de carbono.
- Los nombres de hidrocarburos con enlaces simples terminan en “-ane”, aquellos con dobles enlaces terminan en “-eno” y aquellos con enlaces triples terminan en “-yne”.
- La unión de hidrocarburos les permite formar anillos o cadenas.
Términos Clave
- enlace covalente: Un tipo de enlace químico donde dos átomos están conectados entre sí por la compartición de dos o más electrones.
- alifático: De una clase de compuestos orgánicos en los que los átomos de carbono están dispuestos en una cadena abierta.
- aromático: Tener un anillo cerrado de enlaces simples y dobles alternos con electrones deslocalizados.


