6.8: Energía Potencial, Cinética, Libre y de Activación - Energía de Activación
- Page ID
- 57906
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)- Discutir el concepto de energía de activación
Muchas reacciones químicas, y casi todas las reacciones bioquímicas no ocurren espontáneamente y deben tener una entrada inicial de energía (llamada energía de activación) para comenzar. Se debe considerar la energía de activación al analizar reacciones tanto endergónicas como exergónicas. Las reacciones exergónicas tienen una liberación neta de energía, pero aún requieren una pequeña cantidad de entrada de energía antes de que puedan continuar con sus pasos de liberación de energía. Esta pequeña cantidad de entrada de energía necesaria para que ocurran todas las reacciones químicas se denomina energía de activación (o energía libre de activación) y se abrevia E A.

Energía de activación en reacciones químicas
¿Por qué una reacción de ∆G negativa y liberadora de energía requeriría realmente algo de energía para proceder? La razón radica en los pasos que tienen lugar durante una reacción química. Durante las reacciones químicas, ciertos enlaces químicos se rompen y se forman otros nuevos. Por ejemplo, cuando se descompone una molécula de glucosa, se rompen los enlaces entre los átomos de carbono de la molécula. Dado que se trata de enlaces de almacenamiento de energía, liberan energía cuando se rompen. No obstante, para ponerlos en un estado que permita que los enlaces se rompan, la molécula debe estar algo contorsionada. Se requiere una pequeña entrada de energía para lograr este estado contorsionado, que se llama estado de transición: es un estado inestable de alta energía. Por esta razón, las moléculas reaccionantes no duran mucho en su estado de transición, sino que pasan muy rápidamente a los siguientes pasos de la reacción química.
Las células a veces acoplarán una reacción exergónica (ΔG0<0) with endergonic reactions (ΔG>), permitiéndoles proceder. Este cambio espontáneo de una reacción a otra se llama acoplamiento energético. La energía libre liberada por la reacción exergónica es absorbida por la reacción
endergónica. Un ejemplo de acoplamiento de energía usando ATP implica una bomba de iones transmembrana que es extremadamente importante para la función celular.
Diagramas de energía gratis
Los diagramas de energía libre ilustran los perfiles de energía para una reacción dada. Si la reacción es exergónica (ΔG0<0) or endergonic (ΔG>) determina si los productos en el diagrama existirán en un estado de energía menor o mayor que los reactivos. Sin embargo, la medida de la energía de activación es independiente de la ΔG de la reacción. Es decir, a una temperatura dada, la energía de activación depende de la naturaleza de la transformación química que tenga lugar, pero no del estado energético relativo de los reactivos y productos.
Si bien la imagen anterior discute el concepto de energía de activación dentro del contexto de la reacción exergónica hacia adelante, los mismos principios se aplican a la reacción inversa, que debe ser endergónica. Observe que la energía de activación para la reacción inversa es mayor que para la reacción directa.
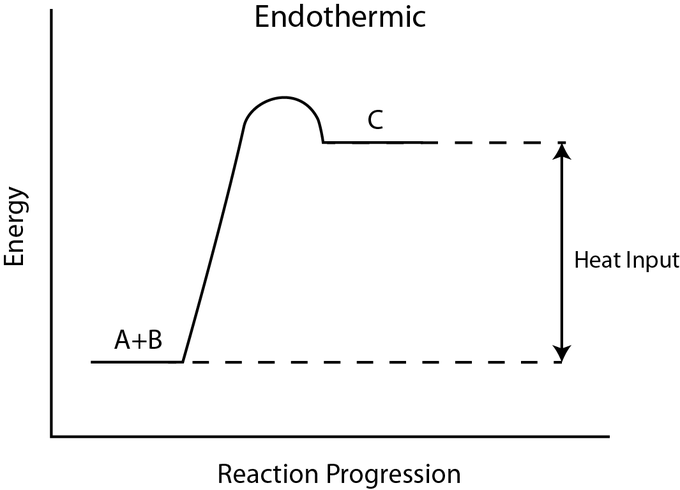
Energía de Calor
La fuente de la energía de activación necesaria para impulsar las reacciones es típicamente la energía térmica de los alrededores. La energía térmica (la energía de enlace total de los reactivos o productos en una reacción química) acelera el movimiento de las moléculas, aumentando la frecuencia y la fuerza con la que colisionan. También mueve ligeramente los átomos y enlaces dentro de la molécula, ayudándolos a alcanzar su estado de transición. Por esta razón, calentar un sistema provocará que los reactivos químicos dentro de ese sistema reaccionen con mayor frecuencia. Aumentar la presión sobre un sistema tiene el mismo efecto. Una vez que los reactivos hayan absorbido suficiente energía térmica de sus alrededores para alcanzar el estado de transición, la reacción continuará.
La energía de activación de una reacción particular determina la velocidad a la que procederá. Cuanto mayor sea la energía de activación, más lenta será la reacción química. El ejemplo de oxidación del hierro ilustra una reacción inherentemente lenta. Esta reacción se produce lentamente a lo largo del tiempo debido a su alto E A. Adicionalmente, la quema de muchos combustibles, que es fuertemente exergónico, se llevará a cabo a un ritmo insignificante a menos que su energía de activación sea superada por suficiente calor de una chispa. Sin embargo, una vez que comienzan a quemarse, las reacciones químicas liberan suficiente calor para continuar el proceso de combustión, suministrando la energía de activación para las moléculas de combustible circundantes.
Al igual que estas reacciones fuera de las células, la energía de activación para la mayoría de las reacciones celulares es demasiado alta para que la energía térmica la supere a velocidades eficientes. Es decir, para que las reacciones celulares importantes ocurran a velocidades significativas (número de reacciones por unidad de tiempo), se deben disminuir sus energías de activación; esto se conoce como catálisis. Esto es algo muy bueno en lo que respecta a las células vivas. Las macromoléculas importantes, como las proteínas, el ADN y el ARN, almacenan energía considerable y su descomposición es exergónica. Si las temperaturas celulares por sí solas proporcionaran suficiente energía térmica para que estas reacciones exergónicas superaran sus barreras de activación, los componentes esenciales de una célula se desintegrarían.
La ecuación de Arrhenius
Las ecuaciones de Arrhenius relacionan la velocidad de una reacción química con la magnitud de la energía de activación:
K=Ae E a /RT
donde
- k es el coeficiente de velocidad de reacción o constante
- A es el factor de frecuencia de la reacción. Se determina experimentalmente.
- R es la constante Universal Gas
- T es la temperatura en Kelvin
Puntos Clave
- Las reacciones requieren un aporte de energía para iniciar la reacción; esto se denomina energía de activación (E A).
- La energía de activación es la cantidad de energía requerida para alcanzar el estado de transición.
- La fuente de la energía de activación necesaria para impulsar las reacciones es típicamente la energía térmica de los alrededores.
- Para que las reacciones celulares ocurran lo suficientemente rápido en escalas de tiempo cortas, sus energías de activación son reducidas por moléculas llamadas catalizadores.
- Las enzimas son catalizadores.
Términos Clave
- energía de activación: La energía mínima requerida para que ocurra una reacción.
- catálisis: El aumento en la velocidad de una reacción química al disminuir su energía de activación.
- estado de transición: Un estado intermedio durante una reacción química que tiene una energía mayor que los reactivos o los productos.
Contribuciones y Atribuciones
- Colegio OpenStax, Biología. 16 de octubre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m44425/latest...ol11448/latest. Licencia: CC BY: Atribución
- Energía libre de Gibbs. Proporcionado por: Wikcionario. Ubicado en: http://en.wiktionary.org/wiki/Gibbs_free_energy. Licencia: CC BY-SA: Atribución-CompartirIgual
- reacción endergónica. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Endergonic%20Reaction. Licencia: CC BY-SA: Atribución-CompartirIgual
- reacción exergónica. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Exergonic%20Reaction. Licencia: CC BY-SA: Atribución-CompartirIgual
- OpenStax College, Potencial, Cinética, Libre y Energía de Activación. 16 de octubre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m44425/latest...e_06_03_03.jpg. Licencia: CC BY: Atribución
- OpenStax College, Potencial, Cinética, Libre y Energía de Activación. 16 de octubre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m44425/latest...05abcd_new.png. Licencia: CC BY: Atribución
- Colegio OpenStax, Biología. 16 de octubre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m44424/latest...ol11448/latest. Licencia: CC BY: Atribución
- primera ley de la termodinámica. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Primer%2... termodinámica. Licencia: CC BY-SA: Atribución-CompartirIgual
- trabajo. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/work. Licencia: CC BY-SA: Atribución-CompartirIgual
- OpenStax College, Potencial, Cinética, Libre y Energía de Activación. 16 de octubre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m44425/latest...e_06_03_03.jpg. Licencia: CC BY: Atribución
- OpenStax College, Potencial, Cinética, Libre y Energía de Activación. 16 de octubre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m44425/latest...05abcd_new.png. Licencia: CC BY: Atribución
- Límite del sistema. Proporcionado por: Wikipedia. Ubicado en: Commons.wikimedia.org/wiki/Fi... m_boundary.svg. Licencia: CC BY: Atribución
- Archivo:El cohete Soyuz TMA-05M lanza desde Baikonur 4.jpg. Proporcionado por: Archivo:El cohete Soyuz TMA-05M lanza desde Baikonur 4.jpg. Ubicado en: Commons.wikimedia.org/wiki/Fi... Baikonur_4.jpg. Licencia: CC BY-SA: Atribución-CompartirIgual
- Colegio OpenStax, Las leyes de la termodinámica. 16 de octubre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m44424/latest...e_06_02_01.jpg. Licencia: CC BY: Atribución
- Colegio OpenStax, Biología. 16 de octubre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m44424/latest...ol11448/latest. Licencia: CC BY: Atribución
- segunda ley de la termodinámica. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Second%... termodinámica. Licencia: CC BY-SA: Atribución-CompartirIgual
- entropía. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Entropy. Licencia: CC BY-SA: Atribución-CompartirIgual
- OpenStax College, Potencial, Cinética, Libre y Energía de Activación. 16 de octubre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m44425/latest...e_06_03_03.jpg. Licencia: CC BY: Atribución
- OpenStax College, Potencial, Cinética, Libre y Energía de Activación. 16 de octubre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m44425/latest...05abcd_new.png. Licencia: CC BY: Atribución
- Límite del sistema. Proporcionado por: Wikipedia. Ubicado en: Commons.wikimedia.org/wiki/Fi... m_boundary.svg. Licencia: CC BY: Atribución
- Archivo:El cohete Soyuz TMA-05M lanza desde Baikonur 4.jpg. Proporcionado por: Archivo:El cohete Soyuz TMA-05M lanza desde Baikonur 4.jpg. Ubicado en: Commons.wikimedia.org/wiki/Fi... Baikonur_4.jpg. Licencia: CC BY-SA: Atribución-CompartirIgual
- Colegio OpenStax, Las leyes de la termodinámica. 16 de octubre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m44424/latest...e_06_02_01.jpg. Licencia: CC BY: Atribución
- Colegio OpenStax, Las leyes de la termodinámica. 16 de octubre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m44424/latest...e_06_02_02.jpg. Licencia: CC BY: Atribución
- Colegio OpenStax, Biología. 16 de octubre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m44425/latest...ol11448/latest. Licencia: CC BY: Atribución
- catálisis. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/catálisis. Licencia: CC BY-SA: Atribución-CompartirIgual
- OpenStax, Biología. 29 de septiembre de 2015. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/contents/185cbf87-c72...f21b5eabd@9.87. Licencia: CC BY: Atribución
- energía de activación. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/activation_energy. Licencia: CC BY-SA: Atribución-CompartirIgual
- estado de transición. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/transition_state. Licencia: CC BY-SA: Atribución-CompartirIgual
- OpenStax College, Potencial, Cinética, Libre y Energía de Activación. 16 de octubre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m44425/latest...e_06_03_03.jpg. Licencia: CC BY: Atribución
- OpenStax College, Potencial, Cinética, Libre y Energía de Activación. 16 de octubre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m44425/latest...05abcd_new.png. Licencia: CC BY: Atribución
- Límite del sistema. Proporcionado por: Wikipedia. Ubicado en: Commons.wikimedia.org/wiki/Archivo:System_boundary.svg. Licencia: CC BY: Atribución
- Archivo:El cohete Soyuz TMA-05M lanza desde Baikonur 4.jpg. Proporcionado por: Archivo:El cohete Soyuz TMA-05M lanza desde Baikonur 4.jpg. Ubicado en: Commons.wikimedia.org/wiki/Fi... Baikonur_4.jpg. Licencia: CC BY-SA: Atribución-CompartirIgual
- Colegio OpenStax, Las leyes de la termodinámica. 16 de octubre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m44424/latest...e_06_02_01.jpg. Licencia: CC BY: Atribución
- Colegio OpenStax, Las leyes de la termodinámica. 16 de octubre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m44424/latest...e_06_02_02.jpg. Licencia: CC BY: Atribución
- Reacción Endotérmica. Proporcionado por: Wikimedia. Ubicado en: Commons.wikimedia.org/wiki/Fi... c_Reaction.png. Licencia: CC BY-SA: Atribución-CompartirIgual
- OpenStax College, Potencial, Cinética, Libre y Energía de Activación. 16 de octubre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m44425/latest...e_06_03_04.jpg. Licencia: CC BY: Atribución


