6.11: Enzimas - Control del Metabolismo a través de Regulación
- Page ID
- 57925
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
- Explicar el efecto de una enzima en el equilibrio químico
Control del Metabolismo a través de Regulación
Las necesidades y condiciones celulares varían de una célula a otra y cambian dentro de las células individuales a lo largo del tiempo. Por ejemplo, una célula estomacal requiere una cantidad de energía diferente a la de una célula cutánea, célula de almacenamiento de grasa, célula sanguínea o célula nerviosa. La misma célula estomacal también puede necesitar más energía inmediatamente después de una comida y menos energía entre comidas.
La función de una célula está encapsulada por las reacciones químicas que puede llevar a cabo. Las enzimas disminuyen las energías de activación de las reacciones químicas; en las células, promueven aquellas reacciones que son específicas de la función de la célula. Debido a que las enzimas determinan en última instancia qué reacciones químicas puede llevar a cabo una célula y la velocidad a la que pueden proceder, son claves para la funcionalidad celular.
Inhibición competitiva y no competitiva
La célula utiliza moléculas específicas para regular enzimas con el fin de promover o inhibir ciertas reacciones químicas. En ocasiones es necesario inhibir una enzima para reducir una velocidad de reacción, y hay más de una forma de que se produzca esta inhibición. En la inhibición competitiva, una molécula inhibidora es lo suficientemente similar a un sustrato que puede unirse al sitio activo de la enzima para evitar que se una al sustrato. “Compite” con el sustrato para unirse a la enzima.
En la inhibición no competitiva, una molécula inhibidora se une a la enzima en una ubicación distinta del sitio activo (un sitio alostérico). El sustrato aún puede unirse a la enzima, pero el inhibidor cambia la forma de la enzima por lo que ya no está en posición óptima para catalizar la reacción.

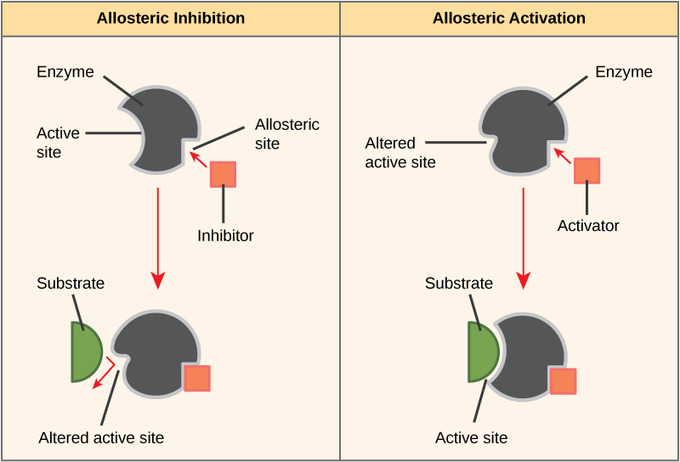
Inhibición y activación alostérica
En la inhibición alostérica no competitiva, las moléculas inhibidoras se unen a una enzima en el sitio alostérico. Su unión induce un cambio conformacional que reduce la afinidad del sitio activo de la enzima por su sustrato. La unión de este inhibidor alostérico cambia la conformación de la enzima y su sitio activo, por lo que el sustrato no es capaz de unirse. Esto evita que la enzima disminuya la energía de activación de la reacción, y la velocidad de reacción se reduce.
Sin embargo, los inhibidores alostéricos no son las únicas moléculas que se unen a sitios alostéricos. Los activadores alostéricos pueden aumentar las velocidades de reacción. Se unen a un sitio alostérico que induce un cambio conformacional que aumenta la afinidad del sitio activo de la enzima por su sustrato. Esto aumenta la velocidad de reacción.
Cofactores y coenzimas
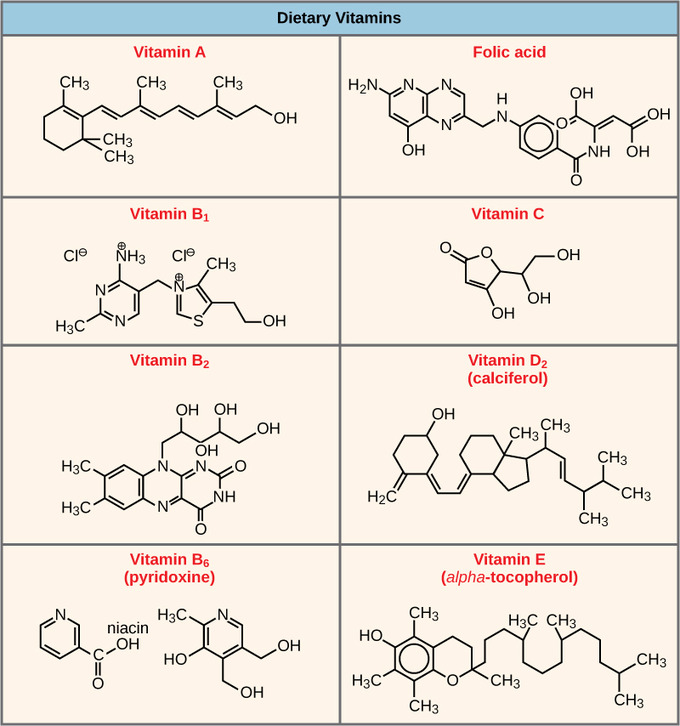
Muchas enzimas solo funcionan si se unen a moléculas colaboradoras no proteicas llamadas cofactores y coenzimas. La unión a estas moléculas promueve una conformación y función óptimas para sus respectivas enzimas. Estas moléculas se unen temporalmente a través de enlaces iónicos o de hidrógeno o permanentemente a través de enlaces covalentes más fuertes.
Los cofactores son iones inorgánicos como el hierro (Fe 2+) y el magnesio (Mg 2+). Por ejemplo, la ADN polimerasa requiere un ion zinc (Zn 2+) para construir moléculas de ADN. Las coenzimas son moléculas colaboradoras orgánicas con una estructura atómica básica compuesta por carbono e hidrógeno. Las coenzimas más comunes son las vitaminas dietéticas. La vitamina C es una coenzima para múltiples enzimas que participan en la construcción del colágeno, un componente importante del tejido conectivo. La piruvato deshidrogenasa es un complejo de varias enzimas que requiere un cofactor y cinco coenzimas orgánicas diferentes para catalizar su reacción química. La disponibilidad de diversos cofactores y coenzimas regula la función enzimática.
Compartimentación de Enzimas
En las células eucariotas, las moléculas como las enzimas suelen compartimentarse en diferentes orgánulos. Esta organización contribuye a la regulación enzimática porque ciertos procesos celulares están contenidos en orgánulos separados. Por ejemplo, las enzimas involucradas en las etapas posteriores de la respiración celular realizan reacciones exclusivamente en las mitocondrias. Las enzimas involucradas en la digestión de desechos celulares y materiales extraños se localizan dentro de los lisosomas.
Inhibición de retroalimentación en vías metabólicas
La inhibición de retroalimentación es cuando se usa un producto de reacción para regular su propia producción adicional. Las células han evolucionado para utilizar la inhibición por retroalimentación para regular la actividad enzimática en el metabolismo, mediante el uso de los productos de las reacciones enzimáticas para inhibir la actividad enzimática adicional. Las reacciones metabólicas, como los procesos anabólicos y catabólicos, deben proceder de acuerdo a las demandas de la célula. Con el fin de mantener el equilibrio químico y satisfacer las necesidades de la célula, algunos productos metabólicos inhiben las enzimas en la vía química mientras que algunos reactivos las activan.
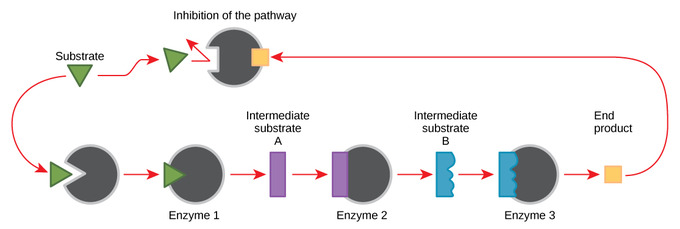
La producción de aminoácidos y nucleótidos se controla a través de la inhibición por retroalimentación. Para un ejemplo de inhibición de retroalimentación, considere ATP. Es producto del metabolismo catabólico del azúcar (respiración celular), pero también actúa como regulador alostérico para las mismas enzimas que lo produjeron. El ATP es una molécula inestable que puede disociarse espontáneamente en ADP; si hubiera demasiado ATP presente, la mayor parte se desperdiciaría. Esta inhibición de retroalimentación impide la producción de ATP adicional si ya es abundante. Sin embargo, mientras que el ATP es un inhibidor, el ADP es un activador alostérico. Cuando los niveles de ADP son altos en comparación con los niveles de ATP, el ADP desencadena el catabolismo del azúcar para producir más ATP.
Puntos Clave
- En la inhibición competitiva, una molécula inhibidora compite con un sustrato al unirse al sitio activo de la enzima para que el sustrato se bloquee.
- En la inhibición no competitiva (también conocida como inhibición alostérica), un inhibidor se une a un sitio alostérico; el sustrato aún puede unirse a la enzima, pero la enzima ya no está en posición óptima para catalizar la reacción.
- Los inhibidores alostéricos inducen un cambio conformacional que cambia la forma del sitio activo y reduce la afinidad del sitio activo de la enzima por su sustrato.
- Los activadores alostéricos inducen un cambio conformacional que cambia la forma del sitio activo y aumenta la afinidad del sitio activo de la enzima por su sustrato.
- La inhibición de retroalimentación implica el uso de un producto de reacción para regular su propia producción posterior.
- Los cofactores inorgánicos y las coenzimas orgánicas promueven la orientación y función óptimas de las enzimas.
- Las vitaminas actúan como coenzimas (o precursores de las coenzimas) y son necesarias para que las enzimas funcionen.
Términos Clave
- coenzima: Una molécula orgánica que es necesaria para que una enzima funcione.
- Sitio alostérico: Un sitio distinto del sitio activo en una enzima.
- cofactor: Una molécula inorgánica que es necesaria para que una enzima funcione.
Contribuciones y Atribuciones
- Colegio OpenStax, Biología. 16 de octubre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m44429/latest/?collection=col11448/latest. Licencia: CC BY: Atribución
- sitio activo. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Active%20site. Licencia: CC BY-SA: Atribución-CompartirIgual
- sustrato. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/substrate. Licencia: CC BY-SA: Atribución-CompartirIgual
- ajuste inducido. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Induced%20Fit. Licencia: CC BY-SA: Atribución-CompartirIgual
- Colegio OpenStax, Enzimas. 16 de octubre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m44429/latest/Figure_06_05_03.jpg. Licencia: CC BY: Atribución
- Colegio OpenStax, Biología. 16 de octubre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m44429/latest/?collection=col11448/latest. Licencia: CC BY: Atribución
- Sin límites. Proporcionado por: Boundless Learning. Ubicada en: www.boundless.com//biología/definición/sitio-alostérico. Licencia: CC BY-SA: Atribución-CompartirIgual
- cofactor. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/cofactor. Licencia: CC BY-SA: Atribución-CompartirIgual
- coenzima. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/coenzima. Licencia: CC BY-SA: Atribución-CompartirIgual
- Colegio OpenStax, Enzimas. 16 de octubre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m44429/latest/Figure_06_05_03.jpg. Licencia: CC BY: Atribución
- Colegio OpenStax, Enzimas. 16 de octubre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m44429/latest/Figure_06_05_04.jpg. Licencia: CC BY: Atribución
- Colegio OpenStax, Enzimas. 16 de octubre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m44429/latest/Figure_06_05_06.jpg. Licencia: CC BY: Atribución
- Colegio OpenStax, Enzimas. 16 de octubre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m44429/latest/Figure_06_05_05.jpg. Licencia: CC BY: Atribución
- Colegio OpenStax, Enzimas. 16 de octubre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m44429/latest/Figure_06_05_07.jpg. Licencia: CC BY: Atribución


