2.3: Agua
- Page ID
- 58485

¿Alguna vez te has preguntado por qué los científicos pasan tiempo buscando agua en otros planetas? Es porque el agua es esencial para la vida; incluso las huellas diminutas de ella en otro planeta pueden indicar que la vida podría o existió en ese planeta. El agua es una de las moléculas más abundantes en las células vivas y la más crítica para la vida tal como la conocemos. Aproximadamente el 60—70 por ciento de tu cuerpo está compuesto por agua. Sin ella, la vida simplemente no existiría.
El agua es polar
Los átomos de hidrógeno y oxígeno dentro de las moléculas de agua forman enlaces covalentes polares. Los electrones compartidos pasan más tiempo asociados con el átomo de oxígeno que con los átomos de hidrógeno. No hay carga general a una molécula de agua, pero hay una ligera carga positiva en cada átomo de hidrógeno y una ligera carga negativa en el átomo de oxígeno. Debido a estas cargas, los átomos de hidrógeno ligeramente positivos se repelen entre sí y forman la forma única. Cada molécula de agua atrae a otras moléculas de agua debido a las cargas positivas y negativas en las diferentes partes de la molécula.
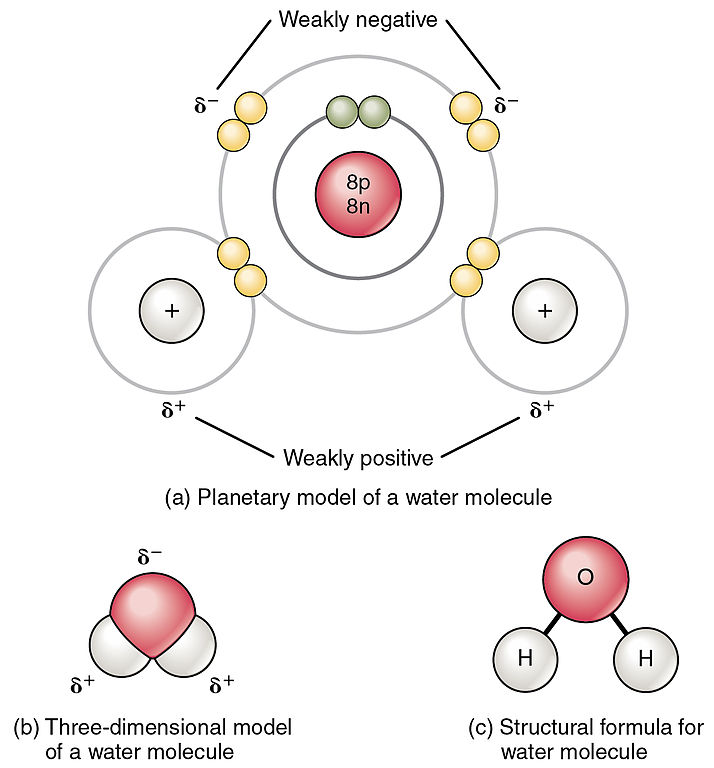
El agua también atrae a otras moléculas polares (como los azúcares), formando enlaces de hidrógeno. Cuando una sustancia forma fácilmente enlaces de hidrógeno con el agua, puede disolverse en agua y se la conoce como hidrófila (“amante del agua”). Los enlaces de hidrógeno no se forman fácilmente con sustancias no polares como aceites y grasas (Figura\(\PageIndex{3}\)). Estos compuestos no polares son hidrófobos (“temerosos del agua”) y no se disolverán en el agua.

El agua estabiliza la temperatura
Los enlaces de hidrógeno en el agua le permiten absorber y liberar energía térmica más lentamente que muchas otras sustancias. La temperatura es una medida del movimiento (energía cinética) de las moléculas. A medida que aumenta el movimiento, la energía es mayor y por lo tanto la temperatura es mayor. El agua absorbe una gran cantidad de energía antes de que suba su temperatura. El aumento de la energía interrumpe los enlaces de hidrógeno entre las moléculas de agua. Debido a que estos enlaces se pueden crear e interrumpir rápidamente, el agua absorbe un aumento en la energía y los cambios de temperatura solo mínimamente. Esto significa que el agua modera los cambios de temperatura dentro de los organismos y en sus ambientes. A medida que la entrada de energía continúa, el equilibrio entre la formación de enlaces de hidrógeno y la destrucción oscila hacia el lado de la destrucción. Se rompen más lazos de los que se forman. Este proceso da como resultado la liberación de moléculas de agua individuales en la superficie del líquido (como un cuerpo de agua, las hojas de una planta o la piel de un organismo) en un proceso llamado evaporación. La evaporación del sudor, que es 90 por ciento de agua, permite el enfriamiento de un organismo, porque romper los enlaces de hidrógeno requiere un aporte de energía y quita el calor del cuerpo.
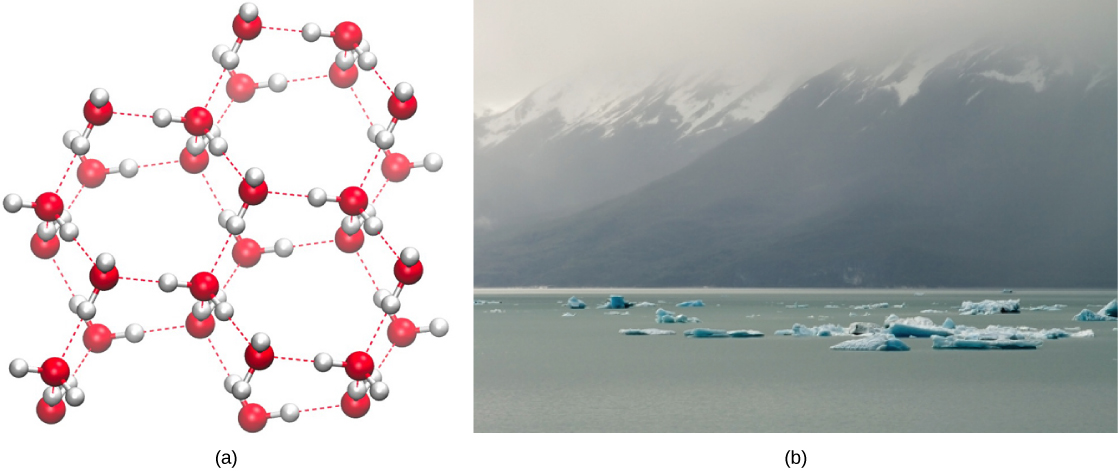
Por el contrario, a medida que el movimiento molecular disminuye y las temperaturas disminuyen, hay menos energía presente para romper los enlaces de hidrógeno entre las moléculas de agua. Estos enlaces permanecen intactos y comienzan a formar una estructura rígida similar a una celosía (por ejemplo, hielo) (Figura\(\PageIndex{4}\) a). Cuando se congela, el hielo es menos denso que el agua líquida (las moléculas están más separadas). Esto significa que el hielo flota en la superficie de un cuerpo de agua (Figura\(\PageIndex{4}\) b). En lagos, estanques y océanos, se formará hielo en la superficie del agua, creando una barrera aislante para proteger la vida animal y vegetal debajo de la congelación en el agua. Si esto no sucediera, las plantas y animales que viven en el agua se congelarían en un bloque de hielo y no podrían moverse libremente, haciendo que la vida en temperaturas frías sea difícil o imposible.
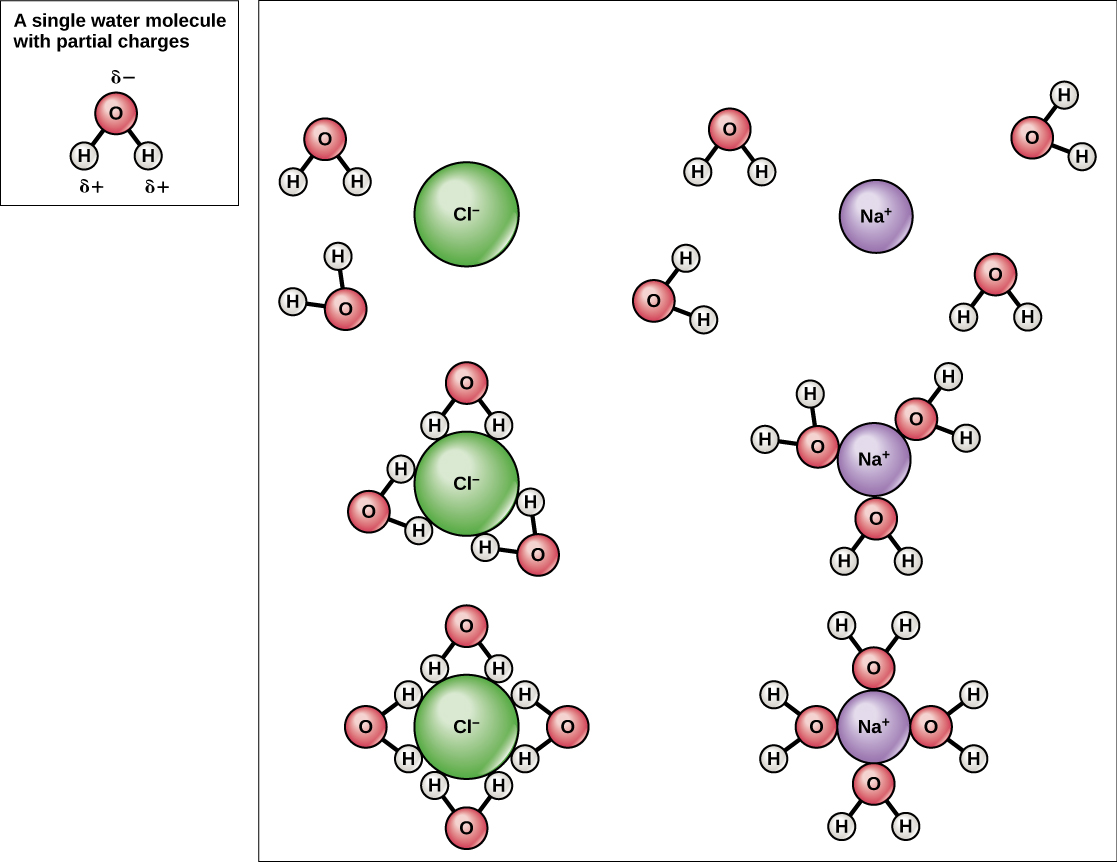
El agua es un excelente solvente
Debido a que el agua es polar, con ligeras cargas positivas y negativas, los compuestos iónicos y las moléculas polares pueden disolverse fácilmente en ella. El agua es, por lo tanto, lo que se denomina disolvente, una sustancia capaz de disolver otra sustancia. Las partículas cargadas formarán enlaces de hidrógeno con una capa circundante de moléculas de agua. Esto se conoce como una esfera de hidratación y sirve para mantener las partículas separadas o dispersas en el agua. En el caso de la sal de mesa (NaCl) mezclada en agua (Figura\(\PageIndex{5}\)), los iones sodio y cloruro se separan, o se disocian, en el agua, y se forman esferas de hidratación alrededor de los iones. Un ion de sodio cargado positivamente está rodeado por las cargas parcialmente negativas de los átomos de oxígeno en las moléculas de agua. Un ion cloruro cargado negativamente está rodeado por las cargas parcialmente positivas de los átomos de hidrógeno en las moléculas de agua. Estas esferas de hidratación también se denominan conchas de hidratación. La polaridad de la molécula de agua la convierte en un solvente efectivo y es importante en sus múltiples roles en los sistemas vivos.
El agua es cohesiva
¿Alguna vez has llenado un vaso de agua hasta la parte superior y luego lentamente agregaste algunas gotas más? Antes de que se desborde, el agua en realidad forma una forma de cúpula sobre el borde del vidrio. Esta agua puede permanecer por encima del cristal debido a la propiedad de cohesión. En cohesión, las moléculas de agua son atraídas entre sí (debido a los enlaces de hidrógeno), manteniendo las moléculas juntas en la interfaz líquido-aire (gas), aunque no hay más espacio en el vidrio. La cohesión da lugar a la tensión superficial, la capacidad de una sustancia para soportar la ruptura cuando se coloca bajo tensión o tensión. Cuando se deja caer un pequeño trozo de papel sobre una gotita de agua, el papel flota sobre la gotita de agua, aunque el objeto es más denso (más pesado) que el agua. Esto ocurre debido a la tensión superficial que crean las moléculas de agua. La cohesión y la tensión superficial mantienen intactas las moléculas de agua y el artículo flotando en la parte superior. Incluso es posible “flotar” una aguja de acero sobre un vaso de agua si la colocas suavemente, sin romper la tensión superficial (Figura\(\PageIndex{6}\)).

Estas fuerzas cohesivas también están relacionadas con la propiedad de adhesión del agua, o la atracción entre las moléculas de agua y otras moléculas. Esto se observa cuando el agua “sube” por una pajita colocada en un vaso de agua. Notarás que el agua parece estar más alta en los lados de la paja que en el medio. Esto se debe a que las moléculas de agua son atraídas por la paja y por lo tanto se adhieren a ella.
Las fuerzas cohesivas y adhesivas son importantes para mantener la vida útil. Por ejemplo, debido a estas fuerzas, el agua puede fluir desde las raíces hasta la parte superior de las plantas para alimentar a la planta.
Consulta\(\PageIndex{1}\)
Referencias
A menos que se indique lo contrario, las imágenes de esta página están bajo licencia CC-BY 4.0 de OpenStax.
OpenStax, Conceptos de Biología. OpenStax CNX. marzo 22, 2017 https://cnx.org/contents/s8Hh0oOc@9....0BfSb7@4/Water

