6.5: Transporte Pasivo - Osmosis
- Page ID
- 58388
La ósmosis es la difusión del agua a través de una membrana semipermeable de acuerdo con el gradiente de concentración del agua a través de la membrana. Mientras que la difusión transporta material a través de las membranas y dentro de las células, la ósmosis transporta solo agua a través de una membrana y la membrana limita la difusión de solutos en el agua. La ósmosis es un caso especial de difusión. El agua, al igual que otras sustancias, pasa de un área de mayor concentración a una de menor concentración. Imagínese un vaso de precipitados con una membrana semipermeable, separando los dos lados o mitades (Figura\(\PageIndex{1}\)). A ambos lados de la membrana, el nivel del agua es el mismo, pero hay diferentes concentraciones a cada lado de una sustancia disuelta, o soluto, que no puede atravesar la membrana. Si el volumen del agua es el mismo, pero las concentraciones de soluto son diferentes, entonces también hay diferentes concentraciones de agua, el disolvente, a cada lado de la membrana.
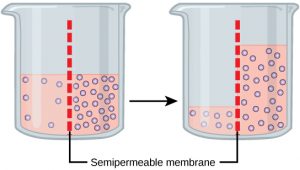
Un principio de difusión es que las moléculas se mueven alrededor y se esparcirán uniformemente por todo el medio si pueden. Sin embargo, solo el material capaz de atravesar la membrana se difundirá a través de ella. En este ejemplo, el soluto no puede difundirse a través de la membrana, pero el agua sí. El agua tiene un gradiente de concentración en este sistema. Por lo tanto, el agua se difundirá por su gradiente de concentración, cruzando la membrana hacia el lado donde está menos concentrada. Esta difusión del agua a través de la membrana —ósmosis — continuará hasta que el gradiente de concentración del agua llegue a cero. La ósmosis procede constantemente en los sistemas vivos.
Tonicidad
La tonicidad describe la cantidad de soluto en una solución. La medida de la tonicidad de una solución, o la cantidad total de solutos disueltos en una cantidad específica de solución, se llama su osmolaridad. Tres términos —hipotónico, isotónico e hipertónico— se utilizan para relacionar la osmolaridad de una célula con la osmolaridad del líquido extracelular que contiene las células. Los tres términos son una comparación entre dos soluciones diferentes (por ejemplo, dentro de una celda en comparación con fuera de la celda).
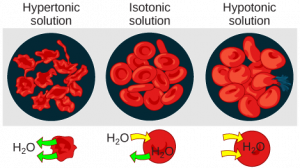
En una solución hipotónica, como el agua del grifo, el fluido extracelular tiene una concentración menor de solutos que el fluido dentro de la célula, y el agua ingresa a la célula. (En los sistemas vivos, el punto de referencia es siempre el citoplasma, por lo que el prefijo hipo — significa que el fluido extracelular tiene una menor concentración de solutos, o una osmolaridad menor, que el citoplasma celular.) También significa que el fluido extracelular tiene una mayor concentración de agua que la célula. En esta situación, el agua seguirá su gradiente de concentración y entrará en la celda. Esto puede hacer que una célula animal estalle o se lise.
En una solución hipertónica (el prefijo hiper — se refiere al fluido extracelular que tiene una mayor concentración de solutos que el citoplasma de la célula), el fluido contiene menos agua que la célula, como el agua de mar. Debido a que la célula tiene una menor concentración de solutos, el agua saldrá de la célula. En efecto, el soluto está sacando el agua de la celda. Esto puede hacer que una célula animal se marchite o se crene.
En una solución isotónica, el fluido extracelular tiene la misma osmolaridad que la célula. Si la concentración de solutos de la célula coincide con la del fluido extracelular, no habrá movimiento neto de agua dentro o fuera de la célula. La célula conservará su aspecto “normal”. Las células sanguíneas en soluciones hipertónicas, isotónicas e hipotónicas adquieren apariencias características (Figura\(\PageIndex{2}\)).
Recuerde que los tres términos son comparaciones entre dos soluciones (es decir, dentro y fuera de la celda). Una solución no puede ser hipotónica, eso sería como decir que Bob es más alto. Eso no tiene sentido — hay que decir que Bob es más alto que Mike. Se puede decir que la solución dentro de la célula es hipotónica a la solución fuera de la célula. Eso también significa que la solución exterior es hipertónica a la solución interior (al igual que Mike sería más corto que Bob).
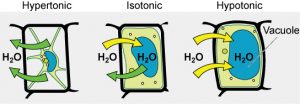
Algunos organismos, como plantas, hongos, bacterias y algunos protistas, tienen paredes celulares que rodean la membrana plasmática y previenen la lisis celular. La membrana plasmática sólo puede expandirse hasta el límite de la pared celular, por lo que la célula no lisará. De hecho, el citoplasma en las plantas es siempre ligeramente hipertónico en comparación con el ambiente celular, y el agua siempre ingresará a la célula vegetal si hay agua disponible. Esta afluencia de agua produce presión de turgencia, que endurece las paredes celulares de la planta (Figura\(\PageIndex{3}\)). En plantas no leñosas, la presión de turgencia apoya a la planta. Si las células vegetales se vuelven hipertónicas, como ocurre en la sequía o si una planta no se riega adecuadamente, el agua saldrá de la célula. Las plantas pierden presión de turgencia en esta condición y se marchitan.
Consulta\(\PageIndex{1}\)
Consulta\(\PageIndex{2}\)
Consulta\(\PageIndex{3}\)
Referencias
A menos que se indique lo contrario, las imágenes de esta página están bajo licencia CC-BY 4.0 de OpenStax.
Texto adaptado de: OpenStax, Conceptos de Biología. OpenStax CNX. mayo 18, 2016 http://cnx.org/contents/b3c1e1d2-839...9a8aafbdd@9.10

