5.4: Regulación de la Transcripción
- Page ID
- 53548
Los procesos descritos anteriormente son requeridos siempre que se transcriba algún gen. Pero qué determina qué genes se transcriben en un momento dado. ¿Cuáles son los interruptores moleculares que activan o desactivan la transcripción? Aunque hay libros completos escritos sobre este tema, el mecanismo básico por el cual se regula la transcripción depende de interacciones altamente específicas entre las proteínas reguladoras de la transcripción y las secuencias reguladoras en el ADN.
Sabemos que los promotores indican dónde comienza la transcripción, pero ¿qué determina que se transcriba un gen dado? Además de las secuencias promotoras requeridas para el inicio de la transcripción, los genes tienen secuencias reguladoras adicionales (secuencias de ADN en la misma molécula de ADN que el gen) que controlan cuándo se transcribe un gen. Las secuencias reguladoras están unidas fuertemente y específicamente por reguladores transcripcionales, proteínas que pueden reconocer secuencias de ADN y unirse a ellas. La unión de tales proteínas al ADN puede regular la transcripción previniendo o aumentando la transcripción de un promotor particular.
Regulación en Procariotas
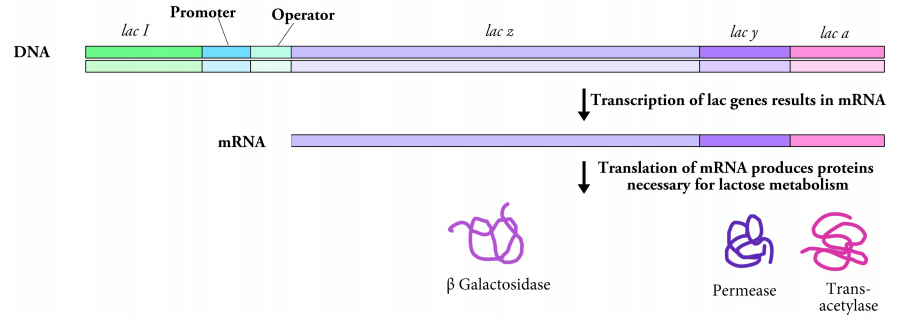
Consideremos primero un ejemplo de procariotas. En las bacterias, los genes a menudo se agrupan en grupos, de tal manera que los genes que necesitan expresarse al mismo tiempo están uno al lado del otro y todos ellos son controlados como una sola unidad por el mismo promotor. El operón lac, mostrado en la Figura 5.4.2, es uno de esos grupos de genes que codifican proteínas necesarias para la captación y descomposición de la lactosa de azúcar. Los tres genes del operón lac, lac z, lac y lac a están controlados por un solo promotor.
Las células bacterianas generalmente prefieren usar la glucosa para sus necesidades energéticas, pero si la glucosa no está disponible, y la lactosa está presente, la bacteria tomará lactosa y la descompondrá para obtener energía. Dado que las proteínas para tomar y descomponer la lactosa solo son necesarias cuando la glucosa está ausente y la lactosa está disponible, las células bacterianas necesitan una forma de expresar los genes del operón lac solo bajo esas condiciones. En momentos en que la lactosa está ausente, las células no necesitan expresar estos genes.
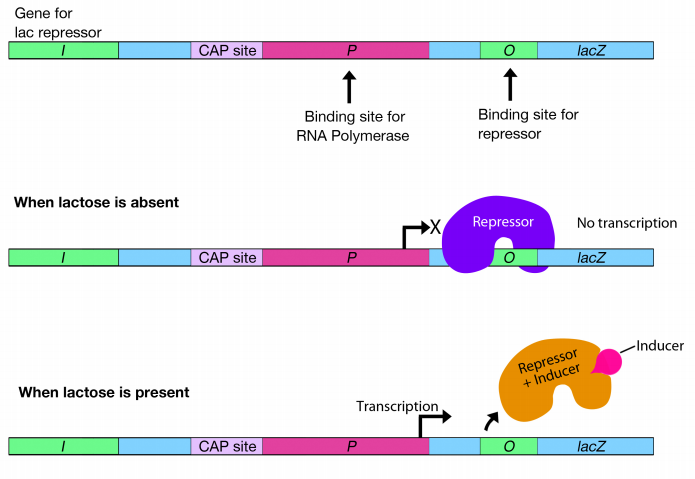
¿Cómo logran esto las bacterias? La transcripción del grupo lac de genes está controlada principalmente por una proteína represora que se une a una región del ADN justo aguas abajo de la secuencia -10 del promotor lac. Recordemos que el promotor es donde la ARN polimerasa debe unirse para comenzar la transcripción. El lugar donde se une el represor se llama operador (etiquetado O en la figura). Cuando el represor está unido en esta posición, bloquea físicamente que la ARN polimerasa transcriba los genes, así como un vehículo bloqueando tu entrada te impediría sacar.
Obviamente, si quieres irte, el vehículo que está bloqueando tu camino debe ser removido. De igual manera, para que se produzca la transcripción, el represor debe ser removido del operador para despejar la ruta de la ARN polimerasa. ¿Cómo se elimina el represor?
Cuando el azúcar lactosa está presente, se une al represor, cambiando su conformación para que ya no se una al operador. Cuando el represor ya no está unido al operador, se elimina el “bloqueo de carretera” frente a la ARN polimerasa, permitiendo la transcripción de los genes del operón lac.
Debido a que la unión de la lactosa induce la expresión de los genes en el operón lac, la lactosa se denomina inductor. (Técnicamente, el inductor es la alolactosa, una molécula elaborada a partir de lactosa por la célula, pero el principio es el mismo.)
Lo que hace de este un sistema de control especialmente efectivo es que los genes del operón lac codifican proteínas que descomponen la lactosa. Encender estos genes requiere que la lactosa esté presente. Una vez que se descompone la lactosa, el represor se une una vez más al operador y los genes lac ya no se expresan. Esto permite que los genes se expresen solo cuando son necesarios.
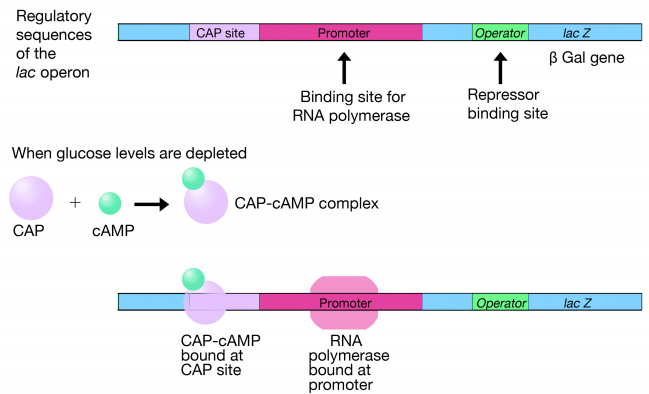
Pero, ¿cómo afectan los niveles de glucosa a la expresión de los genes lac? Señalamos anteriormente que si estuviera presente glucosa, no se utilizaría lactosa. Un segundo nivel de control es ejercido por una proteína llamada CAP que se une a un sitio adyacente al promotor y recluta ARN polimerasa para unirse al promotor lac. Cuando se agota la glucosa, hay un aumento en los niveles de AMPc que se une a la PAC. El complejo CAP cAMP se une luego al sitio CAP, como se muestra en la Figura 5.4.3. La combinación de unión a CAP y el represor lac que se disocia del operador cuando los niveles de lactosa son altos asegura altos niveles de transcripción del operón lac justo cuando más se necesita. La unión a la proteína CAP puede pensarse como una luz verde para la ARN polimerasa, mientras que la eliminación del represor es como el levantamiento de una barricada frente a ella. Cuando se cumplen ambas condiciones, la ARN polimerasa transcribe los genes aguas abajo.
El operón lac que acabamos de describir es un conjunto de genes que se expresan únicamente bajo las condiciones específicas de agotamiento de glucosa y disponibilidad de lactosa. Otros genes pueden expresarse a menos que se cumpla una condición particular. Un ejemplo de ello es el operón trp en células bacterianas, que codifica enzimas necesarias para la síntesis del aminoácido triptófano. Estos genes se expresan en todo momento, excepto cuando el triptófano está disponible en los alrededores de la célula. Esto significa que se debe evitar que estos genes se expresen en presencia de triptófano. Esto se logra al tener una proteína represora que se unirá al operador solo en presencia de triptófano.
Regulación en eucariotas
La transcripción en eucariotas también está regulada por la unión de proteínas a secuencias de ADN específicas, pero con algunas diferencias con respecto a los esquemas simples descritos anteriormente. Para la mayoría de los genes eucariotas, los factores generales de transcripción y la ARN polimerasa (es decir, el complejo de transcripción basal) son necesarios, pero no suficientes, para altos niveles de transcripción.
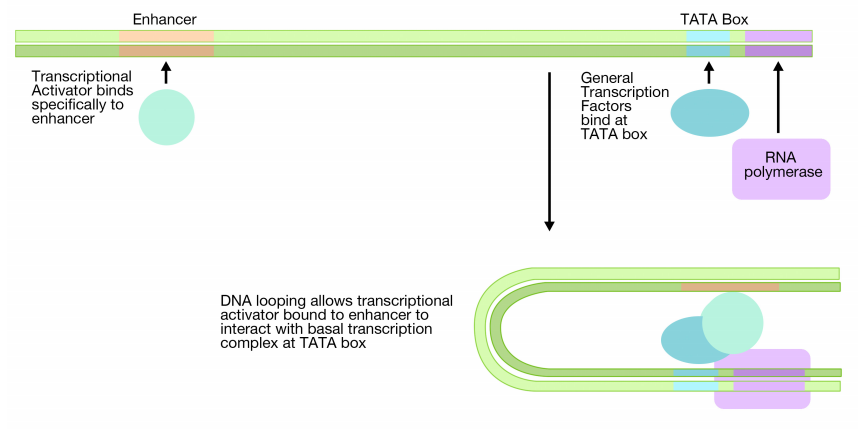
En eucariotas, se necesitan secuencias reguladoras adicionales llamadas potenciadores y las proteínas que se unen a los potenciadores para lograr altos niveles de transcripción. Los potenciadores son secuencias de ADN que regulan la transcripción de genes. A diferencia de las secuencias reguladoras procariotas, los potenciadores no necesitan estar al lado del gen que controlan. A menudo están a muchas kilobases de distancia en el ADN. Como su nombre indica, los potenciadores pueden potenciar (aumentar) la transcripción de un gen en particular.
¿Cómo puede una secuencia de ADN lejos del gen que se transcribe afectar el nivel de su transcripción?
Los potenciadores funcionan uniendo proteínas (activadores transcripcionales) que pueden, a su vez, interactuar con las proteínas unidas al promotor. La región potenciadora del ADN, con su (los) activador (es) transcripcional (es) asociado (es) puede (n) entrar en contacto con el complejo de transcripción basal que se une en una caja TATA distante mediante un ciclo del ADN (página anterior). Esto permite que la proteína unida al potenciador haga contacto con las proteínas en el complejo de transcripción basal.
Una forma en que el activador transcripcional unido al potenciador aumenta la transcripción desde un promotor distante es que aumenta la frecuencia y eficiencia con la que se forma el complejo de transcripción basal en el promotor.
Otro mecanismo por el cual las proteínas unidas al potenciador pueden afectar la transcripción es reclutando al promotor otras proteínas que puedan modificar la estructura de la cromatina en esa región. Como señalamos anteriormente, en los eucariotas, el ADN se empaqueta con proteínas para formar la cromatina. Cuando el ADN está estrechamente asociado con estas proteínas, es difícil acceder para su transcripción. Entonces, las proteínas que pueden hacer que el ADN sea más accesible a la maquinaria de transcripción también pueden desempeñar un papel en la medida en que se produce la transcripción.
Además de los potenciadores, también hay secuencias reguladoras negativas llamadas silenciadores. Dichas secuencias reguladoras se unen a proteínas represoras transcripcionales. Los activadores y represores transcripcionales son proteínas modulares, tienen una parte que se une al ADN y una parte que activa o reprime la transcripción al interactuar con el complejo de transcripción basal.


