2.2: Crecimiento y Reproducción Bacteriana
- Page ID
- 57342
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Flagelos y motilidad
- flagelos monotricos - la célula bacteriana tiene un solo flagelo
- flagelos periricos - la célula bacteriana tiene varios flagelos que se encuentran en varios sitios en la superficie celular (por ejemplo, E. coli)
La motilidad se debe a la presencia de uno o más flagelos.
- en bacterias flageladas peritricas los flagelos rotan independientemente unos de otros
- 95% del tiempo que los flagelos giran en sentido antihorario
- 5% de las veces los flagelos cambian de dirección y giran en sentido horario
- Cuando todos los flagelos giran en sentido contrario a las agujas del reloj, los flagelos se agrupan y las bacterias viajan en línea recta (es decir, nada)
- Cuando un flagelo cambia de dirección, el haz se desasocia y la bacteria cae
- resultados alternativos de natación y volteo en una caminata aleatoria tridimensional
- Los quimioatrayentes y repelentes pueden interactuar con proteínas receptoras en la envoltura celular, lo que a su vez influye en la velocidad de volteo cuando la célula se mueve en una dirección dada
Crecimiento y Reproducción
Los requisitos esenciales para el crecimiento incluyen:
- suministro de nutrientes adecuados
- fuente de energía
- agua
- temperatura apropiada
- pH apropiado
- niveles apropiados (o ausencia) de oxígeno
Nutrientes
Las células necesitan una fuente de:
- carbono
- nitrógeno
- fósforo
- azufre
- otros materiales traza
Aunque una bacteria dada normalmente usa una gama limitada de compuestos, las bacterias como grupo pueden utilizar una amplia gama de compuestos como nutrientes:
- azúcares e hidratos de carbono
- Aminoácidos
- esteroles
- alcoholes
- hidrocarburos
- metano
- sales inorgánicas
- dióxido de carbono
Energía
Se necesita energía para
- reacciones químicas esenciales
- absorción de nutrientes
- motilidad flagelar
Bacterias fototróficas vs quimiotrofas
- fototrófico - energía derivada de la fuente de luz
- quimiotrófica - la energía se obtiene procesando productos químicos del medio ambiente
Agua
- El 80% de la masa de bacterias típicas es agua
- Se necesita agua para el crecimiento y la reproducción
- La desización (extrema falta de agua) es tolerada en diferentes grados por diferentes bacterias
Temperatura
- El crecimiento avanza más rápidamente a la temperatura de crecimiento óptima para una bacteria particular (y disminuye a medida que la temperatura se eleva o disminuye desde este óptimo)
- Para cualquier bacteria, hay una temperatura mínima y máxima más allá de la cual no se soporta el crecimiento
Bacterias termófilas
- la temperatura óptima de crecimiento es >45°C
- ocurren en pilotes de compost, aguas termales y respiraderos hidrotermales del fondo oceánico
- El pirodiccio tiene una temperatura de crecimiento óptima de 105°C
Bacterias mesofílicas
- temperaturas óptimas de crecimiento entre 15 y 45°C
- viven en una amplia gama de hábitats
- ya que el cuerpo humano es 37-42°C, las bacterias patógenas humanas son mesófilos
Bacterias psicrófilas
- óptimo a 15°C o menos
- temperatura mínima de 0°C, o menos
- temperatura máxima de 20°C
- ocurren en mares polares
pH
- la mayoría de las bacterias crecen óptimamente cerca de pH neutro (7.0)
- los acidófilos tienen un pH óptimo con es más ácido (Thermoplasma acidophilum, que se encuentra en aguas termales, prefiere pH 0.8-3, y no crecerá a pH neutro)
- los alcalófilos tienen un óptimo en rangos de pH más altos (alcalinos) (Exiguobacterium aurantiacum, que se encuentra en lagos alcalinos naturales, prefiere pH 8.5-9.5)
Oxígeno
- bacterias que deben tener oxígeno para el crecimiento se denominan aerobios obligados
- bacterias que pueden crecer solo en ausencia de oxígeno se conocen como anaerobios obligados (por ejemplo, ambiente aislado de la atmósfera; por ejemplo, lodo de río, y dentro de los intestinos, por ejemplo)
- bacterias que normalmente crecen en presencia de oxígeno, pero que pueden llegar a crecer en su ausencia, se denominan anaerobios faculativos
- a la inversa, las bacterias que normalmente crecen anaeróbicamente, pero que pueden llegar a crecer en presencia de oxígeno, se conocen como aeróbicos faculativos
Iones inorgánicos
Todas las bacterias necesitan bajas concentraciones de ciertos iones inorgánicos para funcionar, p.
- hierro para citocromos (metabolismo energético) y ciertas enzimas
- magnesio para la estabilidad de la pared celular
- manganeso y níquel en enzimas metabólicas
- altas concentraciones suelen inhibir el crecimiento (por ejemplo, la sal se ha utilizado en la conservación de carne de cerdo, carne de res y bacalao
- algunas bacterias, halófilos, crecen solo en presencia de altas concentraciones de ciertas sales (por ejemplo, cloruro de sodio). Las halobacteriáceas crecen solo en presencia de NaCl 3-4 M. Esta cantidad de sal es necesaria para mantener la estructura de la pared celular y los ensamblajes moleculares internos (por ejemplo, ribosomas).
Crecimiento en una sola célula (por ejemplo, Escherichia coli, un bacilo gram negativo)
El ciclo de eventos en el que una célula crece, y se divide en dos células hijas, se denomina ciclo celular.
“Crecimiento lento”
.png)
Figura 2.2.1: Replicación para crecimiento lento
- La replicación comienza en un lugar específico del cromosoma, el origen o región “ori”.
- Durante el “crecimiento lento” cada nueva célula hija contiene exactamente un cromosoma, porque una nueva ronda de replicación cromosómica no comienza hasta después de completar la división celular
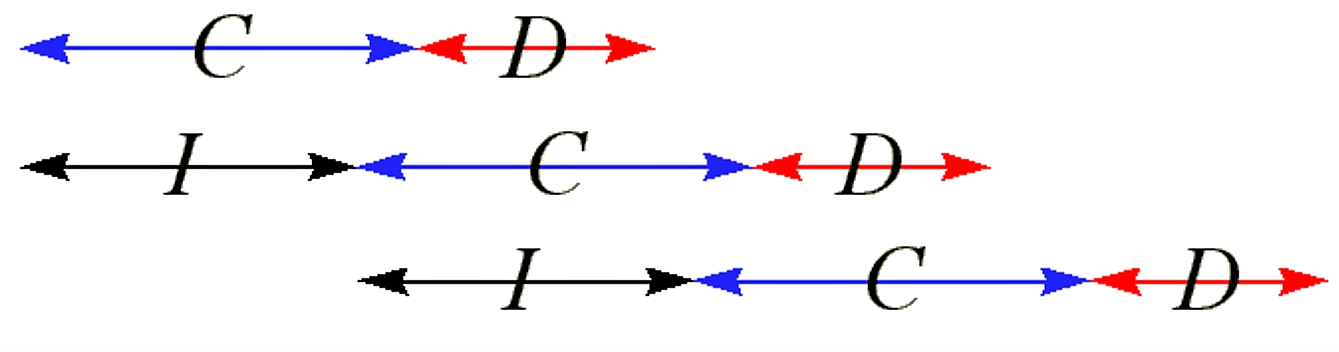
El ciclo de división celular se puede considerar como una secuencia lineal de tres periodos: I, C y D
- C es el periodo durante el cual se produce la replicación cromosómica
- D es el período en el que se forma el tabique y la división celular ocurre al final del período D
- I es el periodo entre cada inicio sucesivo de la replicación cromosómica
Para el tipo de crecimiento lento anterior, la relación entre estos tres periodos es la siguiente:
.png)
Figura 2.2.2: Periodos de ciclo celular para crecimiento lento
- También se me conoce como el tiempo de duplicación del crecimiento bacteriano
“Crecimiento Rápido”
.png)
Figura 2.2.3: Replicación para crecimiento rápido
- Comienza una nueva ronda de replicación cromosómica antes de que ocurra la división celular
.png)
Figura 2.2.4: Ciclo celular para crecimiento rápido
- Cada célula hija tiene el equivalente de aproximadamente 1 ½ cromosomas
- En células de E. coli de rápido crecimiento el periodo C es de aproximadamente 42 minutos y D es de aproximadamente 25 minutos.
- El tiempo máximo de duplicación para E. coli es de aproximadamente 20 minutos
- “medio “: todo sólido o líquido especialmente preparado para el crecimiento bacteriano
- “cultivo “: un medio líquido o sólido que contiene bacterias que han crecido (o están creciendo) en ese medio o sobre ese medio
- “incubación “: el proceso de mantener una temperatura particular (y/u otras condiciones deseables) para el crecimiento bacteriano
- “inoculación “: el proceso inicial de agregar las células al medio
Crecimiento en un medio sólido
- Solución líquida de nutrientes más 1% agar (la forma preferida de Jello en Asia. Un polisacárido extraído de algas marinas; a diferencia de Western Jello, que es una proteína extraída de las pezuñas de grandes animales de granja) forma medios sólidos
Receta Típica de Medios Sólidos (1 litro). Al medio de comunicación se le suele llamar “Caldo Luria”, o “LB”. Lleva el nombre de uno de los científicos que la desarrollaron (no “Dr. Broth”).
- Extracto de levadura 5 g (ácidos nucleicos, cofactores, sales inorgánicas, carbohidratos)
- Digestión tríptica de caseína (proteína de leche) 10g (péptidos y aminoácidos)
- NaCl 10g (nota: la concentración final es así 0.17 M, o cercana a fisiológica)
- Agar 10g
- Agua (llevar volumen hasta 1.0 litro)
- Autoclave, verter en placa de Petri, dejar enfriar
Una célula bacteriana individual se dividirá y eventualmente se convertirá en una masa visible de células conocida como colonia
Si en lugar de una sola célula, el medio sólido está inicialmente poblado con un gran número de células, será visible el crecimiento confluente o un césped de bacterias
.png)
Figura 2.2.5: Crecimiento en medio sólido
Placas de medios sólidos “rayados”
- las bacterias se pueden introducir en medios sólidos mediante una herramienta de transferencia estéril, como un bucle de alambre (alambre de nicrom) o un palillo de dientes autoclavado, que se ha sumergido en un cultivo bacteriano
- dicha transferencia contiene miles de células bacterianas individuales
- es deseable cultivar colonias a partir de células individuales en lugar de a partir de una gran población
Esto se hace para evitar la toma de la cepa por posibles revertantes de tipo silvestre
- “" "Rayado "” es un método para aislar células individuales para su crecimiento en medios sólidos a partir de una inoculación que originalmente contiene miles de células
.png)
Figura 2.2.6: Rayado
Crecimiento en medio líquido
- Sin agar
- Use un matraz Erlenmeyer o un fermentador
- Si es necesario, airear, agite
- la progenie se dispersará a lo largo del medio (difusión o locomoción)
- a medida que aumenta la densidad celular, el medio se vuelve turbio
- número de celdas trazadas frente al tiempo producirá una curva de crecimiento
.png)
Figura 2.2.7: Curva de crecimiento en medio líquido
- “fase de retraso" después de la inoculación las células se están aclimatando al nuevo ambiente (temp, nutrientes, etc.)
- Las células en “fase logarítmica" se han adaptado y se están dividiendo a una velocidad constante (es decir, el máximo para la especie en las condiciones dadas de temperatura, pH, nutrientes, oxígeno, etc.)
- El crecimiento celular en “fase estacionaria” cesa a medida que se agotan los nutrientes y/o se acumule productos de desecho en los medios
- “fase de muerte" número de viables (células vivas) en el cultivo de fase estacionaria disminuye (generalmente debido a la toxicidad de los productos de desecho)
La densidad celular se puede monitorear convenientemente usando la absorbancia de luz visible (generalmente a 600 nm)
.png)
Figura 2.2.8: Curva de densidad celular
Diferentes medios darán como resultado diferentes tasas de crecimiento y diferentes densidades de fase estacionaria
- Los medios ricos tendrán tiempos de duplicación cortos (<1.0 hora) y darán como resultado densidades celulares más altas en fase estacionaria
- Los medios mínimos exhibirán un crecimiento lento (tiempos de duplicación ~1,0 hora a 37°C) y densidades finales bajas
- La agitación y aireación eficientes pueden aumentar las densidades celulares finales (los fermentadores pueden lograr densidades más altas que los matraces agitadores).
|
Mínimo |
LB |
Estupendo |
|
|
Sales de fosfato |
16g |
- |
12g |
|
Sales de amonio |
1g |
- |
- |
|
Sales de Magnesio |
0.1g |
- |
- |
|
Glucosa/glicerol |
4g |
- |
4g |
|
Cloruro de Sodio |
0.5g |
10g |
- |
|
Digesto enzimático de caseína (proteína de leche) |
- |
10g |
12g |
|
Extracto de levadura |
- |
5g |
24g |
|
Tiempo aproximado de duplicación (min) |
60 |
45 |
30 |
|
Densidad de fase estacionaria (A 600) |
3 |
7 |
15 |
Echemos un vistazo a algunos datos brutos de un cultivo de E. coli que crece en un fermentador. La absorbancia a 600 nm se registró en varios intervalos de tiempo:
|
Tiempo |
A 600 |
|
0 |
0.09 |
|
18 |
0.102 |
|
78 |
0.124 |
|
142 |
0.253 |
|
205 |
0.487 |
|
255 |
1.02 |
|
322 |
1.98 |
|
378 |
3.95 |
|
446 |
5.88 |
|
504 |
6.76 |
|
564 |
7.2 |
`
La curva de crecimiento se ve así:
.png)
Figura 2.2.9: Curva de crecimiento muestral
Para calcular el tiempo de duplicación necesitamos conocer la región de la curva de crecimiento para la cual el crecimiento es logarítmico. Podemos evaluar esto trazando los datos de absorbancia en una escala logarítmica (log 10). En este caso, nuestros datos se verán así:
|
Tiempo |
A 600 |
registro 10 |
|
0 |
0.09 |
-1.05 |
|
18 |
0.102 |
-0.99 |
|
78 |
0.124 |
-0.91 |
|
142 |
0.253 |
-0.60 |
|
205 |
0.487 |
-0.31 |
|
255 |
1.02 |
0.01 |
|
322 |
1.98 |
0.30 |
|
378 |
3.95 |
0.60 |
|
446 |
5.88 |
0.77 |
|
504 |
6.76 |
0.83 |
|
564 |
7.2 |
0.86 |
.png)
Figura 2.2.10: Curva de crecimiento logarítmico de la muestra
En este caso, los datos parecen tener un periodo de rezago inicial seguido de crecimiento logarítmico hasta cerca de 400 minutos, luego la tasa se ralentiza. En otras palabras, la curva log 10 aparece lineal a lo largo del periodo de tiempo de 100 a 400 minutos, más o menos.
Podemos determinar convenientemente el tiempo de duplicación retrazando los datos a lo largo de este período y convirtiendo el A 600 en valores de log 2.
Nota
log N (X) = log 10 (X) /log 10 (N)
|
Tiempo |
A 600 |
registro 10 |
registro 2 |
|
0 |
0.09 |
-1.05 |
|
|
18 |
0.102 |
-0.99 |
|
|
78 |
0.124 |
-0.91 |
-3.01 |
|
142 |
0.253 |
-0.60 |
-1.98 |
|
205 |
0.487 |
-0.31 |
-1.04 |
|
255 |
1.02 |
0.01 |
0.029 |
|
322 |
1.98 |
0.30 |
0.99 |
|
378 |
3.95 |
0.60 |
1.98 |
|
446 |
5.88 |
0.77 |
|
|
504 |
6.76 |
0.83 |
|
|
564 |
7.2 |
0.86 |
.png)
Figura 2.2.11: Muestra l og 2 curva de crecimiento
Si trazamos una línea recta a través de estos puntos la pendiente nos dará la tasa de cambio de los valores del log 2 A 600 en función del tiempo:
.png)
Figura 2.2.12: Ajuste lineal L para la curva de crecimiento del log 2 de la muestra
- Así, para este cultivo, el crecimiento (pendiente) puede describirse como una tasa de 0.0167 log 2 A 600 /min.
- Por lo tanto, la inversa de la pendiente nos dirá cuántos minutos tarda el cultivo en incrementar su densidad en 1 log 2 A 600 unidades de absorbancia.
- Al ser log 2, un cambio de 1 unidades de absorbancia significa que la absorbancia se ha duplicado.
Por lo tanto, la inversa de la pendiente para la parcela log 2 nos da el tiempo que tarda la absorbancia del cultivo en duplicarse (es decir, el tiempo de duplicación)
Para este experimento, el tiempo de duplicación es 1/0.0167 o 59.9 minutos. Esto sugiere que los medios probablemente no son muy ricos (tal vez como medios mínimos), sin embargo, la absorbancia final es superior a la esperada para medios mínimos. Entonces, posiblemente el medio LB, pero el crecimiento se realizó a una temperatura más baja (es decir, conduciendo a una tasa de crecimiento más lenta).
Parámetros importantes para determinar:
- A 600 en fase estacionaria
- Una fase estacionaria de 600 a ½ (generalmente el punto de tiempo elegido para estimular a las bacterias para producir proteínas recombinantes)
- Tiempo de duplicación (parcela log 2 de A 600 sobre rango logarítmico de crecimiento, tomar pendiente inversa)


