5.2: Espectrofotometría
- Page ID
- 57278
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
El ojo humano responde a la radiación electromagnética dentro de un rango de longitudes de onda entre 400-750 nm (es decir, el “espectro visible”). Las muestras de luz que contienen un espectro continuo de todas las longitudes de onda entre 400-750nm serán percibidas por el cerebro como “luz blanca” (por ejemplo, el sol). La luz que comprende una longitud de onda específica dentro de este rango es percibida por el cerebro como “coloreada”:
|
|
|
|
|
|
A menudo los objetos aparecen coloreados debido a su absorción de luz dentro de regiones selectivas del espectro visible. La luz de tales objetos que golpea nuestros ojos (cuyo color percibimos) está compuesta por esas longitudes de onda que el objeto NO absorbió.
Por ejemplo, las hojas de las plantas contienen dos pigmentos fotosintéticos: clorofila A y clorofila B. La molécula de clorofila A tiene la capacidad de absorber luz con una longitud de onda en el rango de 430 y 660 nm; la molécula de clorofila B absorbe luz con una longitud de onda en el rango de 450 y 640 nm. Así, estos dos pigmentos en las hojas absorben las longitudes de onda de la luz violeta/azul y naranja/roja (la energía que representan estos fotones se transfiere a las moléculas de clorofila). La luz con longitudes de onda en el rango de 500-600 nm no es absorbida por ninguna de las moléculas. Así, después de que la luz solar interactúa con las hojas las longitudes de onda que quedan (y que nuestro ojo puede percibir) son verde-amarillas. Por lo tanto, las plantas son “verdes” porque no absorben la luz verde.
- ¿Cómo se vería un objeto si contuviera un pigmento que absorbiera todas las longitudes de onda de 400-750nm? Sería “negro”
- Esta es la misma situación que estar en una habitación cerrada con las luces apagadas. Sin luz no hay color.
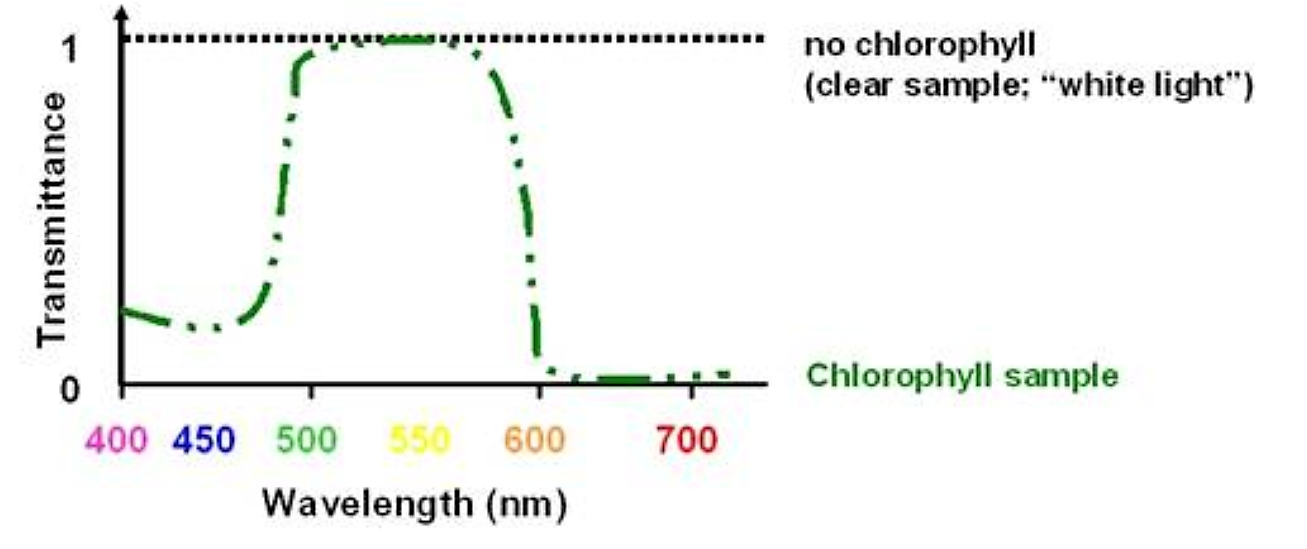
Si tuviéramos una muestra de jugo foliar que contenga clorofila A y B podríamos cuantificar la concentración de clorofila por la cantidad de violeta/azul y luz naranja/roja que absorbió. NO PODEMOS cuantificarlo por la cantidad de luz verde transmitida (sería esencialmente la misma cantidad independientemente de la cantidad de clorofila:
.png)
Figura 5.1.1: Transmisión de luz de clorofila
A pesar de que la muestra es “más verde” con mayores concentraciones de clorofila, esto no se debe a un aumento en la intensidad de la longitud de onda verde de la luz; se debe a una reducción en las longitudes de onda violeta/azul y naranja/roja de la luz. Es esta reducción la que podemos utilizar para cuantificar la concentración de clorofila. Aunque la muestra aparece verde, no podemos cuantificarla monitoreando la longitud de onda verde de la luz.
Luz, Energía y Estructura Molecular
La luz es algo extraño, es una forma radiativa de transferencia de energía, y para entender sus propiedades tenemos que considerarla que tiene propiedades tanto de onda como de partícula. Las diferentes longitudes de onda de la luz difieren en la energía que transportan; la energía es directamente proporcional a la frecuencia de la luz (cuanto mayor es la frecuencia, mayor es la energía):
E α n
La unidad de energía es el erg (1Joule = 10 7 ergs) y la unidad de frecuencia es Hertz (es decir, ciclos por segundo, o solo unidades de sec -1). La constante de proporcionalidad es la constante de Planck, h, con un valor y unidades de 6.6 x 10 -27 erg seg
E = h n
erg = (erg seg) (seg -1)
La frecuencia (n) de la luz es inversamente proporcional a la longitud de onda (l):
n α 1/λ
La frecuencia tiene unidades de sec -1 y la longitud de onda tiene unidades de metros. La constante de proporcionalidad es c (la velocidad de la luz) con un valor y unidades de 3 x 10 8 m/seg:
n = c (1/λ) = c/λ
Esta relación es cierta en un vacío; sin embargo, los materiales “ópticamente densos” pueden disminuir la velocidad de la luz requiriendo la siguiente corrección a la ecuación anterior:
n = c/ n l
donde n es el “índice de refracción” del material y tiene un valor > 1
Por lo tanto, la energía de la luz es inversamente proporcional a la longitud de onda:
E = (h c)/(n l)
El “fotón” es una descripción corpuscular (partícula) de la luz que es el portador de los “cuantos” de energía definidos en la ecuación anterior. Cuando la luz es absorbida por una molécula transfiere sus cuantos de energía, y el fotón deja de existir. ¿A dónde fue la energía?
- Los enlaces atómicos, la estructura química y los electrones de una molécula dada tienen estados excitados específicos y modos vibracionales.
- Estos estados excitados y modos vibracionales tienen niveles de energía definidos por encima del estado fundamental.
- La molécula puede cambiar del estado fundamental a un estado excitado (o modo vibracional) tras la absorción de una cantidad de energía exactamente igual a la diferencia entre los estados tierra y excitado.
- Así, las moléculas pueden absorber la energía asociada a longitudes de onda específicas de la luz, y la luz se consume en el proceso.
.png)
Figura 5.1.2: Escala de luz
Los enlaces atómicos, la estructura química y electrónica de las moléculas son propiedades únicas y difieren de un tipo de molécula a otra.
- Así, las diferencias energéticas entre los estados suelo y excitado difieren de un tipo de molécula a otro.
- Por lo tanto, la capacidad de interactuar y absorber la luz, y las longitudes de onda específicas de la luz absorbida difieren de un tipo de molécula a otra
El patrón de absorción característico de las diferentes longitudes de onda de luz es único para cada tipo de molécula y es un tipo de “huella” molecular que se puede utilizar para identificar y cuantificar moléculas
En el ejemplo de clorofila dado anteriormente la intensidad de la luz que pasa a través de la muestra se denomina la “transmitancia de luz" de la muestra:
.png)
Figura 5.1.3: Transmitancia de luz de clorofila
- La transmitancia es un número adimensional que varía de 1 (transmitancia completa) a 0 (sin transmitancia - absorción completa)
Es importante destacar la distinción entre transmitancia y absorción: son inversamente proporcionales
- Una muestra con alta absorbancia tiene una baja transmisión de luz
.png)
Figura 5.1.4: Absorción de clorofila
¿Cómo se cuantifican la transmitancia (T) y la absorción (A)?
- La intensidad de la luz que brilla sobre una muestra se denomina luz incidente, I 0
- La intensidad de la luz medida después de pasar a través de una muestra es la luz transmitida, I
- La transmitancia, T, se define como la relación I/I 0 y variará entre 0 y 1:
.png)
Figura 5.1.5: Transmitancia
¿Cómo afecta la transmitancia la concentración de la muestra y el tamaño físico (es decir, la longitud de la ruta)?
- Si la transmitancia se reduce debido a la absorción por la muestra, entonces cuanto mayor sea la concentración (c), menor será la transmitancia. En otras palabras, la transmitancia es inversamente proporcional a la concentración: (Ley de Beer)
T α 1/ c
- De manera similar, cuanto más gruesa es la muestra (es decir, cuanto mayor es la longitud del camino de la luz a través de la muestra), menor es la transmitancia. Así, la transmitancia también es inversamente proporcional a la longitud de la trayectoria (l): (Ley de Lambert)
T α 1/ l
Así, esperamos que la ecuación que relaciona T con c y l tome la forma general de:
T α 1/ cl
La transmitancia resulta disminuir exponencialmente con los aumentos en la concentración y la longitud de la trayectoria, así la ecuación tiene la forma:
LogT α 1/ cl
-logT α cl
La constante de proporcionalidad es el coeficiente de extinción e:
-logT = ε cl
Dado que los valores logarítmicos son adimensionales, las unidades de e parecerían ser concentración inversa y distancia inversa (por ejemplo, M -1 cm -1)
El término -logT a la izquierda se puede escribir como log (1/T) e identifica la relación inversa entre la transmitancia T y el término e cl. Dado que la absorbancia y la transmitancia están inversamente relacionadas, el término e cl parecería ser una definición conveniente para la absorbancia (A):
log (1/T) = ε cl = A
(la Ley Beer-Lambert)
Valores para ε y l
- La longitud de la trayectoria l suele ser en unidades de cm
- El coeficiente de extinción molar ε tiene unidades de M -1 cm -1 y es una constante de proporcionalidad que relaciona la absorción de soluciones molares
- El coeficiente de extinción de masa ε 1% se refiere a la absorbancia de una solución al 1% en masa. Típicamente esto se refiere a una solución acuosa que podemos tomar para tener una densidad de 1000g/L, por lo que una solución acuosa al 1% en masa se referiría a la disolución de 10g/L, o una solución de 10mg/ml de la molécula de interés.
- Dado que la absorbancia de una molécula es una función de la longitud de onda (es decir, la absorción no es igual para cada longitud de onda) el coeficiente de extinción también debe hacer referencia a una longitud de onda. Esto se hace típicamente usando un subíndice:
ε 1% 280nm = 14.5 g -1 L cm -1
· En este caso una solución de 10mg/ml de la molécula tendrá una lectura de absorbancia de 14.5 (unidades adimensionales) a l = 280nm (la absorción a otras longitudes de onda puede no conocerse). Las unidades de concentración son g/L, por lo que e tendrá dimensiones de g -1 L cm -1.
La relación entre los cambios en A, T y c
· La relación directa entre A y c significa que existe una relación lineal entre absorbancia y concentración. Si duplicas la concentración la absorbancia se duplicará, etc.
· La relación logarítmica inversa entre transmitancia y absorbancia se puede afirmar como:
T = 1/10 A
- Por lo tanto, una duplicación de la concentración dará como resultado una reducción de 10 veces en la transmitancia. La instrumentación para mediciones de absorbancia (espectrofotómetros) realmente mide la transmitancia y, naturalmente, se vuelve menos precisa a valores bajos de transmitancia. Por lo tanto, cuanto mayor es la lectura de absorbancia, menos precisa es. La mayoría de estos instrumentos son inexactos en lecturas de absorbancia > 1.5 (esto resulta ser a transmitancia < 3% de transmitancia completa)
Diseño de Espectrofotómetros
Los espectrofotómetros son instrumentos de precisión, sin embargo, conceptualmente involucran un número relativamente pequeño de partes. Un diseño simple se vería así:
.png)
Figura 5.1.6: Espectrofotómetro
- Una lámpara de tungsteno se utiliza para producir longitudes de onda de luz que abarcan el rango visible, mientras que una lámpara de deuterio se utiliza para producir luz que abarca el rango ultravioleta.
- El prisma móvil o rejilla de difracción se ajusta para dirigir la longitud de onda de interés hacia la muestra
- Se trata de un espectrofotómetro de “haz único” y los datos de referencia y de muestra se recogen por separado (la muestra de referencia se utiliza para determinar el valor máximo de transmisión (efectivamente I 0)
Una modificación de este diseño, un espectrofotómetro de “doble haz”, puede permitir la medición simultánea de I e I 0:
.png)
Figura 5.1.7: Espectrómetro de haz doble
Tanto el detector de haz simple como el doble permiten al investigador monitorear las propiedades de absorbancia para una sola longitud de onda de luz (la longitud de onda seleccionada por los ajustes de prism/hendidura. Una modificación que incorpora una matriz de detectores puede permitir la medición simultánea de un espectro de longitudes de onda:
.png)
Figura 5.1.8: Medición simultánea de un espectro
Espectros de absorbancia de moléculas biológicas
Proteínas
Las proteínas no se absorben en la longitud de onda visible a menos que tengan un grupo protésico (por ejemplo, Fe 2+) o un aminoácido no natural. Sin embargo, los aminoácidos triptófano, tirosina y cisteína absorben la luz en la longitud de onda UV:
.png)
Figura 5.1.9: Absorción de triptófano
- El triptófano tiene un pico de absorción a 280 nm en el rango UV
- Esta es una longitud de onda útil para cuantificar la absorción de triptófano
- Dado que la absorción es proporcional a la concentración, esta es una forma útil de cuantificar la concentración de proteínas (para proteínas que contienen Trp)
Ácidos nucleicos
Los anillos aromáticos en las bases de los ácidos nucleicos también absorben en el rango UV:
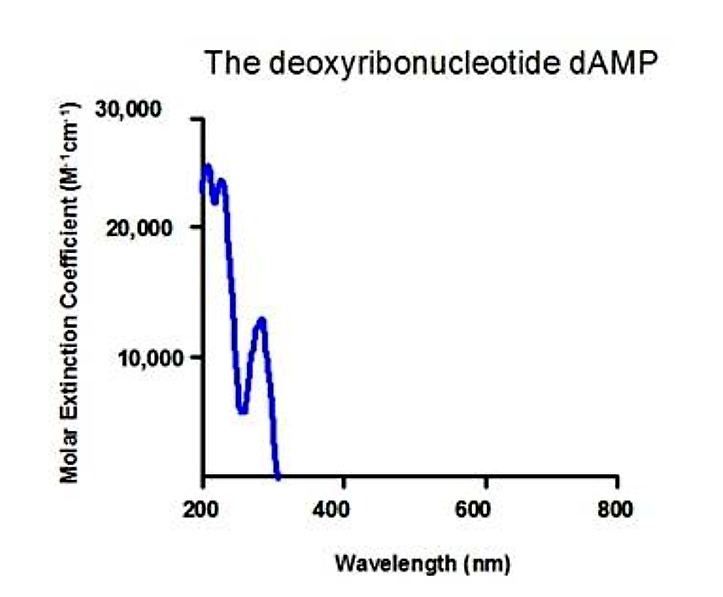.png)
Figura 5.1.10: Absorción de ácidos nucleicos
- Cada base de ADN y ARN tiene un espectro de absorción ligeramente diferente
- 260 o 280 nm es una longitud de onda típicamente útil para monitorear la concentración de ácidos nucleicos
Tenga en cuenta que las muestras de ácidos nucleicos y proteínas pueden absorber ambos a 280nm, por lo tanto, las muestras de moléculas biológicas deben ser puras para cuantificar mediante espectroscopía de absorción UV.


