6.2: El Proceso de Desarrollo de Medicamentos
- Page ID
- 53275
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Descripción general
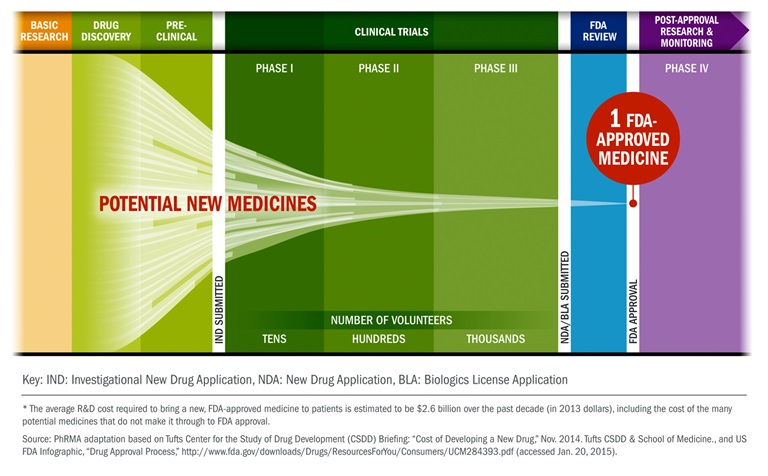
Los nuevos medicamentos pueden tardar más de 12 años y cuestan 2.6 mil millones de dólares (Phrma, 2015). El primer hito para cualquier medicamento nuevo ocurre durante la fase de investigación y descubrimiento. Alguna forma de experimentación en un laboratorio de I+D conduce al desarrollo de un ingrediente farmacéutico activo (API) que puede tener actividad terapéutica en el cuerpo humano. Si se cree que el ingrediente activo tiene un potencial real, el medicamento pasa a la etapa de desarrollo. Esta etapa temprana de desarrollo involucra lo que se conoce como “pruebas preclínicas”, y se lleva a cabo en laboratorios e instalaciones de pruebas en animales. Esta fase preclínica debe ser exitosa antes de que las pruebas puedan ocurrir en humanos. Si el medicamento funciona bien durante esta etapa, la compañía puede presentar una Solicitud de Nuevo Medicamento en Investigación (IND) ante la FDA para solicitar permiso para comenzar las pruebas en sujetos humanos. Hay tres fases principales por las que debe pasar un medicamento durante las pruebas con sujetos humanos (estudios clínicos). Si el medicamento pasa por estudios clínicos con éxito, la compañía puede enviar una Solicitud de Nuevo Medicamento (NDA) a la FDA. Si la FDA otorga su aprobación, la compañía finalmente puede comenzar a vender el producto, pero su participación no termina ahí. La FDA continuará interactuando con la compañía para ayudar a garantizar que el producto se fabrique de manera segura. Es importante señalar que la empresa que patrocina el desarrollo de medicamentos puede no ser la empresa que realiza las tareas del desarrollo. Las Organizaciones de Investigación por Contrato (CRO) son frecuentemente alistadas y pagadas para realizar tareas específicas de desarrollo de medicamentos. Estas tareas pueden incluir pruebas en animales, pruebas en humanos y fabricación real.
¡Explora!
La FDA proporciona una descripción general simple del proceso de revisión de medicamentos aquí.
¿Los medicamentos de venta libre pasan por el mismo proceso de aprobación?
Hitos en la Fabricación de un Medicamento
Investigación y Desarrollo
Los primeros enfoques para el descubrimiento de fármacos consistieron en identificar y aislar los componentes activos de los productos químicos naturales, como los que se encuentran en las plantas y otros remedios homeopáticos. En el laboratorio moderno, los investigadores también buscan los agentes causantes de enfermedades (por ejemplo, proteínas faltantes o hiperactivas) para guiar la investigación de medicamentos al comprender qué problemas deben ser dirigidos. El cribado de alto rendimiento (HTS) es otro enfoque, que permite a los científicos seleccionar miles de medicamentos potenciales a la vez y permite una rápida identificación y focalización de compuestos potencialmente útiles.
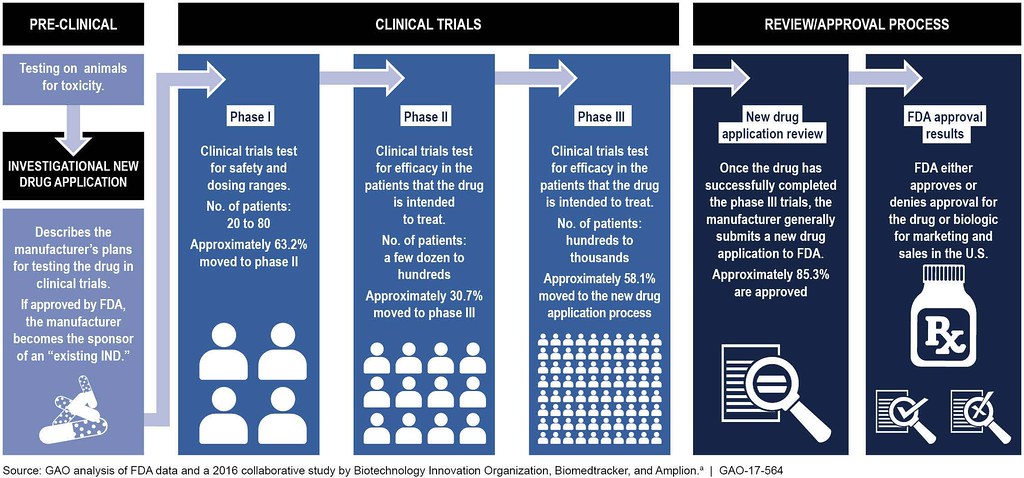
Desarrollo Preclínico
Antes de probar un medicamento en humanos, debe someterse a pruebas no clínicas para obtener datos básicos de toxicidad y farmacológicos. Las pruebas no clínicas deben incluir modelos animales y ensayos para explorar farmacología, toxicidad, toxicidad reproductiva y genotoxicidad. El desarrollo preclínico puede tomar entre 1 y 4 años y puede requerir pruebas adicionales para ser en conjunto (o en paralelo) con estudios clínicos.
Los Objetivos del Desarrollo Preclínico:
- Identificar las propiedades físicas y químicas del fármaco candidato
- Prueba in vitro del fármaco candidato
- Determinación de la formulación para administración a sujetos de prueba y pacientes
- Desarrollo de métodos de fabricación para el fármaco candidato
- Prueba del fármaco candidato en células cultivadas
- Prueba de seguridad del fármaco candidato en animales
- Desarrollo de ensayos analíticos
- Asegurar la protección de la propiedad intelectual del producto potencial, sus usos y su fabricación
ADME
Para que este fármaco potencial sea útil, debe ser estable, seguro y fabricarse prácticamente. Esta etapa también se dedica a determinar la actividad del fármaco, los atributos químicos y la solubilidad y a esbozar esquemas de fabricación para asegurar su potencial como medicamento. Si el medicamento muestra potencial en el laboratorio, el siguiente paso requiere pruebas de toxicidad. Estas pruebas también se conocen como estudios ADME (Absorción, Diseminación, Metabólico y Excreción). Los estudios ADME se llevan a cabo en animales y ayudan a los investigadores a determinar:
- ¿Cuánto de la droga es absorbida por la sangre?
- ¿Cómo se altera metabólicamente la sustancia en el cuerpo?
- ¿Cuáles son los efectos de toxicidad de los subproductos metabólicos?
- ¿Qué tan rápido se excretará el medicamento y sus subproductos?
Toxicidad
La evaluación de la seguridad se realiza mediante estudios de toxicidad. Estos estudios se llevan a cabo utilizando pautas de BPL durante 30-90 días, en un mínimo de dos especies de mamíferos, una de las cuales debe ser no roedor. La dosis, la duración del estudio y la complejidad del estudio están relacionadas con el estudio clínico propuesto; la duración y complejidad deben ser iguales o superiores a lo que se propone en humanos. Adicionalmente, si el nuevo medicamento también es una Nueva Entidad Química (NCE) y no tiene datos humanos a largo plazo en absoluto, se puede requerir que el estudio supere los 12 meses.
- Toxicidad reproductiva. La fertilidad y el desarrollo embrionario también se estudian extensamente en ensayos clínicos en humanos. Esto incluye el desarrollo embrionario temprano, el desarrollo embriofetal, así como el desarrollo pre y postnatal.
- Genotoxicidad. La genotoxicidad, la propensión a dañar la información genética, también se estudia extensamente tanto in vitro como in vivo. Esta evaluación de la mutagenicidad se prueba tanto en bacterias como en células de mamíferos.
- Carcinogenicidad. No se requieren estudios de carcinogenicidad antes de que comiencen los estudios clínicos y es posible que no sea necesario realizar para algunos productos. Estos estudios pueden tardar más de 2 años en completarse.
Aplicación Investigacional de Nuevos Medicamentos (IND)
Si el candidato a fármaco es prometedor en las pruebas preclínicas, entonces la compañía compila sus datos y presenta un plan para probar el medicamento en sujetos humanos a la FDA, llamado Aplicación Investigacional de Nuevo Medicamento (IND). El IND contiene información de estudios en animales, información relativa a la composición y fabricación del medicamento, y el plan de investigación. La aplicación IND incluye una descripción del producto, los resultados de las pruebas en animales y los planes para realizar más pruebas. Entonces, la FDA decide si los materiales de la compañía están lo suficientemente completos para que la compañía pueda comenzar a probar el producto en humanos.
El IND no está 'aprobado'; más bien, se activa dentro de los 30 días posteriores a la recepción de la FDA. Si se descubren deficiencias, se le da a la empresa la oportunidad de corregirla. Si no se abordan los temas, la FDA pondrá en suspenso los estudios clínicos hasta que estén. Algunas áreas de preocupación para la FDA incluyen riesgos irrazonables para la salud humana, investigadores sin las credenciales apropiadas y datos preclínicos incompletos (o engañosos).
Enmiendas IND
Durante el desarrollo clínico, el IND debe actualizarse si se realizan cambios. Estas enmiendas pueden incluir cambios en los protocolos, nuevos datos toxicológicos de estudios en animales que se extendieron a los estudios clínicos, cualquier evento adverso y cualquier nuevo hallazgo que revele que este medicamento pueda causar un riesgo significativo para la salud de los voluntarios humanos.
Desarrollo Clínico
El gobierno tiene interés en proteger al público de productos y medicamentos defectuosos. Por lo tanto, las empresas deben demostrar su efectividad y seguridad antes de la distribución masiva. Sin embargo, la única forma en que pueden hacerlo activamente es haciendo que sujetos humanos prueben sus productos. Como actualización del capítulo anterior sobre estudios clínicos, vea este video sobre ensayos clínicos: Youtu.be/PM1IGF85UOa
Banco de Datos de Ensayos Clínicos
Como se discutió anteriormente, todos los datos clínicos se publican en el banco de datos de ensayos clínicos en clinicaltrials.gov, el cual es mantenido por los Institutos Nacionales de Salud (NIH). Las empresas deben presentar sus datos clínicos de Fase 2 y 3. Una empresa puede solicitar retener estos datos si pueden demostrar que interferirán sustancialmente con un estudio clínico oportuno; sin embargo, esto depende de la FDA.


