17.1: Isótopos radiactivos
- Page ID
- 54663
Recordemos que un átomo es el componente más pequeño de un elemento que conserva todas las propiedades químicas de ese elemento (ver Materia). Como se discutió anteriormente, los átomos contienen neutrones no cargados y protones cargados positivamente en el núcleo. Los electrones cargados negativamente rodean el núcleo. La masa atómica de un átomo está determinada por el número de protones y neutrones porque la masa de electrones es insignificante. Cada protón o neutrón pesa 1 unidad de masa atómica (UMA). Los valores de masa atómica mostrados en la tabla periódica de elementos no son números enteros porque representan la masa atómica promedio para los átomos de ese elemento (figura\(\PageIndex{a}\)). Los átomos del mismo elemento no necesariamente tienen la misma masa porque pueden diferir en el número de neutrones.
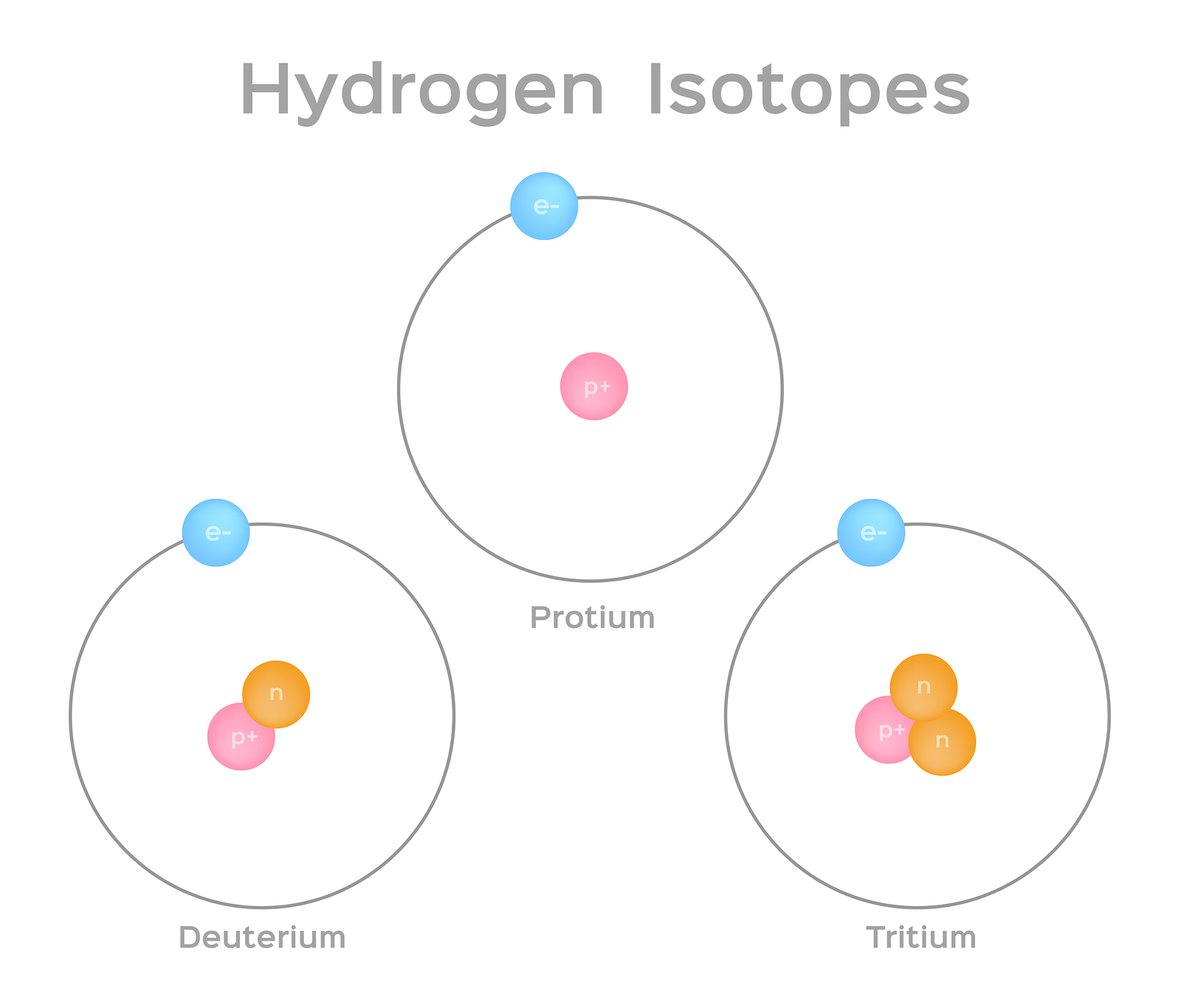
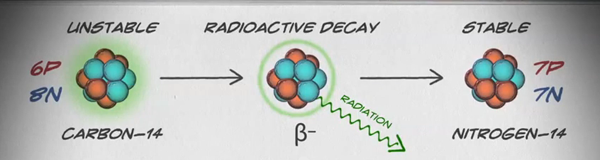
Los isótopos son diferentes formas del mismo elemento que tienen el mismo número de protones, pero un número diferente de neutrones. Algunos elementos, como el carbono, potasio y uranio, tienen isótopos naturales. El carbono-12, el isótopo más común del carbono, contiene seis protones y seis neutrones. Por lo tanto, tiene un número de masa de 12 (seis protones y seis neutrones) y un número atómico de 6 (lo que lo convierte en carbono). El Carbono-14 contiene seis protones y ocho neutrones. Por lo tanto, tiene un número de masa de 14 (seis protones y ocho neutrones) y un número atómico de 6, lo que significa que sigue siendo el elemento carbono. Estas dos formas alternas de carbono son isótopos. Algunos isótopos son inestables y emiten radiación en forma de partículas y energía para formar elementos más estables. Algunas formas de radiación son peligrosas. Estos se denominan isótopos radiactivos o radioisótopos (figura\(\PageIndex{b}\)). Durante la desintegración radiactiva, un tipo de átomo puede transformarse en otro tipo de átomo de esta manera (figura\(\PageIndex{c}\)).
Half-Life
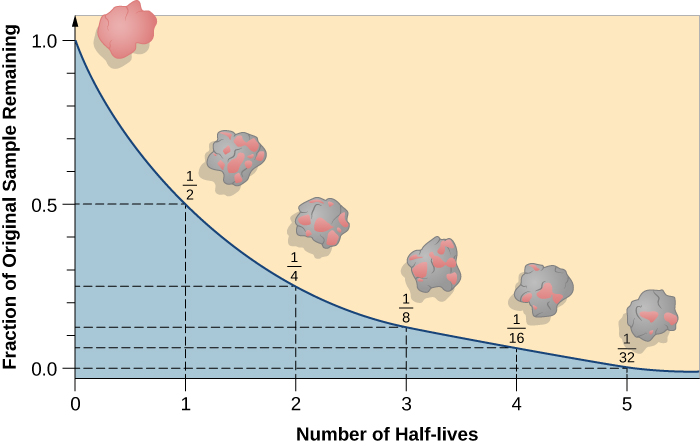
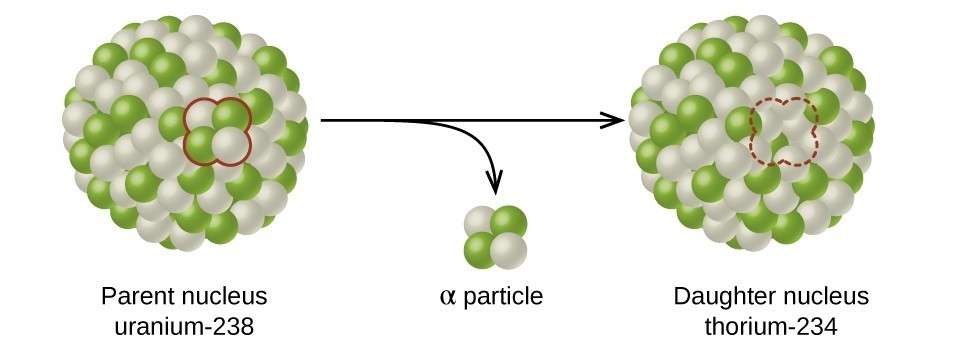
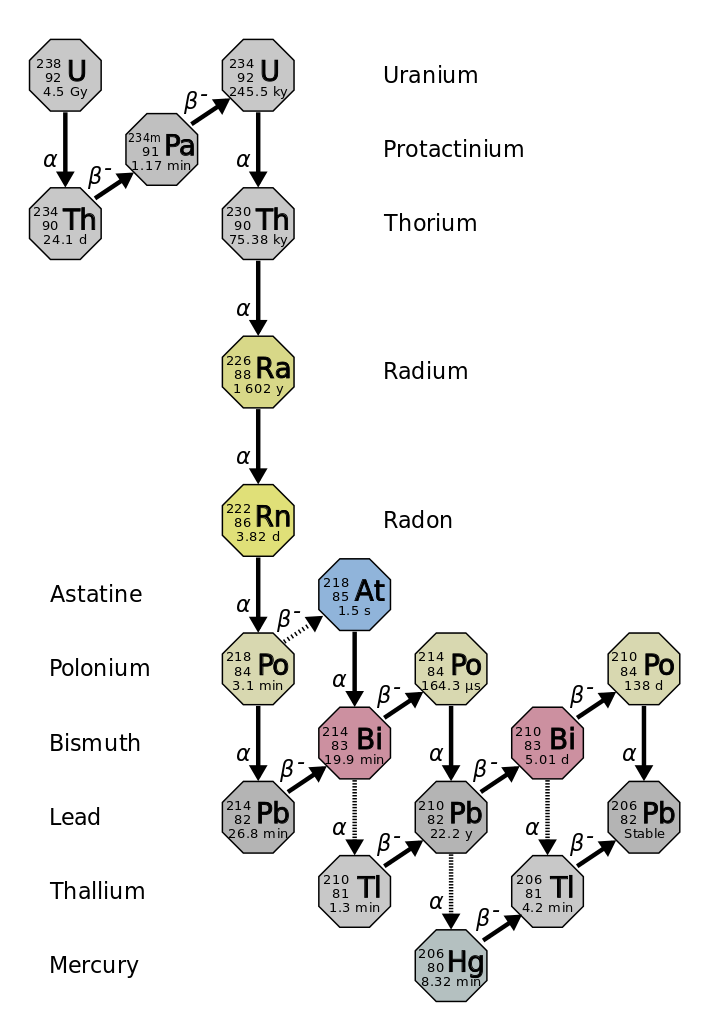
La vida media es la cantidad de tiempo que tarda la mitad del isótopo radiactivo original en descomponerse (figura\(\PageIndex{d}\)). Por ejemplo, la vida media del uranio-238 es de unos 4.5 mil millones de años. Después de 4.5 mil millones de años, sólo quedará la mitad (50%) de la cantidad original de uranio-238. El resto habrá descompuesto a torio-234 (que también es radiactivo y rápidamente se descompone en una serie de isótopos radiactivos, hasta que finalmente se convierte en plomo-206, que es estable; cifra\(\PageIndex{e-f}\)). Después de dos vidas medias (9 mil millones de años), solo quedaría la mitad del 50% (25% del original). Después de tres semividas, sólo quedaría 12.5% del uranio-238 original.
Evolución en acción: Datación por carbono
El carbono-14 (14 C) es un radioisótopo natural que es creado en la atmósfera por los rayos cósmicos. Este es un proceso continuo, por lo que siempre se está creando más 14 C. A medida que se desarrolla un organismo vivo, el nivel relativo de 14 C en su cuerpo es igual a la concentración de 14C en la atmósfera. Cuando un organismo muere, ya no está ingiriendo 14 C, por lo que la proporción disminuirá. 14 C decae a 14 N por un proceso llamado decaimiento beta; emite energía en este proceso lento (figura\(\PageIndex{c}\)). Después de aproximadamente 5,730 años, solo la mitad de la concentración inicial de 14 C habrá sido convertida a 14 N. El tiempo que tarda la mitad de la concentración original de un isótopo en desintegrarse a su forma más estable se llama su vida media.
Debido a que la vida media de 14 C es larga, se utiliza para envejecer objetos anteriormente vivos, como los fósiles. Utilizando la relación entre la concentración de 14 C que se encuentra en un objeto y la cantidad de 14 C detectada en la atmósfera, se puede determinar la cantidad del isótopo que aún no se ha descompuesto. Con base en esta cantidad, la edad del fósil se puede calcular en aproximadamente 50,000 años (figura\(\PageIndex{g}\) a continuación). Los isótopos con vidas medias más largas, como el potasio-40, se utilizan para calcular las edades de los fósiles más antiguos. Mediante el uso de la datación por carbono, los científicos pueden reconstruir la ecología y biogeografía de organismos que viven en los últimos 50,000 años.
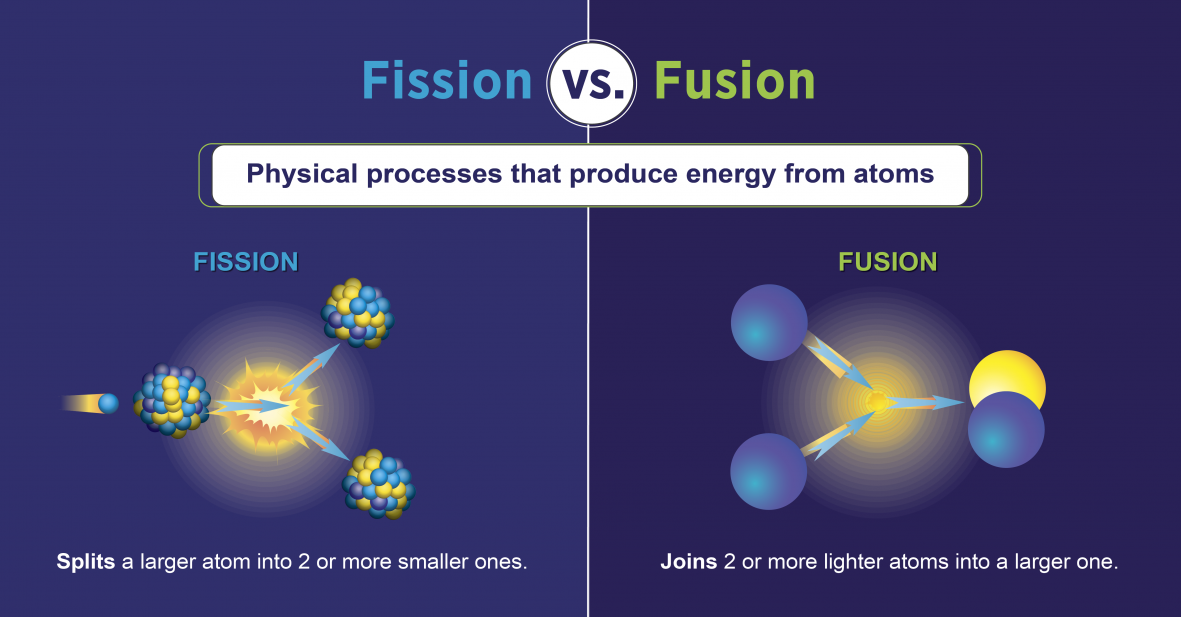
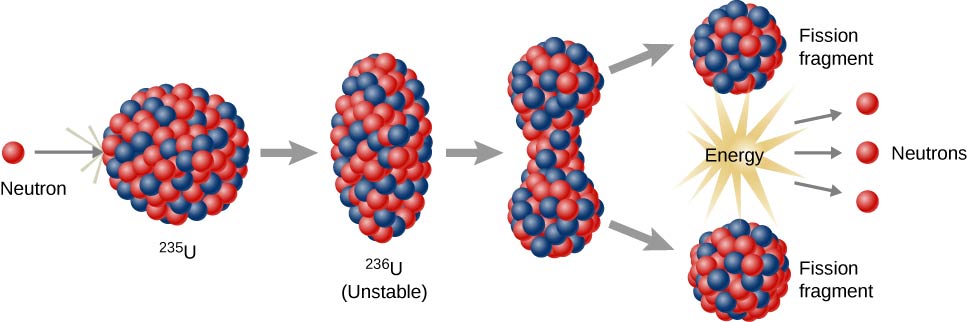
Reacciones de fisión nuclear
Las reacciones de fisión nuclear son aquellas que implican dividir el núcleo de un átomo (figura\(\PageIndex{h}\)). Pueden ser inducidos por voladura de elementos radiactivos con neutrones. Como ocurre con la desintegración radiactiva natural, las reacciones de fisión nuclear inducidas liberan energía La energía térmica liberada cuando la fisión nuclear puede ser utilizada para generar electricidad. Esta es la base de la energía nuclear. Actualmente, el uranio-235 (235 U; un isótopo de uranio con una masa atómica de 235) se utiliza actualmente como combustible para reacciones de fisión nuclear (figura\(\PageIndex{h}\)).