3.2: Detección de quórum bacteriano, islas de patogenicidad y sistemas de secreción (injectosomas)
- Page ID
- 55297
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Objetivos de aprendizaje
- Defina lo siguiente:
- patogenicidad
- virulencia
- A pesar de que un microorganismo puede considerarse patógeno, es posible que aún no pueda causar enfermedades al ingresar al cuerpo. Discuta por qué.
- Definir y describir brevemente el proceso general de detección de quórum en bacterias y cómo puede permitir que las bacterias se comporten como una población multicelular.
- Indicar al menos dos posibles ventajas del comportamiento bacteriano individual.
- Indicar al menos dos posibles ventajas del comportamiento bacteriano multicelular.
- Indicar qué se entiende por intraespecies, interespecies y comunicación interreino.
- Indicar la función de los sistemas de secreciones bacterianas (injectisomas) como los sistemas de secreción tipo 3 y tipo 6 en la patogenicidad bacteriana.
En este Objeto de Aprendizaje vamos a analizar varios aspectos de la genética bacteriana que están directamente relacionados con la patogenicidad bacteriana, a saber, la detección de quórum, las islas de patogenicidad y los sistemas de secreción. La patogenicidad y virulencia son términos que se refieren a la capacidad de un organismo para causar enfermedades. La patogenicidad es la capacidad de un microbio para causar enfermedades e infligir daño a su huésped, mientras que la virulencia es el grado de patogenicidad dentro de un grupo o especie de microbios como lo indican las tasas de letalidad y/o la capacidad del organismo para invadir los tejidos del huésped. La patogenicidad de un organismo, es decir, su capacidad de causar enfermedades, está determinada por sus factores de virulencia.
Muchos de los factores de virulencia que permiten que las bacterias colonicen el cuerpo y/o dañen el cuerpo son productos de genes sensores de quórum. Muchas bacterias son capaces de percibir su propia densidad de población, comunicarse entre sí a través de factores químicos secretados y comportarse como una población más que como bacterias individuales. Esto juega un papel importante en la patogenicidad y supervivencia de muchas bacterias.
Detección de quórum bacteriano
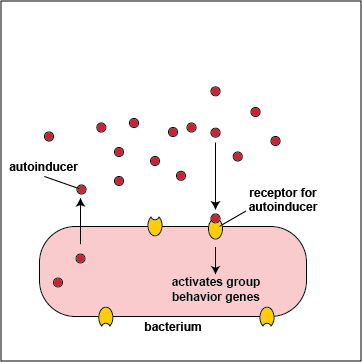
Las bacterias pueden comportarse como organismos unicelulares individuales o como poblaciones multicelulares. Las bacterias exhiben estos comportamientos al “hablar” químicamente entre sí a través de un proceso llamado detección de quórum. La detección de quórum implica la producción, liberación y detección en toda la comunidad de moléculas llamadas autoinductores que modulan la expresión génica y, en última instancia, el comportamiento bacteriano, en respuesta a la densidad de una población bacteriana.
Para iniciar el proceso de detección de quórum, los genes bacterianos codifican para la producción de moléculas de señalización llamadas autoinductores que se liberan en el entorno circundante de la bacteria. Estas moléculas de señalización luego se unen a receptores de señalización ya sea en la superficie bacteriana o en el citoplasma. Cuando estos autoinductores alcanzan un nivel crítico de umbral, activan genes de detección de quórum bacteriano que permiten que las bacterias se comporten como una población multicelular en lugar de como organismos unicelulares individuales (Figura\(\PageIndex{3}\).2.2). El complejo autoinductor/receptor es capaz de unirse a promotores de ADN y activar la transcripción de genes controlados por detección de quórum en la bacteria. De esta manera, las bacterias individuales dentro de un grupo son capaces de beneficiarse de la actividad de todo el grupo.
- En bacterias Gram-negativas, los autoinductores son típicamente moléculas llamadas acil-homoserina lactonas o AHL. Los AHL se difunden fácilmente fuera y hacia las células bacterianas donde se unen a los receptores AHL en el citoplasma de la bacteria. Cuando se alcanza un nivel crítico de AHL, el complejo autoinductor/receptor citoplásmico funciona como un activador transcripcional de unión al ADN.
- En bacterias Gram-positivas, los autoinductores son oligopéptidos, péptidos cortos típicamente de 8-10 aminoácidos de longitud. Los oligopéptidos no pueden difundirse dentro y fuera de bacterias como los AHL, sino que dejan bacterias a través de exportadores específicos. Luego se unen a receptores autoinductores en la superficie de la bacteria. Cuando se alcanza un nivel crítico de oligopéptido, la unión del oligopéptido a su receptor inicia una cascada de fosforilación que activa proteínas reguladoras transcripcionales de unión al ADN llamadas reguladores de respuesta.
Los resultados de la interacción bacteria-huésped suelen estar relacionados con la densidad de población bacteriana. La virulencia bacteriana, es decir, su capacidad para causar enfermedades, se basa en gran medida en la capacidad de la bacteria para producir productos génicos llamados factores de virulencia que permiten que esa bacteria colonice al huésped, resista las defensas del cuerpo y dañe el cuerpo.
A baja densidad de bacterias, los autoinductores se difunden lejos de la bacteria (Figura\(\PageIndex{3}\) .2.2). Cantidades suficientes de estas moléculas son incapaces de unirse a los receptores de señalización en la superficie bacteriana y no se activan los genes de detección de quórum que permiten que las bacterias actúen como población. Esto permite que las bacterias se comporten como organismos unicelulares individuales.
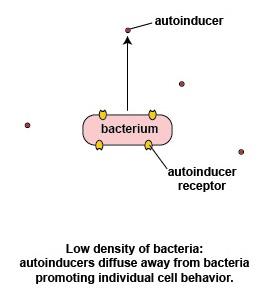
Posibles ventajas del comportamiento bacteriano individual observadas a baja densidad bacteriana
Si un número relativamente pequeño de una bacteria específica ingresara al cuerpo e inmediatamente comenzara a producir sus factores de virulencia, lo más probable es que el sistema inmunitario del cuerpo tuviera tiempo suficiente para reconocer y contrarrestar esos factores de virulencia y eliminar las bacterias antes de que hubiera cantidad suficiente para causar daño. En cambio, la bacteria utiliza genes que le permiten actuar como un organismo individual en lugar de como parte de una población multicelular.
Actuar como organismos individuales puede permitir que esa baja densidad de bacterias se afiance mejor en su nuevo entorno de las siguientes maneras:
1. Muchas bacterias son capaces de motilidad y la motilidad sirve para mantener a las bacterias en un ambiente óptimo a través de taxis.
La motilidad y la quimiotaxis probablemente ayudan a que algunos patógenos intestinales y urinarios se muevan a través de la capa mucosa para que puedan adherirse a las células epiteliales de las membranas mucosas. De hecho, muchas bacterias que pueden colonizar las membranas mucosas de la vejiga y los intestinos son móviles. La motilidad probablemente ayuda a que estas bacterias se muevan a través del moco en lugares donde es menos viscoso.
2. Una de las defensas innatas del cuerpo es la capacidad de eliminar físicamente las bacterias del cuerpo a través de medios tales como el desprendimiento constante de células epiteliales superficiales de la piel y las membranas mucosas, la eliminación de bacterias por medios tales como tos, estornudos, vómitos y diarrea, y la eliminación bacteriana por fluidos corporales como saliva, sangre, mucosidad y orina. Las bacterias pueden resistir esta eliminación física produciendo pili (ver Figura\(\PageIndex{3}\)), proteínas adhesinas de la pared celular (Figura\(\PageIndex{3}\) .2.4) y/o cápsulas productoras de biopelícula. Algunos pili, llamados pili tipo IV, también permiten que algunas bacterias “caminen” o “se arrastren” a lo largo de las superficies para extenderse y eventualmente formar microcolonias.
Figura\(\PageIndex{3}\) .2.3: Punta Adhesiva de Pili Bacterianos que se unen a Receptores de Células

3. Muchas bacterias secretan un polisacárido extracelular o matriz polipeptídica llamada cápsula o glicocáliz que permite que las bacterias se adhieran a las células hospedadoras, resistan la fagocitosis y formen microcolonias. A s las bacterias aumentan geométricamente en número por fisión binaria, también lo hace la cantidad de sus autoinductores secretados, y la producción de altos niveles de autoinductores permite que la población de bacterias se comunique entre sí por detección de quórum. A una alta densidad de bacterias, se producen grandes cantidades de autoinductores (Figura\(\PageIndex{3}\).2.5) and are able to bind to the signaling receptors on the bacterial surface in sufficient quantity so as to activate the quorum sensing genes that enable the bacteria to behave as a multicellular population (Figure \(\PageIndex{3}\).2.1).

Ventajas del Comportamiento Multicelular visto a Alta Densidad Bacteriana
- Al comportarse como una población multicelular, las bacterias individuales dentro de un grupo pueden beneficiarse de la actividad de todo el grupo. A medida que toda la población de bacterias activa simultáneamente sus genes de virulencia, es mucho menos probable que los sistemas inmunitarios del cuerpo tengan tiempo suficiente para contrarrestar esos factores de virulencia antes de que se haga daño.
- Esto desencadena la producción de una matriz adhesiva extracelular (glicocáliz) que permite que las bacterias formen microcolonias y se adhieran irreversiblemente a las membranas mucosas. Comienza la formación de biopelículas.
- Los factores de virulencia como exoenzimas y toxinas pueden dañar las células hospedadoras permitiendo que las bacterias en la biopelícula obtengan nutrientes. La biopelícula continúa desarrollándose y madurando.
- A medida que el área se vuelve superpoblada de bacterias, la detección de quórum permite que algunas de las bacterias escapen de la biopelícula, a menudo produciendo nuevamente flagelos, y regresen al comportamiento individual de los organismos unicelulares para encontrar una nueva visión para colonizar.
Pseudomonas aeruginosa es un ejemplo de una bacteria sensora de quórum. P. aeruginosa causa infecciones graves adquiridas en el hospital, infecciones crónicas en personas con fibrosis quística e infecciones potencialmente fatales en quienes están inmunodeprimidos.
1. Cuando P. aeruginosa ingresa por primera vez al cuerpo, se encuentran en una baja densidad de bacterias. Los autoinductores se difunden lejos de las bacterias (Figura\(\PageIndex{3}\).2.2), sufficient quantities of these molecules are unable to bind to the signaling receptors, and the quorum sensing genes that enable the bacteria to act as a population are not activated. The P. aeruginosa continúan funcionando como bacterias individuales. Se expresan genes de motilidad (que codifican flagelos) y genes adhesina (que codifican pili y adhesinas de la pared celular). Los flagelos permiten que las bacterias iniciales naden a través del moco hacia los tejidos del huésped como las membranas mucosas. Los pili luego permiten que las bacterias se unan reversiblemente a las células hospedadoras para resistir el rubor y comenzar la colonización (Figura\(\PageIndex{3}\) .2.6; izquierda). Los pili tipo IV, que permiten una motilidad espasmódica en algunas bacterias, permiten luego que las bacterias a medida que se replican se arrastren y se extiendan sobre las membranas mucosas (Figura\(\PageIndex{3}\) .2.6; medio). Posteriormente, los pili se retraen y las adhesinas de la pared celular bacteriana permiten una unión más íntima de la bacteria a las membranas mucosas (Figura\(\PageIndex{3}\) .2.6; derecha).

2. Una vez que P. aeruginosa ha colonizado, es capaz de replicarse geométricamente y lograr una alta densidad poblacional. Los genes de detección de quórum se activan y las bacterias funcionan como población. Esto desencadena la producción de un polisacárido extracelular llamado alginato para formar microcolonias y permite la unión irreversible a las membranas mucosas (Figura 3.2.7; izquierda). Comienza la formación de biopelículas.
3. Se producen genes de detección de quórum que codifican enzimas y toxinas que dañan las células hospedadoras. Estos se inyectan en las células hospedadoras por medio de un injectosoma. Esto libera nutrientes para las bacterias en la biopelícula. Las bacterias continúan replicándose a medida que la biopelícula continúa desarrollándose, creciendo y madurando (Figura 3.2. 7; medio).
4. A medida que las bacterias se replican, la biopelícula continúa madurando (Figura 3.2. 7; derecha). Se forman canales de agua dentro de la biopelícula para entregar agua, oxígeno y nutrientes a la creciente población de P. aeruginosa. La alta densidad de bacterias bacterias ahora están actuando como una población multicelular en lugar de como bacterias individuales.

La biopelícula permite a las bacterias:
- resistir el ataque por antibióticos;
- atrapar nutrientes para el crecimiento bacteriano y permanecer en un nicho favorable;
- adherirse a las superficies ambientales y resistir el lavado;
- vivir en estrecha asociación y comunicarse con otras bacterias en la biopelícula; y
- resistir la fagocitosis y el ataque por las vías del complemento del cuerpo.
5. Cuando la población de P. aeruginosa comienza a superar su entorno local, la detección de quórum les permite desactivar los genes de adhesina y activar genes de flagelos que permiten que algunas de las bacterias se extiendan fuera de la biopelícula a una nueva ubicación dentro de ese ambiente vía motilidad (Figura \(\PageIndex{3}\).2.8).

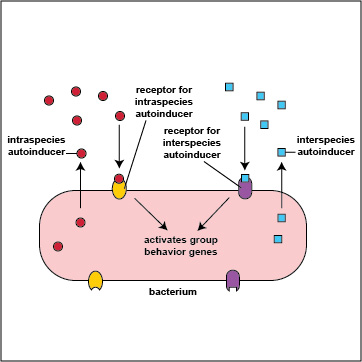
Resulta que las bacterias son multilingües. Utilizan la detección de quórum no sólo para “hablar” con los miembros de su propia especie (comunicación intraespecie), sino también para “hablar” con bacterias que no son de su género y especie (comunicación entre especies). Los autoinductores y receptores intraespecies permiten que las bacterias se comuniquen con otras de su propia especie, mientras que los autoinductores y receptores interespecies permiten que las bacterias se comuniquen con bacterias de una especie o género diferente (Figura\(\PageIndex{3}\) .2.9). Los autoinductores para la comunicación entre especies se denominan autoinductores de la familia AI-2 y son diferentes de los autoinductores intraespecies (AI-1). En algunos casos, las bacterias utilizan la comunicación entre especies para trabajar cooperativamente con otras bacterias en su biopelícula en beneficio de todos los involucrados; en otros casos, las bacterias pueden utilizar la comunicación entre especies de tal manera que un grupo se beneficia a expensas de otro.
Figura\(\PageIndex{3}\) .2.9: Comunicación intraespecias e interespecies. Los autoinductores y receptores intraespecíficos permiten que las bacterias se comuniquen con otras de su propia especie, mientras que los autoinductores y receptores interespecies permiten que las bacterias se comuniquen con bacterias de una especie o género diferente.
Además, las bacterias son capaces de comunicarse entre los reinos, la comunicación entre las bacterias y su hospedador animal o vegetal. Se están encontrando números crecientes de bacterias que tienen receptores de señalización que reconocen las hormonas humanas. Por ejemplo, una serie de bacterias que son patógenos del tracto intestinal humano tienen una molécula sensora llamada QSec que se une a las hormonas humanas adrenalina y noradrenalina. Esto, a su vez, activa diversos genes de virulencia de la bacteria. Por otro lado, algunos autoinductores bacterianos pueden ingresar a las células hospedadoras humanas y regular la función celular humana. Por ejemplo, a baja concentración algunos autoinductores bacterianos suprimen las respuestas inmunes del huésped, permitiendo así que esas bacterias se establezcan mejor en el cuerpo. A altas concentraciones, sin embargo, estimulan una respuesta inflamatoria en el huésped para ayudar a que la bacteria se propague desde el sitio de infección inicial. Se ha encontrado que un autoinductor bacteriano inicia la apoptosis (suicidio celular) en fagocitos como neutrófilos y macrófagos.
Islas de Patogenicidad Bacteriana
Los genomas de bacterias patógenas, cuando se comparan con los de especies o cepas similares no patógenas, a menudo muestran genes extra que codifican factores de virulencia, es decir, moléculas expresadas y secretadas por la bacteria que les permiten colonizar al huésped, evadir o inhibir las respuestas inmunitarias del huésped, entrar dentro o fuera de una célula huésped, y/u obtener nutrición del huésped. Estos incluyen factores de virulencia como cápsulas, adhesinas, sistemas de secreción tipo 3, invasinas y toxinas.
La mayoría de los genes que codifican factores de virulencia en bacterias se localizan en islas de patogenicidad o PAI y generalmente se adquieren por transferencia génica horizontal. Estas PAI pueden estar localizadas en el cromosoma bacteriano, en plásmidos, o incluso en genomas de bacteriófagos que han ingresado a la bacteria. Los genomas de la mayoría de las bacterias patógenas suelen contener múltiples PAI que pueden representar hasta 10 transpoasas, -20% del genoma de la bacteria. Los PAI portan genes como integrasas, o secuencias de inserción que les permiten insertarse en el ADN bacteriano del huésped. Los genes de ARN de transferencia (ARNt) suelen ser el sitio diana para la integración de PAI. Los plásmidos conjugativos son los medios más frecuentes de transferencia de PAI de una bacteria a otra y la transferencia de PAI puede entonces conferir virulencia a una bacteria previamente no patógena.
Sistemas de Secreción Tipo 3 (T3SS o Inyectisomas) y Sistemas de Secreción Tipo 6 (T6SS)
Muchas bacterias involucradas en la infección tienen la capacidad de cooptar las funciones de las células hospedadoras para el propio beneficio de la bacteria. Esto se hace por medio de sistemas de secreciones bacterianas que permiten a la bacteria inyectar directamente moléculas efectoras bacterianas en el citoplasma de la célula hospedadora con el fin de alterar su maquinaria celular o comunicación celular en beneficio de la bacteria.
El tipo más común es el sistema de secreción tipo 3 o T3SS (Figura\(\PageIndex{3}\) .2.10). Un aparato de secreción en la membrana citoplasmática y la pared celular de la bacteria polimeriza una aguja hueca que se baja a la membrana citoplásmica de la célula huésped y luego se suministra una proteína translocon para anclar la aguja a la célula hospedadora. Las proteínas efectoras en la bacteria ahora se pueden inyectar en el citoplasma de la célula huésped. El sistema de administración a veces se llama injectisoma. (Un sistema de secreción tipo 4 puede transferir proteínas efectoras y/o ADN a la célula hospedadora porque es similar al sistema de transferencia de conjugación iniciado por tra genes discutidos en la transferencia horizontal de genes).


Micrografía electrónica de un injectisoma. Imagen de microscopio electrónico de transmisión de complejos aislados de aguja T3SS de Salmonella typhimurium. (CC BY-SA 2.5; Schraidt O, Lefebre MD, Brunner MJ, Schmied WH, Schmidt A, Radics J, Mechtler K, Galán JE, Marlovits TC - Imagen recortada de Schraidt et al. (2010), Topology and Organization of the Salmonella typhimurium Type III Secretion Needle Complex Components. PLoS Patog 6 (4): e1000824. doi:10.1371/journal.ppat.1000824)
Algunas bacterias, como Pseudomonas aeruginosa y Vibrio cholerae, producen un sistema de secreción tipo 6, o T6SS, que consiste en un tubo proteico rodeado por una vaina contráctil, similar a la cola de los bacteriófagos T4 (un bacteriófago es un virus que sólo infecta bacterias). El sistema de secreción tipo 6 no solo inyecta moléculas efectoras en células eucariotas, sino que también es capaz de inyectar moléculas efectoras antibacterianas en otras bacterias para matar esas bacterias. Las bacterias depredadoras pueden usar su T6SS para matar bacterias presa. De hecho, V. cholerae y P. aeruginosa han demostrado “duelo” entre sí a través de sus respectivos T6SS.
V. cholerae también utiliza su T6SS para promover la transferencia horizontal de genes a través de la transformación. Las células individuales de V. cholerae también usan su T6SS para atacarse entre sí al entrar en contacto célula a célula. La mayoría de los miembros de la población, sin embargo, producen proteínas de inmunidad que los protegen de ser destruidos por las moléculas efectoras que se inyectan. No todas las cepas de V. cholerae en la población, sin embargo, producen estas proteínas de inmunidad y estas células no inmunes son posteriormente lisadas, liberando su ADN al ambiente. Este ADN puede entonces ser absorbido por V. cholerae competente vecino a través de la transformación.
Ejercicio: Preguntas de Pensar-Par-Compartir
- Describa brevemente cómo la detección de quórum bacteriano puede desempeñar un papel en la patogenicidad al:
- Promover la colonización de un nuevo hospedador por bacterias que acaban de ingresar al cuerpo.
- Permitir que la bacteria persista dentro de ese hospedador una vez que hayan colonizado.
- Permitir que algunas de las bacterias se propaguen a una nueva ubicación dentro de un huésped o a un nuevo hospedador.
- Describa brevemente cómo la capacidad de producir un sistema de secreción tipo 3 podría desempeñar un papel en un patógeno que coloniza el cuerpo y causa una infección.
Resumen
- La patogenicidad es la capacidad de un microbio para causar enfermedades e infligir daño a su huésped; la virulencia es el grado de patogenicidad dentro de un grupo o especie de microbios.
- La patogenicidad de un organismo está determinada por sus factores de virulencia.
- Los factores de virulencia permiten que esa bacteria colonice al huésped, resista las defensas del cuerpo y dañe el cuerpo.
- La mayoría de los factores de virulencia son los productos de genes sensores de quórum.
- La detección de quórum implica la producción, liberación y detección en toda la comunidad de moléculas llamadas autoinductores que modulan la expresión génica y, en última instancia, el comportamiento bacteriano, en respuesta a la densidad de una población bacteriana.
- Los resultados de la interacción bacteria-huésped suelen estar relacionados con la densidad de población bacteriana.
- A una baja densidad de bacterias, los autoinductores se difunden lejos de las bacterias y hay cantidades insuficientes de estas moléculas para activar los genes sensores de quórum que permiten que las bacterias actúen como población. Como resultado, las bacterias se comportan como organismos individuales, unicelulares.
- Actuar como organismos individuales puede permitir que una baja densidad de bacterias se afiance mejor en su nuevo entorno al permitir que las bacterias usen la motilidad y los taxis para entrar en contacto con las células hospedadoras, usar pili para adherirse inicialmente y arrastrarse sobre las superficies de las células hospedadoras, usar adhesinas para adherirse a las células hospedadoras y resistir el rubor, y secretar un glicocáliz para formar microcolonias.
- A medida que las bacterias aumentan en número geométricamente como resultado de la fisión binaria y alcanzan una alta densidad, se producen grandes cantidades de autoinductores que son capaces de unirse a los receptores de señalización en la superficie bacteriana en cantidad suficiente para activar los genes de detección de quórum que permiten a las bacterias para comportarse ahora como una población multicelular.
- Al comportarse como una población multicelular, las bacterias individuales dentro de un grupo pueden beneficiarse de la actividad de todo el grupo.
- A medida que toda la población de bacterias activa simultáneamente sus genes de virulencia, es mucho menos probable que los sistemas inmunitarios del cuerpo tengan tiempo suficiente para contrarrestar esos factores de virulencia antes de que se haga daño. Los factores de virulencia como exoenzimas y toxinas pueden dañar las células hospedadoras permitiendo que las bacterias en la biopelícula obtengan nutrientes.
- A medida que el área se vuelve superpoblada de bacterias, la detección de quórum permite que algunas de las bacterias escapen de la biopelícula y regresen al comportamiento de los organismos unicelulares individuales para encontrar una nueva visión para colonizar.
- La detección de quórum permite que las bacterias se comuniquen con miembros de su propia especie, con otras especies de bacterias y con sus células hospedadoras eucariotas.
- La mayoría de los genes que codifican factores de virulencia en bacterias se localizan en islas de patogenicidad o PAI y generalmente se adquieren por transferencia génica horizontal.
- Muchas bacterias involucradas en la infección tienen la capacidad de cooptar las funciones de la célula hospedadora para el propio beneficio de la bacteria al producir sistemas de secreciones que permiten a la bacteria inyectar directamente moléculas efectoras bacterianas en el citoplasma de la célula hospedadora para alterar la célula huésped maquinaria, función celular o comunicación celular.