11.3E: Fagocitosis
- Page ID
- 55260
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Objetivos de aprendizaje
- Describa brevemente el papel de los siguientes en relación con la fagocitosis:
- inflamación
- nódulos linfáticos
- ganglios linfáticos
- bazo
- Describa los siguientes pasos en la fagocitosis:
- activación
- quimiotaxis
- fijación (tanto sin mejorar como mejorada)
- ingestión
- destrucción
- Indicar lo que sucede cuando los fagocitos están abrumados con microbios o se adhieren a las células a grandes para ser fagocitados.
- Describir qué causa la mayor parte de la destrucción tisular observada durante las infecciones microbianas.
- Compare los sistemas de destrucción dependientes de oxígeno e independientes del oxígeno de neutrófilos y macrófagos.
- Describa brevemente el papel de la autofagia en la eliminación de microbios intracelulares.

Además, las células de Langerhans (células dendríticas inmaduras) se localizan a lo largo del epitelio de la piel, el tracto respiratorio y el tracto gastrointestinal donde en su forma inmadura están unidas por largos procesos citoplásmicos. Al capturar antígenos a través de pinocitosis y fagocitosis y activarse por citocinas proinflamatorias, las células dendríticas se desprenden del epitelio, ingresan a los vasos linfáticos y se transportan a los ganglios linfáticos regionales. Para cuando ingresan a los ganglios linfáticos, han madurado y ahora son capaces de presentar antígeno a las poblaciones siempre cambiantes de linfocitos T ingenuos localizados en la corteza de los ganglios linfáticos.
El bazo contiene muchas fibras reticulares que soportan macrófagos fijos y células dendríticas, así como poblaciones siempre cambiantes de linfocitos B y linfocitos T circulantes. La sangre transporta microorganismos al bazo donde son filtrados y fagocitados por los macrófagos fijados y células dendríticas y presentados a los linfocitos B y linfocitos T circulantes para iniciar respuestas inmunes adaptativas. También hay macrófagos especializados y células dendríticas localizadas en el cerebro (microglía), pulmones (macrófagos alveolares), hígado (células de Kupffer), riñones (células mesangiales), huesos (osteoclastos), y el tracto gastrointestinal (macrófagos peritoneales).
Los pasos involucrados en la fagocitosis
Hay una serie de etapas distintas involucradas en la fagocitosis:
Paso 1: Activación del fagocito
Los fagocitos en reposo son activados por mediadores inflamatorios como productos bacterianos (proteínas bacterianas, cápsulas, LPS, peptidoglicano, ácidos teicoicos, etc.), proteínas del complemento, citocinas inflamatorias y prostaglandinas. Como resultado, los fagocitos circulantes producen receptores de glicoproteínas superficiales que aumentan su capacidad de adherirse a la superficie interna de las paredes capilares, lo que les permite exprimirse fuera del capilar y ser atraídos hacia el sitio de infección.
Además, producen receptores de reconocimiento de patrones endocíticos que reconocen y se unen a patrones moleculares asociados a patógenos o PAMP, componentes de moléculas microbianas comunes como peptidoglicano, ácidos teicoicos, lipopolisacáridos y glicanos ricos en manosa que no se encuentran en células humanas, para unirse el microbio al fagocito para lo que se llama unión no mejorada (discutido más adelante). También exhiben una mayor actividad metabólica y microbicida al aumentar su producción de ATPs, enzimas lisosómicas, oxidantes letales, etc.
Paso 2: Quimiotaxis de fagocitos (para macrófagos errantes, neutrófilos y eosinófilos)
La quimiotaxis es el movimiento de los fagocitos hacia una concentración creciente de algún atrayente como factores bacterianos (proteínas bacterianas, cápsulas, LPS, peptidoglicano, ácidos teicoicos, etc.), proteínas del complemento (C5a), quimiocinas (citocinas quimiotácticas como la interleucina-8 secretada por diversas células), fibrina productos divididos, quininas y fosfolípidos liberados por células hospedadoras lesionadas.
| Película en la que se muestra la quimiotaxis por neutrófilos. Quimiotaxis de neutrófilos. © De extraños íntimos: vida invisible en la tierra. Creado por Mondo Media. Peter Baker, Productor Ejecutivo. Licencia para su uso, ASM MicrobeLibrary. |
| Animación You Tube que resume la fagocitosis por un macrófago. |
| Película de You Tube que ilustra la quimiotaxis. |
Algunos microbios, como los virus influenza A, Mycobacterium tuberculosis, cepas invasivas sanguíneas de Neisseria gonorrhoeae y Bordetella pertussis han demostrado bloquear la quimiotaxis.
Paso 3: Fijación del Fagocito al Microbio o Célula
La unión de microorganismos es necesaria para la ingestión. El apego puede no mejorarse o mejorarse.

c. Atrapamiento extracelular con TNE: En respuesta a ciertos patrones moleculares asociados a patógenos como el LPS, y ciertas citocinas como la IL-8, los neutrófilos liberan ADN y proteínas granulares antimicrobianas. Estas trampas extracelulares de neutrófilos (NET) se unen a las bacterias, evitan que se propaguen y las matan con proteínas antimicrobianas (ver Figura\(\PageIndex{15}\) y Figura\(\PageIndex{16}\)).
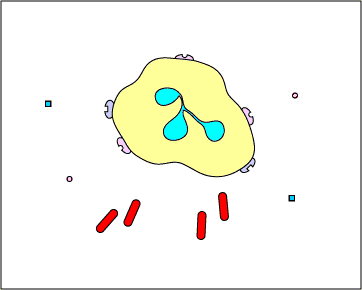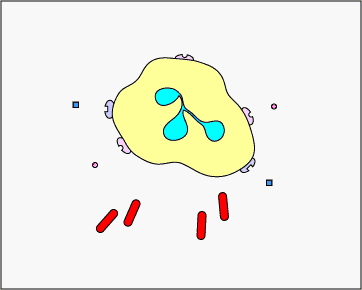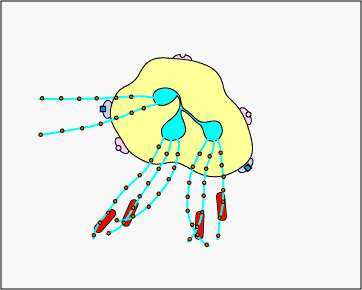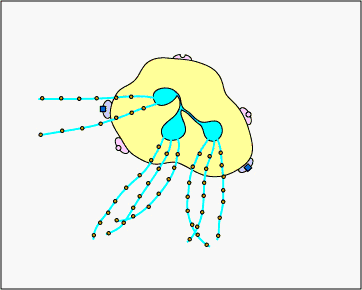
REDES DE Neutrófilos que atrapan y matan bacterias. En respuesta a ciertos patrones moleculares asociados a patógenos como el LPS, y ciertas citocinas como la IL-8, los neutrófilos liberan ADN y proteínas granulares antimicrobianas. Estas trampas extracelulares de neutrófilos (NET) se unen a las bacterias, evitan que se propaguen y las matan con proteínas antimicrobianas como histonas y elastinas. Una hipótesis, mostrada en esta animación, propone que los TNE son producidos por neutrófilos vivos en respuesta a bacterias. Como alternativa, los NET pueden liberarse como resultado de la muerte celular necrótica de neutrófilos.
Algunos microorganismos son más resistentes a la unión fagocítica.
a. Las cápsulas pueden resistir la unión no mejorada al evitar que los receptores de reconocimiento de patrones endocíticos en los fagocitos reconozcan los componentes de la pared celular bacteriana y los carbohidratos que contienen manosa (ver Figura\(\PageIndex{14}\)). Estreptococo. la neumonía activa la vía clásica del complemento, pero resiste la opsonización de C3b, y el complemento causa una mayor inflamación en los pulmones.
Película de una bacteria encapsulada que resiste el engullido por un neutrófilo. Fagocitosis. © James Sullivan, autor. Licencia para su uso, ASM MicrobeLibrary.
b. Algunas cápsulas previenen la formación de C3 convertasa, una enzima temprana en las vías del complemento. Sin esta enzima, no se producen las opsoninas C3b y C4b, así como las otras proteínas beneficiosas.
c. Otras cápsulas, ricas en ácido siálico, un componente común de la glicoproteína de la célula hospedadora, tienen afinidad por la proteína H sérica, una proteína reguladora del complemento que conduce a la degradación de la opsonina C3b por el factor I y la formación de C3 convertasa. (La proteína H sérica es lo que normalmente conduce a la degradación de cualquier C3b que se une a las glicoproteínas del huésped para que no peguemos nuestros propios fagocitos a nuestras propias células con C3b).
d. Algunas cápsulas simplemente cubren el C3b que sí se une a la superficie bacteriana y evitan que el receptor C3b en los fagocitos entre en contacto con el C3b (ver Figura\(\PageIndex{3}\)). Esto se observa con la cápsula de Streptococcus pneumoniae.
e. Neisseria meningitidis tiene una cápsula compuesta por ácido siálico mientras que Streptococcus pyogenes (estreptococos beta del grupo A) tiene una cápsula hecha de ácido hialurónico. Ambos polisacáridos se asemejan mucho a los carbohidratos que se encuentran en los polisacáridos de tejido humano y debido a que no son reconocidos como extraños por los linfocitos que llevan a cabo las respuestas inmunitarias, no se elaboran anticuerpos contra estas cápsulas. De igual manera, algunas bacterias son capaces de cubrirse con proteínas hospedadoras como la fibronectina, lactoferrina o transferrina y de esta manera evitar anticuerpos.
f. Una molécula de membrana externa de Neisseria gonorrhoeae llamada Proteína II y la proteína M de Streptococcus pyogenes permiten que estas bacterias sean más resistentes al engullido fagocítico. La proteína M de S. pyogenes, por ejemplo, se une al factor H de la vía del complemento y esto da como resultado la degradación de la opsonina C3b por el factor I y la formación de C3 convertasa. S. pyogenes también produce una proteasa que escinde la proteína del complemento C5a.
g. Staphylococcus aureus produce proteína A mientras que Streptococcus pyogenes produce proteína G. Ambas proteínas se unen a la porción Fc de los anticuerpos (ver Figura\(\PageIndex{4}\)) y de esta manera las bacterias se recubren con anticuerpos de una manera que no da como resultado opsonización (ver Figura\(\PageIndex{5}\)).
Paso 4: Ingestión del Microbio o Célula por el Fagocito
Después de la unión, la polimerización y luego la despolimerización de los filamentos de actina envían pseudopodos para engullir al microbio (ver Figura\(\PageIndex{6}\)) y colocarlo en una vesícula endocítica llamada fagosoma (ver Figura\(\PageIndex{7}\)).
Durante este proceso, una bomba de electrones trae protones (H +) al fagosoma. Esto disminuye el pH dentro del fagosoma a 3.5 - 4.0 de manera que cuando un lisosoma se fusiona con el fagosoma, el pH es correcto para que las hidrolasas ácidas descompongan eficazmente las proteínas celulares. La acidificación también libera defensinas, catelicidina y proteína inductora de permeabilidad bacteriana (BPI), péptidos y enzimas que pueden matar microbios, de una matriz y permitir su activación.
Micrografías electrónicas de barrido de un macrófago con seudopodos y un macrófago fagocitando E. coli en un vaso sanguíneo ; cortesía de la Microscopía de Dennis Kunkel.
Los microbios intracelulares, como los virus y las bacterias que invaden las células hospedadoras, también pueden ser engullidos una vez que ingresan al citosol de la célula por un proceso llamado autofagia. Un compartimento unido a la membrana llamado autofagosoma crece alrededor del microbio y el citosol circundante y posteriormente lo entrega a los lisosomas para su destrucción (ver Figura\(\PageIndex{17}\)). (Este proceso también es utilizado por las células eucariotas para engullir y degradar componentes celulares innecesarios o disfuncionales como orgánulos dañados).
Algunos microorganismos son más resistentes a la ingestión fagocítica
a. Yersinia patógena, como la que causa la plaga, entra en contacto con los fagocitos y, por medio de un sistema de secreción tipo III, entregan proteínas que despolimerizan los microfilamentos de actina necesarios para el engullido fagocítico en los fagocitos (ver Figura\(\PageIndex{8}\)). Otra proteína Yersinia degrada C3b y C5a.
b. Algunas bacterias, como Mycobacterium tuberculosis, Salmonella y Listeria monocytogenes pueden bloquear la autofagia.
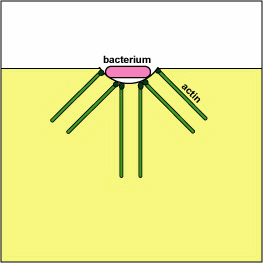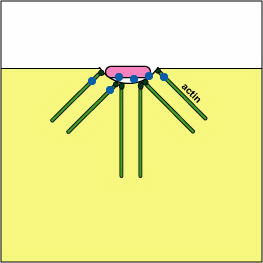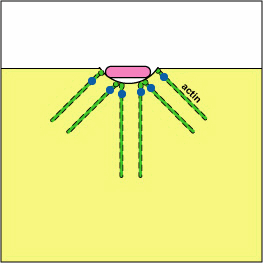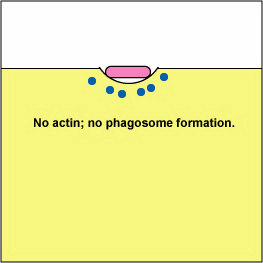
Bloqueo de la Formación de Fagosomas por Despolimerización de Acina. Las moléculas de algunas bacterias, a través de un sistema de secreción tipo III, entregan proteínas que despolimerizan los microfilamentos de actina del fagocito utilizados para el engullido fagocítico.
Paso 5: Destrucción del Microbio o CélulaLos fagocitos contienen sacos membranosos llamados lisosomas producidos por el aparato de Golgi que contienen diversas enzimas digestivas, productos químicos microbicidas y radicales de oxígeno tóxicos. Los lisosomas viajan a lo largo de los microtúbulos dentro del fagocito y se fusionan con los fagosomas que contienen los microbios ingeridos y los microbios se destruyen (ver Figura\(\PageIndex{9}\)).
Para ver una micrografía electrónica de un fagolisosoma, consulte la página web de la Facultad de Medicina de la Universidad de Illinois.
| Animación 3D que ilustra orgánulos moviéndose a lo largo de un microtúbulo. De Graham Johnson, Quinto Elemento. Esta animación tarda algún tiempo en descargarse. |
| Animación You Tube que resume la fagocitosis por un macrófago. |
Algunas bacterias son más resistentes a la destrucción fagocítica una vez envueltas.
a. Algunas bacterias, como las especies Legionella pneumophilia y Mycobacterium, hacen que la célula fagocítica las coloque en una vacuola endocítica a través de una vía que disminuye su exposición a compuestos tóxicos de oxígeno.
b. Algunas bacterias, como la Salmonella, son más resistentes a las formas tóxicas de oxígeno y a las defensinas (péptidos tóxicos que matan bacterias).
c. Algunas bacterias, como Shigella flexneri y la fiebre manchada Rickettsia, escapan del fagosoma al citoplasma antes de que el fagosoma se fusione con un lisosoma (ver Figura\(\PageIndex{10}\)).
d. Neisseria gonorrhoeae produce proteína Por (proteína I) que evita que los fagosomas se fusionen con lisosomas permitiendo que las bacterias sobrevivan dentro de los fagocitos.
e. Algunas bacterias, como especies de Salmonella, Mycobacterium, Legionella y Chlamydia, bloquean la maquinaria de transporte vesicular que permite que el fagosoma se fusione con el lisosoma.
f. algunas bacterias, como Mycobacterium patógenas y Legionella pneumophilia, previenen la acidificación del fagosoma que es necesaria para la destrucción efectiva de microbios por enzimas lisosómicas. (Normalmente después de que se forma el fagosoma, el contenido se acidifica porque las enzimas lisosómicas utilizadas para matar funcionan de manera mucho más efectiva a un pH ácido).
g. Los pigmentos carotenoides que dan a Staphylococcus aureus su color dorado y a los estreptococos del grupo B (GBS) su tinte naranja protegen a las bacterias de los oxidantes tóxicos que los neutrófilos utilizan para matar bacterias.
h. Los lípidos de la pared celular de Mycobacterium tuberculosis, como el lipoarabinomanano, detienen la maduración de los fagosomas impidiendo la entrega de la bacteria a los lisosomas.
i. Algunas bacterias son capaces de matar los fagocitos. Bacterias como Staphylococcus aureus y Streptococcus pyogenes producen la exotoxina leucocidina que daña la membrana citoplasmática del fagocito. Por otro lado, bacterias, como Shigella y Salmonella, inducen apoptosis de macrófagos, una muerte celular programada.
Si el sitio de infección contiene un gran número de microorganismos y se están produciendo altos niveles de citocinas inflamatorias y quimiocinas en respuesta a las PAMP, el fagocito vaciará el contenido de sus lisosomas mediante un proceso llamado desgranulación con el fin de matar los microorganismos o células. extracelularmente.
Estos contenidos lisosómicos liberados, sin embargo, también matan las células hospedadoras circundantes y el tejido. La mayor parte de la destrucción tisular asociada a infecciones es el resultado de este proceso (ver Figura\(\PageIndex{11}\)).
El fagocito también vaciará el contenido de sus lisosomas para la destrucción extracelular si la célula a la que se adhiere el fagocito es demasiado grande para ser engullida (ver Figura\(\PageIndex{12}\) y Figura\(\PageIndex{13}\)).
Hay 2 sistemas de destrucción en neutrófilos y macrófagos: el sistema dependiente de oxígeno y el sistema independiente de oxígeno.
1. El sistema dependiente de oxígeno: producción de especies reactivas de oxígeno (ROS)
La membrana citoplasmática de los fagocitos contiene la enzima oxidasa que convierte el oxígeno en anión superóxido (O 2-). Esto se puede combinar con el agua por medio de la enzima dismutasa para formar peróxido de hidrógeno (H 2 O 2) y radicales hidroxilo (OH).
En el caso de neutrófilos, pero no macrófagos, el peróxido de hidrógeno puede entonces combinarse con iones cloruro (Cl 2-) por la acción de la enzima mieloperoxidasa (MPO) para formar ácido hipocloroso (HOCL), y oxígeno singlete.
En los macrófagos, el óxido nítrico (NO) puede combinarse con el peróxido de hidrógeno para formar radicales peroxinitrito. (Además de ROS y NO, los macrófagos secretan citocinas inflamatorias como TNF-alfa, IL-1, IL-8 e IL-12 para promover una respuesta inflamatoria).
Estos compuestos son muy microbicidas porque son poderosos agentes oxidantes que oxidan la mayoría de los grupos químicos que se encuentran en proteínas, enzimas, carbohidratos, ADN y lípidos. La oxidación lipídica puede descomponer las membranas citoplásmicas. Colectivamente, estos radicales libres oxidantes se denominan especies reactivas de oxígeno (ROS).
La oxidasa también actúa como una bomba de electrones que trae protones (H +) al fagosoma. Esto disminuye el pH dentro del fagosoma de manera que cuando los lisosomas se fusionan con el fagosoma, el pH es correcto para que las hidrolasas ácidas, como la elastasa, descompongan eficazmente las proteínas celulares.
Además de que los fagocitos utilizan este sistema dependiente de oxígeno para matar microbios intracelularmente, los neutrófilos también liberan rutinariamente estos agentes oxidantes, así como hidrolasas ácidas, con el propósito de matar microbios extracelularmente. Estos agentes, sin embargo, también terminan matando a los propios neutrófilos así como a algunas células y tejidos circundantes del cuerpo como se mencionó anteriormente.
2. El sistema independiente del oxígeno
Algunos lisosomas contienen defensinas), péptidos catiónicos que alteran las membranas citoplásmicas; lisozima, una enzima que descompone peptidoglicano, lactoferrina, una proteína que priva a las bacterias del hierro necesario; catepsina G, una proteasa que causa daño a las membranas microbianas; elastasa, una proteasa que mata muchos tipos de bacterias; catelicidinas, proteínas que tras la escisión son directamente tóxicas para una variedad de microorganismos; proteína inductora de permeabilidad bactericida (BPI), proteínas utilizadas por los neutrófilos para matar ciertas bacterias dañando sus membranas; colagenasa; y varias otras enzimas digestivas que exhiben actividad antimicrobiana al descomponer proteínas, ARN, compuestos de fosfato, lípidos e hidratos de carbono.
Ejercicio: Preguntas de Pensar-Par-Compartir
- Streptococcus pyogenes tiene una cápsula hecha de ácido hialurónico, un polisacárido que también se encuentra en las células humanas.
Describir qué importancia tiene esto en la bacteria resistente a la fagocitosis y por qué.
- Streptococcus pyogenes produce una proteína llamada proteína G que se une a la porción Fc de la IgG humana.
Describir qué importancia tiene esto en la bacteria resistente a la fagocitosis y por qué.
- Muchas bacterias producen cápsulas que cubren su pared celular.
Describir qué importancia tiene esto en la bacteria resistente a la fagocitosis y por qué.
- Las personas nacidas con enfermedad granulomatiosa crónica tienen neutrófilos que carecen de la enzima oxidasa en su membrana citoplásmica.
Describir qué importancia tiene esto en la bacteria resistente a la fagocitosis y por qué.
Resumen
La fagocitosis es el método principal utilizado por el cuerpo para eliminar microorganismos libres en la sangre y los fluidos tisulares. Una respuesta inflamatoria a una lesión y/o infección permite que los fagocitos salgan del torrente sanguíneo, ingresen al tejido e ingresen al sitio de infección o lesión. Los microorganismos que ingresan a los nódulos linfáticos que se encuentran en el tracto respiratorio, gastrointestinal y genitourinario pueden ser fagocitados por macrófagos fijos y células dendríticas y presentados a linfocitos B y linfocitos T para iniciar respuestas inmunes adaptativas.El líquido tisular recoge microbios en el tejido, ingresa al vasos linfáticos como linfa, y transporta los microbios a los ganglios linfáticos regionales donde son filtrados y fagocitados por macrófagos fijos y células dendríticas y presentados a los linfocitos B circulantes y linfocitos T para iniciar respuestas inmunes adaptativas.
Las células dendríticas localizadas a lo largo del epitelio de la piel, el tracto respiratorio y el tracto gastrointestinal fagocitan microbios, ingresan a los vasos linfáticos y transportan los microbios a los ganglios linfáticos regionales donde las células dendríticas presentan antígenos asociados con los microbios a las poblaciones siempre cambiantes de Linfocitos T ingenuos.La sangre transporta microorganismos al bazo donde son filtrados y fagocitados por macrófagos fijos y células dendríticas y se presentan a los linfocitos B y linfocitos T circulantes para iniciar respuestas inmunes adaptativas. También hay macrófagos especializados y células dendríticas localizadas en el cerebro (microglía), pulmones (macrófagos alveolares), hígado (células de Kupffer), riñones (células mesangiales), huesos (osteoclastos), y el tracto gastrointestinal (macrófagos peritoneales).
- Los fagocitos en reposo son activados por mediadores inflamatorios y producen receptores superficiales que aumentan su capacidad de adherirse a la superficie interna de las paredes capilares permitiéndoles exprimirse fuera del capilar y entrar en el tejido, un proceso llamado diapedesis.
- La activación también permite a los fagocitos producir receptores de reconocimiento de patrones endocíticos que reconocen y se unen a PAMP microbianos para unir el microbio al fagocito, así como para exhibir una mayor actividad metabólica y microbicida.
- Los fagocitos luego usan la quimiotaxis para avanzar hacia una concentración creciente de algún atrayente como factores bacterianos o moléculas de defensa.
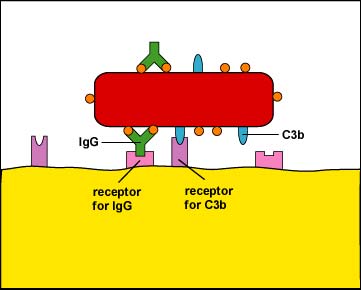
- La unión de los fagocitos a los microbios o células puede ser a través de una unión no mejorada o una unión mejorada.
- La unión no mejorada es el reconocimiento de patrones moleculares asociados a patógenos o PAMP por receptores de reconocimiento de patrones endocíticos en la superficie de los fagocitos.
- La unión mejorada, u opsonización, es la unión de microbios a fagocitos por medio de una molécula de anticuerpo llamada IgG, las proteínas del complemento C3b y C4b, y proteínas de fase aguda como lectina de unión a manosa (MBL) y proteína C reactiva (CRP).
- Después de la unión, la polimerización y luego la despolimerización de los filamentos de actina envían pseudopodos para engullir al microbio y colocarlo en una vesícula endocítica llamada fagosoma.
- Durante este proceso, una bomba de electrones lleva protones (H+) al fagosoma para disminuir el pH dentro del fagosoma a un pH que es correcto para que las hidrolasas ácidas descompongan eficazmente las proteínas celulares.
- Los fagocitos contienen sacos membranosos llamados lisosomas que contienen diversas enzimas digestivas, químicos microbicidas y radicales de oxígeno tóxicos. Los lisosomas se fusionan con los fagosomas que contienen los microbios ingeridos y los microbios se destruyen.
- Si el sitio de infección contiene un gran número de microorganismos y se están produciendo altos niveles de citocinas inflamatorias y quimiocinas en respuesta a las PAMP, el fagocito vaciará el contenido de sus lisosomas para matar a los microorganismos o células extracelularmente.
- Los contenidos lisosómicos liberados durante la destrucción extracelular también matan las células hospedadoras circundantes y el tejido La mayor parte de la destrucción tisular asociada con infecciones es el resultado de la destrucción extracelular por fagocitos.


