8.2: Catabolismo de Carbohidratos
- Page ID
- 54716
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Objetivos de aprendizaje
- Describir por qué la glucólisis no es dependiente del oxígeno
- Definir y describir el rendimiento neto de moléculas de tres carbonos, ATP y NADH a partir de la glucólisis
- Explique cómo las moléculas de piruvato de tres carbonos se convierten en grupos acetilo de dos carbonos que pueden canalizarse al ciclo de Krebs.
- Definir y describir el rendimiento neto de CO 2, GTP/ATP, FADH 2 y NADH del ciclo de Krebs
- Explicar cómo las moléculas intermedias de carbono del ciclo de Krebs pueden ser utilizadas en una célula
Existen extensas vías enzimáticas para descomponer los carbohidratos y capturar energía en los enlaces ATP. Además, muchas vías catabólicas producen moléculas intermedias que también se utilizan como bloques de construcción para el anabolismo. Comprender estos procesos es importante por varias razones. Primero, debido a que los principales procesos metabólicos involucrados son comunes a una amplia gama de organismos quimioheterótrofos, podemos aprender mucho sobre el metabolismo humano estudiando el metabolismo en bacterias más fáciles de manipular como E. coli. Segundo, debido a que los patógenos animales y humanos también son quimioheterótrofos, conocer los detalles del metabolismo en estas bacterias, incluidas las posibles diferencias entre las vías bacterianas y humanas, es útil para el diagnóstico de patógenos así como para el descubrimiento de terapias antimicrobianas dirigidas patógenos específicos. Por último, aprender específicamente sobre las vías involucradas en el metabolismo quimioheterotrófico también sirve como base para comparar otras estrategias metabólicas más inusuales utilizadas por los microbios. Aunque la fuente química de electrones que inician la transferencia de electrones es diferente entre quimioheterorofos y quimioautótrofos, muchos procesos similares se utilizan en ambos tipos de organismos.
El ejemplo típico utilizado para introducir conceptos de metabolismo a los estudiantes es el catabolismo de carbohidratos. Para los quimioheterótrofos, nuestros ejemplos de metabolismo comienzan con el catabolismo de polisacáridos como el glucógeno, el almidón o la celulosa. Enzimas como la amilasa, que descompone el glucógeno o el almidón, y las celulasas, que descomponen la celulosa, pueden provocar la hidrólisis de los enlaces glicosídicos entre los monómeros de glucosa en estos polímeros, liberando glucosa para un mayor catabolismo.
Glicólisis
Para las bacterias, eucariotas y la mayoría de las arqueas, la glucólisis es la vía más común para el catabolismo de la glucosa; produce energía, portadores de electrones reducidos y moléculas precursoras para el metabolismo celular. Todo organismo vivo lleva a cabo alguna forma de glucólisis, sugiriendo que este mecanismo es un antiguo proceso metabólico universal. El proceso en sí no usa oxígeno; sin embargo, la glucólisis se puede acoplar con procesos metabólicos adicionales que son aeróbicos o anaeróbicos. La glucólisis tiene lugar en el citoplasma de células procariotas y eucariotas. Comienza con una sola molécula de glucosa de seis carbonos y termina con dos moléculas de un azúcar de tres carbonos llamado piruvato. El piruvato puede descomponerse aún más después de la glucólisis para aprovechar más energía a través de la respiración aeróbica o anaeróbica, pero muchos organismos, incluidos muchos microbios, pueden ser incapaces de respirar; para estos organismos, la glucólisis puede ser su única fuente de generación de ATP.
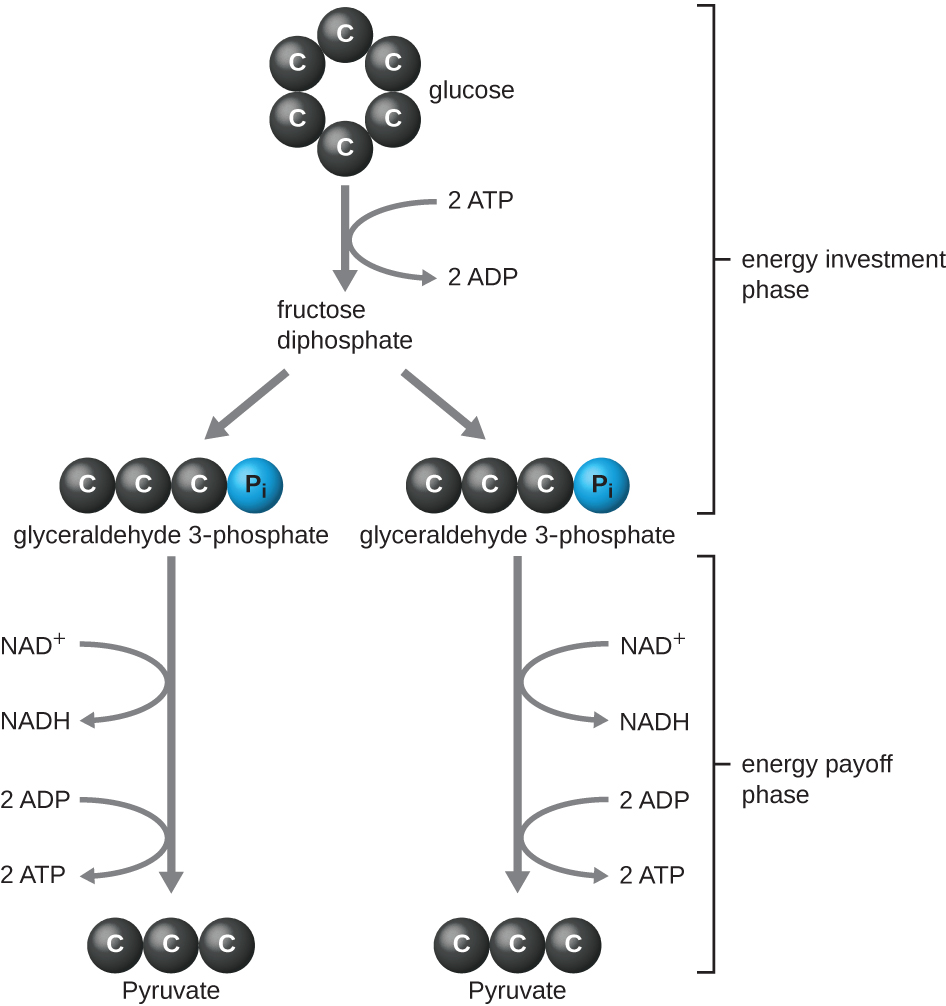
El tipo de glucólisis que se encuentra en los animales y que es más común en los microbios es la vía Embden-Meyerhof-Parnas (EMP), llamada así por Gustav Embden (1874-1933), Otto Meyerhof (1884—1951) y Jakub Parnas (1884—1949). La glucólisis mediante la vía EMP consiste en dos fases distintas (Figura\(\PageIndex{1}\)). La primera parte de la vía, llamada fase de inversión de energía, utiliza la energía de dos moléculas de ATP para modificar una molécula de glucosa de manera que la molécula de azúcar de seis carbonos se pueda dividir uniformemente en dos moléculas de tres carbonos fosforiladas llamadas gliceraldehído 3-fosfato (G3P). La segunda parte de la vía, llamada fase de pago de energía, extrae energía oxidando G3P a piruvato, produciendo cuatro moléculas de ATP y reduciendo dos moléculas de NAD + a dos moléculas de NADH, utilizando electrones que se originaron a partir de la glucosa. (Una discusión e ilustración de la ruta completa de EMP con estructuras químicas y nombres enzimáticos aparecen en el Apéndice C.)
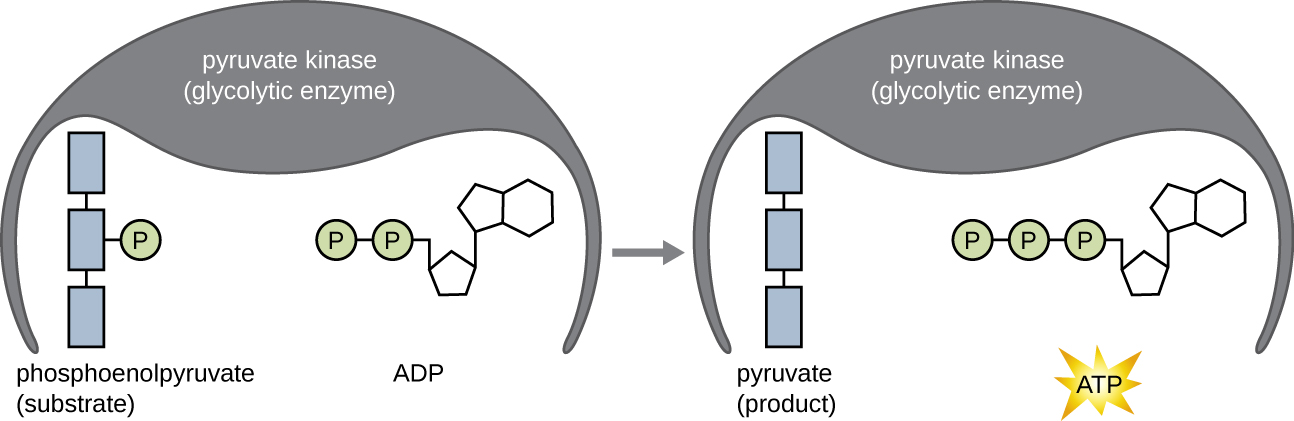
Las moléculas de ATP producidas durante la fase de recuperación de energía de la glucólisis se forman por fosforilación a nivel de sustrato (Figura\(\PageIndex{1}\)), uno de los dos mecanismos para producir ATP. En la fosforilación a nivel de sustrato, se elimina un grupo fosfato de una molécula orgánica y se transfiere directamente a una molécula de ADP disponible, produciendo ATP. Durante la glucólisis, los grupos fosfato de alta energía de las moléculas intermedias se agregan al ADP para producir ATP.
En general, en este proceso de glucólisis, la ganancia neta de la descomposición de una sola molécula de glucosa es:
- dos moléculas de ATP
- dos moléculas NADH, y
- dos moléculas de piruvato.
Otras vías glicolíticas
Cuando nos referimos a la glucólisis, a menos que se indique lo contrario, nos estamos refiriendo a la vía EMP utilizada por animales y muchas bacterias. Sin embargo, algunos procariotas utilizan vías glicolíticas alternativas. Una alternativa importante es la vía Entner-Doudoroff (ED), que lleva el nombre de sus descubridores Nathan Entner y Michael Doudoroff (1911—1975). Aunque algunas bacterias, incluido el patógeno gramnegativo oportunista Pseudomonas aeruginosa, contienen solo la vía ED para la glucólisis, otras bacterias, como E. coli, tienen la capacidad de usar ya sea la vía ED o la vía EMP.
Un tercer tipo de vía glicolítica que ocurre en todas las células, que es bastante diferente de las dos vías anteriores, es la vía de pentosa fosfato (PPP) también llamada vía fosfogluconato o derivación de hexosa monofosfato. La evidencia sugiere que el PPP puede ser la vía glicolítica universal más antigua. Los intermedios del PPP se utilizan para la biosíntesis de nucleótidos y aminoácidos. Por lo tanto, esta vía glicolítica puede ser favorecida cuando la célula tiene necesidad de síntesis de ácidos nucleicos y/o proteínas, respectivamente. Una discusión e ilustración de la vía completa de ED y PPP con estructuras químicas y nombres enzimáticos aparecen en el Apéndice C.
Ejercicio\(\PageIndex{1}\)
¿Cuándo podría un organismo utilizar la vía ED o el PPP para la glucólisis?
Reacción de transición, coenzima A y ciclo de Krebs
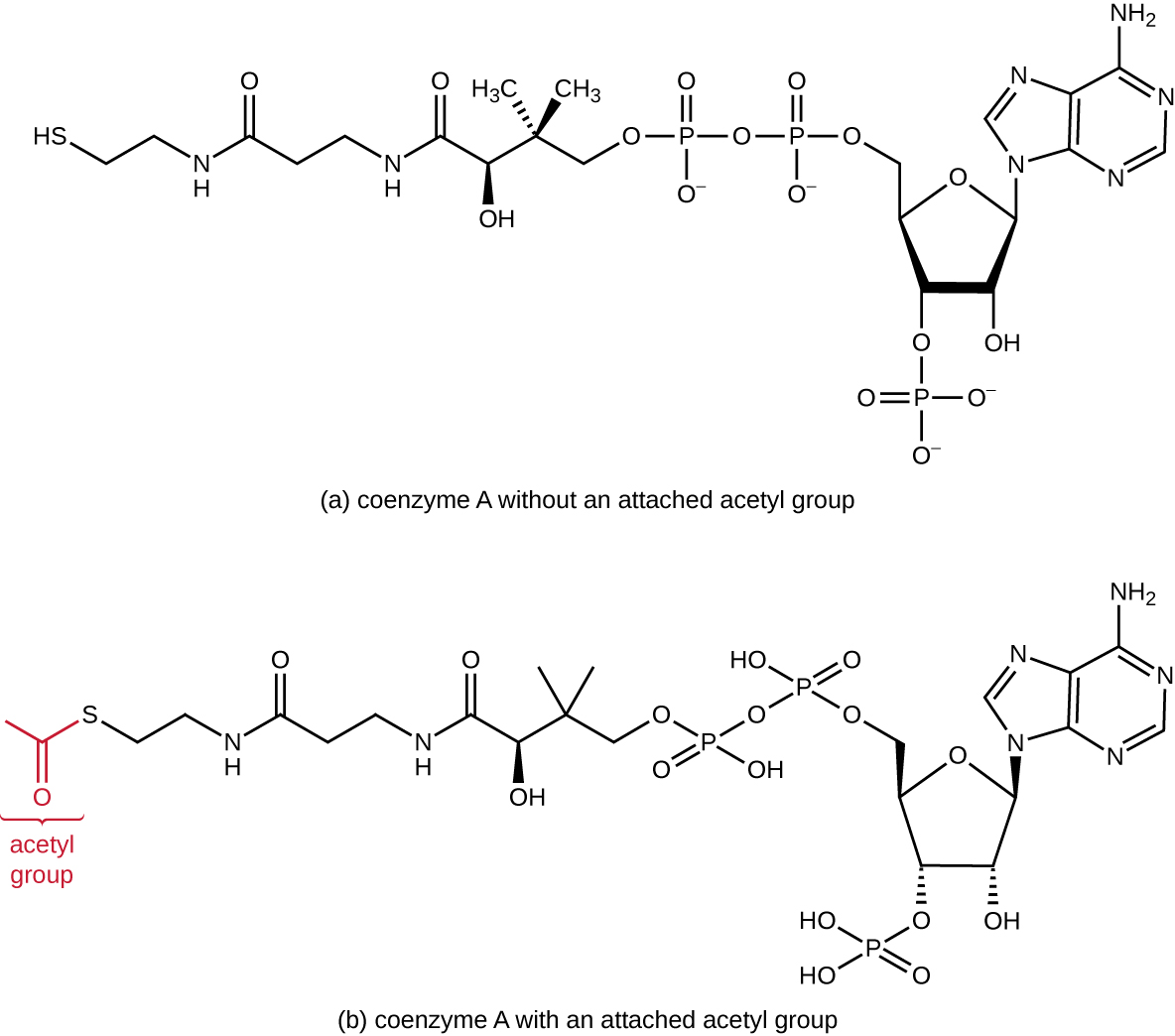
La glucólisis produce piruvato, que puede oxidarse aún más para capturar más energía. Para que el piruvato entre en la siguiente vía oxidativa, primero debe ser descarboxilado por el complejo enzimático piruvato deshidrogenasa a un grupo acetilo de dos carbonos en la reacción de transición, también llamada reacción puente (ver Apéndice C y Figura\(\PageIndex{3}\)). En la reacción de transición, los electrones también se transfieren a NAD + para formar NADH. Para pasar a la siguiente fase de este proceso metabólico, el acetilo de dos carbonos comparativamente pequeño debe unirse a un compuesto portador muy grande llamado coenzima A (CoA). La reacción de transición ocurre en la matriz mitocondrial de los eucariotas; en los procariotas, ocurre en el citoplasma debido a que los procariotas carecen de orgánulos encerrados en la membrana.
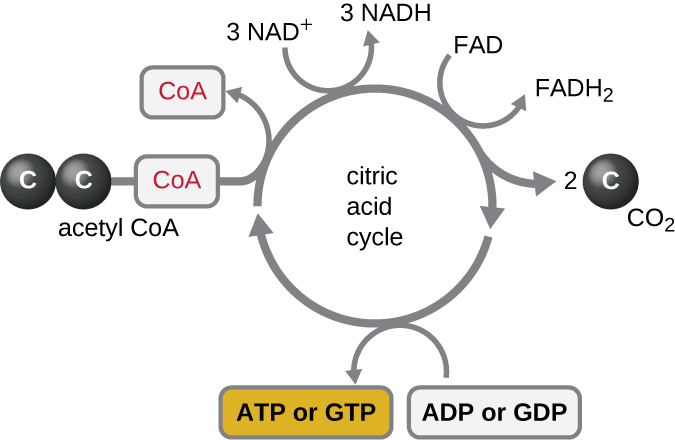
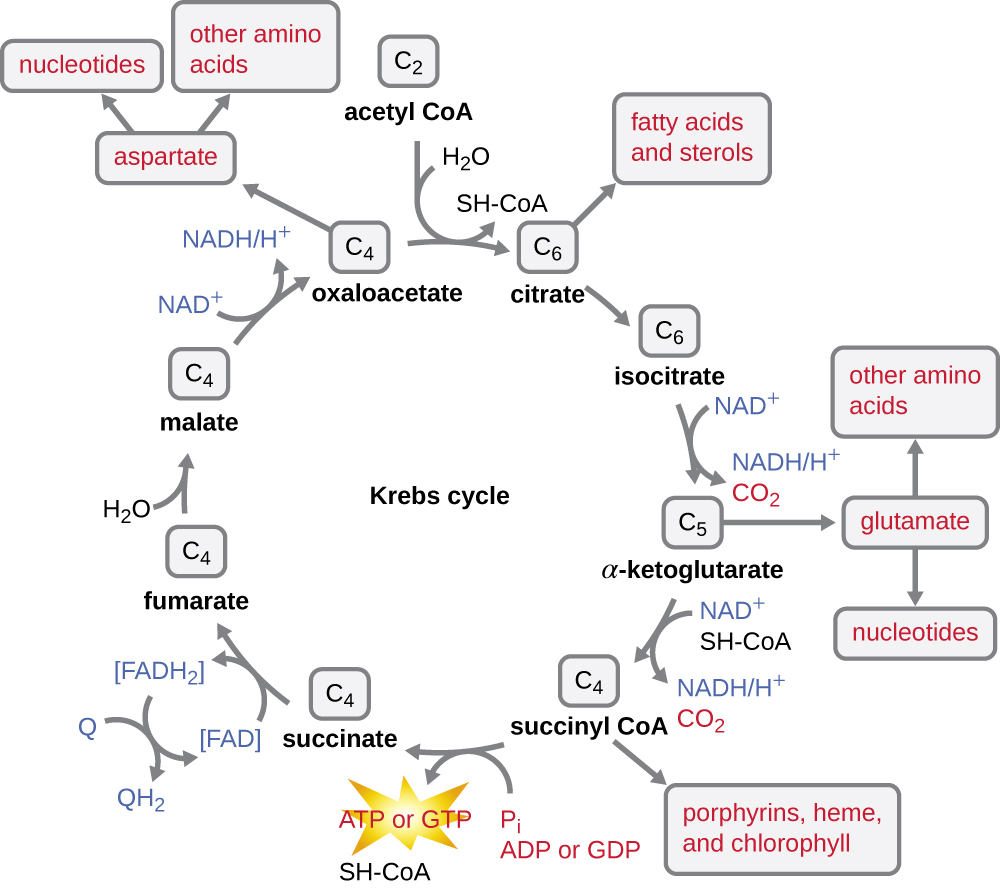
El ciclo de Krebs transfiere los electrones restantes del grupo acetilo producido durante la reacción de transición a moléculas portadoras de electrones, reduciéndolos así. El ciclo de Krebs también ocurre en el citoplasma de procariotas junto con la glucólisis y la reacción de transición, pero tiene lugar en la matriz mitocondrial de células eucariotas donde también se produce la reacción de transición. El ciclo de Krebs lleva el nombre de su descubridor, el científico británico Hans Adolf Krebs (1900—1981) y también se le llama el ciclo del ácido cítrico, o el ciclo del ácido tricarboxílico (TCA) porque el ácido cítrico tiene tres grupos carboxilo en su estructura. A diferencia de la glucólisis, el ciclo de Krebs es un ciclo cerrado: La última parte de la vía regenera el compuesto utilizado en el primer paso (Figura\(\PageIndex{4}\)). Los ocho pasos del ciclo son una serie de reacciones químicas que capturan el grupo acetilo de dos carbonos (el portador CoA no ingresa al ciclo de Krebs) de la reacción de transición, que se agrega a un intermedio de cuatro carbonos en el ciclo de Krebs, produciendo el ácido cítrico intermedio de seis carbonos (dando el nombre alternativo para este ciclo). A medida que un giro del ciclo vuelve al punto de partida del intermedio de cuatro carbonos, el ciclo produce dos moléculas de CO 2, una molécula de ATP (o un equivalente, como el trifosfato de guanosina [GTP]) producida por fosforilación a nivel de sustrato, y tres moléculas de NADH y una de FADH 2 . (Una discusión e ilustración detallada del ciclo completo de Krebs aparecen en el Apéndice C.)
Aunque muchos organismos utilizan el ciclo de Krebs como se describe como parte del metabolismo de la glucosa, varios de los compuestos intermedios en el ciclo de Krebs se pueden usar para sintetizar una amplia variedad de moléculas celulares importantes, incluyendo aminoácidos, clorofilas, ácidos grasos y nucleótidos; por lo tanto, el ciclo es tanto anabólicos como catabólicos (Figura\(\PageIndex{5}\)).
Conceptos clave y resumen
- La glucólisis es el primer paso en la descomposición de la glucosa, dando como resultado la formación de ATP, que se produce por fosforilación a nivel de sustrato; NADH; y dos moléculas de piruvato. La glucólisis no usa oxígeno y no es dependiente del oxígeno.
- Después de la glucólisis, un piruvato de tres carbonos es descarboxilado para formar un grupo acetilo de dos carbonos, acoplado con la formación de NADH. El grupo acetilo está unido a un compuesto portador grande llamado coenzima A.
- Después de la etapa de transición, la coenzima A transporta el acetilo de dos carbonos al ciclo de Krebs, donde los dos carbonos ingresan al ciclo. Por giro del ciclo, un grupo acetilo derivado de la glucólisis se oxida adicionalmente, produciendo tres moléculas de NADH, una FADH 2 y una ATP por fosforilación a nivel de sustrato, y liberando dos moléculas de CO 2.
- El ciclo Krebs puede ser utilizado para otros fines. Muchos de los intermedios se utilizan para sintetizar moléculas celulares importantes, incluyendo aminoácidos, clorofilas, ácidos grasos y nucleótidos.


