19.1: Hipersensibilidad
- Page ID
- 54577
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Objetivos de aprendizaje
- Identificar y comparar las características distintivas, los mecanismos y los principales ejemplos de hipersensibilidad tipo I, II, III y IV
Enfoque Clínico: Parte 1
Kerry, una piloto de aerolínea de 40 años, ha concertado una cita con su médico de atención primaria para hablar sobre un sarpullido que se desarrolla cada vez que pasa tiempo bajo el sol. Según explica a su médico, no parece quemadura solar. Ella tiene cuidado de no pasar demasiado tiempo al sol y usa protector solar. A pesar de estas precauciones, el sarpullido sigue apareciendo, manifestándose como manchas rojas, levantadas que se vuelven ligeramente escamosas. El sarpullido persiste de 7 a 10 días cada vez, y parece desaparecer en gran medida por sí solo. Últimamente, las erupciones también han comenzado a aparecer en sus mejillas y por encima de sus ojos a cada lado de su frente.
Ejercicio\(\PageIndex{1}\)
- ¿Kerry tiene razón en estar preocupada, o simplemente debería tener más cuidado con la exposición al sol?
- ¿Hay condiciones que puedan ser provocadas por la exposición al sol que el médico de Kerry debería estar considerando?
En las Defensas Adaptativas Específicas de Huésped se discutieron los mecanismos por los cuales las defensas inmunitarias adaptativas, tanto humorales como celulares, nos protegen de las enfermedades infecciosas. Sin embargo, estas mismas defensas inmunitarias protectoras también pueden ser responsables de reacciones indeseables llamadas reacciones de hipersensibilidad. Las reacciones de hipersensibilidad se clasifican por su mecanismo inmune.
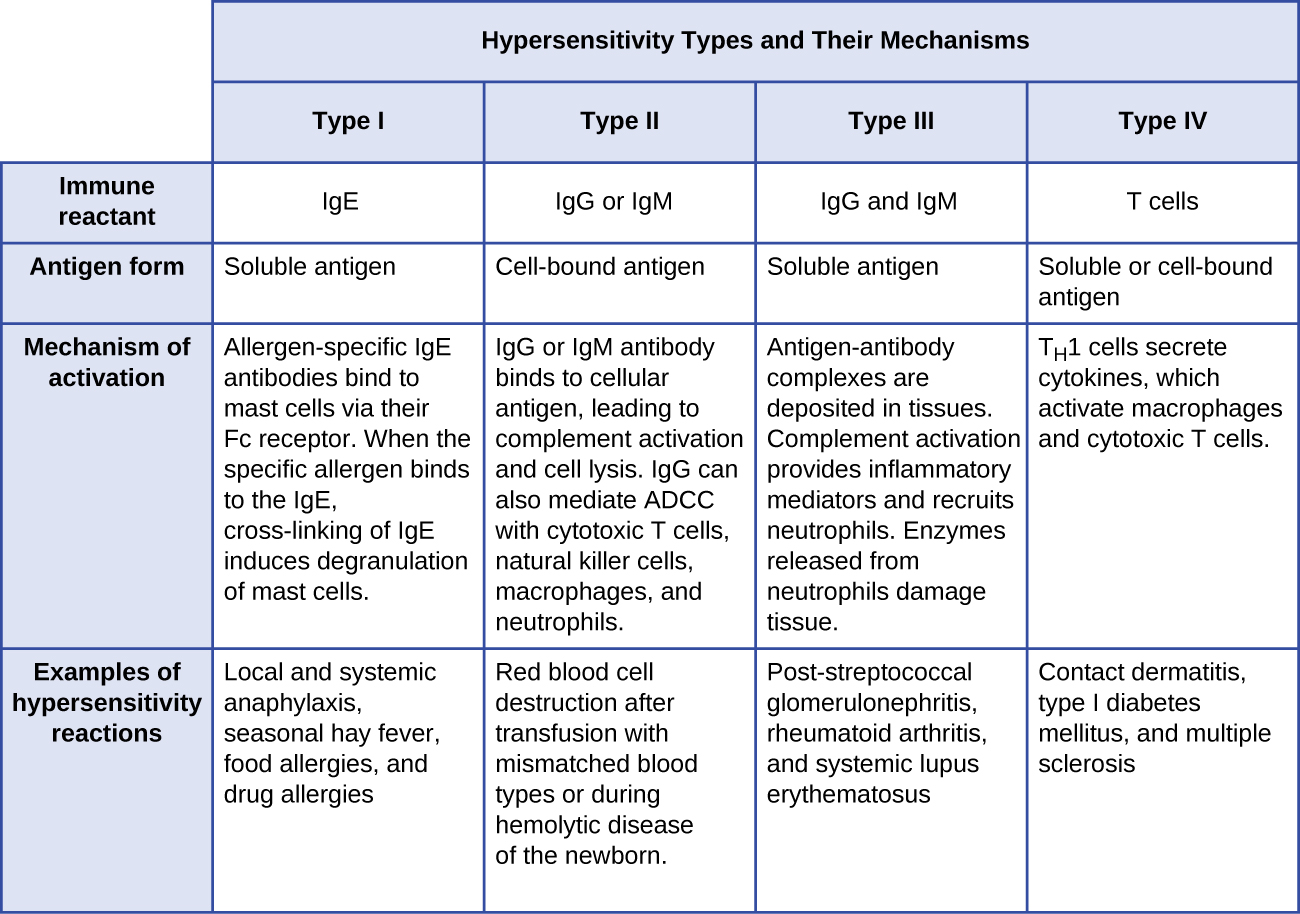
- Las reacciones de hipersensibilidad tipo I involucran anticuerpo de inmunoglobulina E (IgE) contra antígeno soluble, desencadenando la desgranulación de mastocitos.
- Las reacciones de hipersensibilidad tipo II involucran anticuerpos IgG e IgM dirigidos contra antígenos celulares, lo que lleva al daño celular mediado por otros efectores del sistema inmune.
- Las reacciones de hipersensibilidad tipo III implican las interacciones de anticuerpos IgG, IgM y, ocasionalmente, IgA 1 con antígeno para formar complejos inmunes. La acumulación de complejos inmunes en el tejido conduce al daño tisular mediado por otros efectores del sistema inmune.
- Las reacciones de hipersensibilidad tipo IV son reacciones mediadas por células T que pueden implicar daño tisular mediado por macrófagos activados y células T citotóxicas.
Hipersensibilidades Tipo I
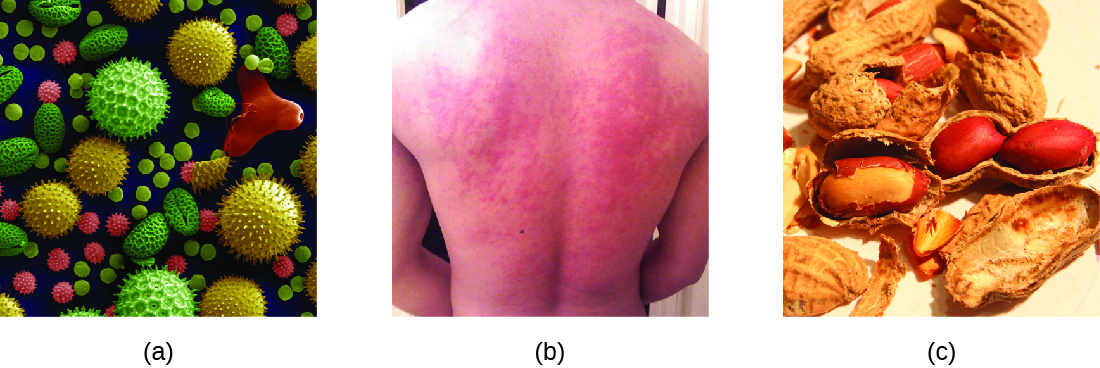
Cuando un individuo presensibilizado se expone a un alérgeno, puede conducir a una respuesta inmune rápida que ocurre casi de inmediato. Tal respuesta se llama alergia y se clasifica como hipersensibilidad tipo I. Los alérgenos pueden ser sustancias aparentemente inofensivas como caspa de animales, mohos o polen. Los alérgenos también pueden ser sustancias consideradas de manera innata más peligrosas, como el veneno de insectos o las drogas terapéuticas. Las intolerancias alimentarias también pueden producir reacciones alérgicas a medida que los individuos se sensibilizan a alimentos como el maní o los mariscos (Figura\(\PageIndex{1}\)). Independientemente del alérgeno, la primera exposición activa una respuesta primaria de anticuerpos IgE que sensibiliza a un individuo a la reacción de hipersensibilidad tipo I tras la exposición posterior.
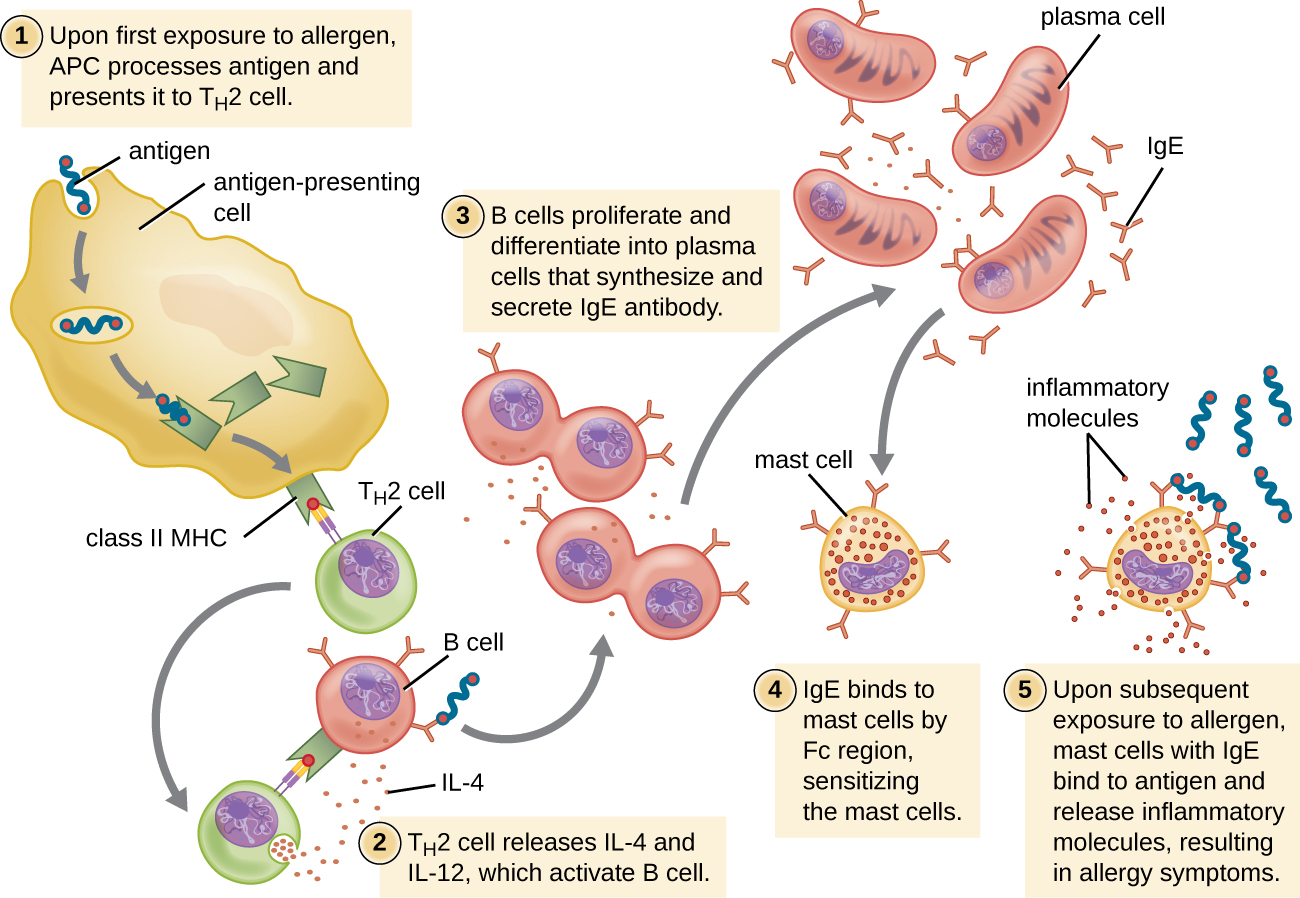
Para individuos susceptibles, una primera exposición a un alérgeno activa una fuerte respuesta de células T H 2 (Figura\(\PageIndex{2}\)). Las citocinas interleucina (IL) -4 e IL-13 de las células T H 2 activan a las células B específicas del mismo alérgeno, dando como resultado la proliferación clonal, la diferenciación en células plasmáticas y el cambio de clase de anticuerpos de la producción de IgM a la producción de IgE. Las regiones de fragmentos cristalizables (Fc) de los anticuerpos IgE se unen a receptores específicos en la superficie de los mastocitos en todo el cuerpo. Se estima que cada mastocito puede unirse hasta 500,000 moléculas de IgE, teniendo cada molécula de IgE dos sitios de unión a antígeno de fragmentos específicos de alérgeno (Fab) disponibles para unirse al alérgeno en exposiciones posteriores. Para cuando esto ocurre, el alérgeno a menudo ya no está presente y no hay reacción alérgica, pero los mastocitos se ceban para una posterior exposición y el individuo es sensibilizado al alérgeno.
En la posterior exposición, los alérgenos se unen a múltiples moléculas de IgE en los mastocitos, reticulando las moléculas de IgE. En cuestión de minutos, esta reticulación de IgE activa los mastocitos y desencadena la desgranulación, una reacción en la que el contenido de los gránulos en el mastocito se libera al ambiente extracelular. Los componentes preformados que se liberan de los gránulos incluyen histamina, serotonina y bradiquinina (Tabla\(\PageIndex{1}\)). Los mastocitos activados también liberan mediadores lipídicos recién formados (leucotrienos y prostaglandinas del metabolismo del ácido aracadónico de membrana) y citocinas como el factor de necrosis tumoral (Tabla\(\PageIndex{2}\)).
| Componente Granulado | Actividad |
|---|---|
| Heparina | Estimula la generación de bradiquinina, que provoca aumento de la permeabilidad vascular, vasodilatación, constricción bronquiólica y aumento de la secreción de moco |
| Histamina | Provoca contracción del músculo liso, aumenta la permeabilidad vascular, aumenta la formación de moco y lágrimas |
| Serotonina | Aumenta la permeabilidad vascular, causa vasodilatación y contracción del músculo liso |
Los mediadores químicos liberados por los mastocitos provocan colectivamente la inflamación y los signos y síntomas asociados con las reacciones de hipersensibilidad tipo I. La histamina estimula la secreción de moco en las fosas nasales y la formación de lágrimas de las glándulas lagrimales, promoviendo la secreción nasal y los ojos llorosos de las alergias. La interacción de la histamina con las terminaciones nerviosas provoca picor y estornudos. La vasodilatación causada por varios de los mediadores puede resultar en urticaria, dolores de cabeza, angioedema (hinchazón que a menudo afecta los labios, la garganta y la lengua) e hipotensión (presión arterial baja). La constricción bronquiólica causada por algunos de los mediadores químicos provoca sibilancias, disnea (dificultad para respirar), tos y, en casos más severos, cianosis (color azulado en la piel o membranas mucosas). El vómito puede ser el resultado de la estimulación del centro del vómito en el cerebelo por la histamina y la serotonina. La histamina también puede causar relajación de los músculos lisos intestinales y diarrea.
| Mediador Químico | Actividad |
|---|---|
| Leukot rieno | Provoca contracción del músculo liso y secreción de moco, aumenta la permeabilidad vascular |
| Prostaglandina | Provoca contracción muscular lisa y vasodilatación |
| TNF-α (citocina) | Provoca inflamación y estimula la producción de citocinas por otros tipos de células |
Las reacciones de hipersensibilidad tipo I pueden ser localizadas o sistémicas. Las reacciones de hipersensibilidad tipo I localizadas incluyen rinitis por fiebre del heno, urticaria y asma (Tabla\(\PageIndex{3}\)). Las reacciones sistémicas de hipersensibilidad tipo I se denominan shock anafiláctico anafilaxisor. Aunque la anafilaxia comparte muchos síntomas comunes con las reacciones de hipersensibilidad tipo I localizadas, la hinchazón de la lengua y la tráquea, el bloqueo de las vías respiratorias, la caída peligrosa de la presión arterial y el desarrollo de shock pueden hacer que la anafilaxia sea especialmente grave y potencialmente mortal. De hecho, la muerte puede ocurrir a los pocos minutos del inicio de los signos y síntomas.
Las reacciones de fase tardía en las hipersensibilidad tipo I pueden desarrollarse 4-12 horas después de la fase temprana y están mediadas por eosinófilos, neutrófilos y linfocitos que han sido reclutados por factores quimiotácticos liberados de mastocitos. La activación de estas células reclutadas conduce a la liberación de más mediadores químicos que causan daño tisular y síntomas de fase tardía de hinchazón y enrojecimiento de la piel, tos, sibilancias y secreción nasal.
Se espera que los individuos que poseen genes para rasgos desadaptativos, como reacciones intensas de hipersensibilidad tipo I a componentes del ambiente que de otro modo serían inofensivos, sufrieran un éxito reproductivo reducido. Con este tipo de presión selectiva evolutiva, no se esperaría que tales rasgos persistieran en una población. Esto sugiere que las hipersensibilidad tipo I pueden tener una función adaptativa. Existe evidencia de que la IgE producida durante las reacciones de hipersensibilidad tipo I en realidad está destinada a contrarrestar las infecciones por helmintos 2. Los helmintos son uno de los pocos organismos que poseen proteínas que son atacadas por IgE. Además, existe evidencia de que las infecciones por helmintos a una edad temprana reducen la probabilidad de hipersensibilidad tipo I a sustancias inocuas más adelante en la vida. Así puede ser que las alergias sean una consecuencia desafortunada de una fuerte selección en el linaje de los mamíferos o antes para una defensa contra gusanos parásitos.
| Nombre común | Causa | Signos y síntomas |
|---|---|---|
| Asma inducida por alergia | Inhalación de alérgenos | Constricción de bronquios, dificultad para respirar, tos, escalofríos, dolores corporales |
| Anafilaxia | Reacción sistémica a alérgenos | Urticaria, picor, hinchazón de lengua y garganta, náuseas, vómitos, presión arterial baja, shock |
| Fiebre del heno | Inhalación de moho o polen | Secreción nasal, ojos llorosos, estornudos |
| Urticaria | Alérgenos alimentarios o farmacológicos, picaduras de insectos | Erupción cutánea elevada y llena de baches con picazón; los bultos pueden converger en grandes áreas elevadas |
Ejercicio\(\PageIndex{2}\)
- ¿Cuáles son las células que causan una reacción de hipersensibilidad tipo I?
- Describir las diferencias entre reacciones de hipersensibilidad tipo I inmediatas y de fase tardía.
- Enumere los signos y síntomas de la anafilaxia.
La hipótesis de higiene
En la mayoría de las sociedades modernas, la buena higiene se asocia con el baño regular, y la buena salud con la limpieza. Pero algunos estudios recientes sugieren que la asociación entre la salud y la vida limpia puede ser defectuosa. Algunos llegan a sugerir que se debe alentar a los niños a jugar en la suciedad —o incluso a comer tierra 3 — en beneficio de su salud. Esta recomendación se basa en la llamada hipótesis de higiene, que propone que la exposición infantil a antígenos de una amplia gama de microbios conduce a un sistema inmune mejor funcional más adelante en la vida.
La hipótesis de higiene fue sugerida por primera vez en 1989 por David Strachan 4, quien observó una relación inversa entre el número de niños mayores en una familia y la incidencia de fiebre del heno. Aunque la fiebre del heno en niños había aumentado dramáticamente a mediados del siglo XX, la incidencia fue significativamente menor en familias con más hijos. Strachan propuso que la menor incidencia de alergias en familias numerosas podría estar relacionada con infecciones adquiridas de hermanos mayores, lo que sugiere que estas infecciones hacen que los niños sean menos susceptibles a las alergias. Strachan también argumentó que las tendencias hacia familias más pequeñas y un mayor énfasis en la limpieza en el siglo XX habían disminuido la exposición a patógenos y, por lo tanto, llevaron a mayores tasas generales de alergias, asma y otros trastornos inmunológicos.
Otros investigadores han observado una relación inversa entre la incidencia de trastornos inmunitarios y enfermedades infecciosas que ahora son raras en los países industrializados pero que siguen siendo comunes en los países menos industrializados. 5 En las naciones desarrolladas, los niños menores de 5 años no están expuestos a muchos de los microbios, moléculas y antígenos que casi seguramente habrían encontrado hace un siglo. La falta de desafíos tempranos al sistema inmunológico por parte de organismos con los que evolucionaron los humanos y sus antepasados puede resultar en fallas en el funcionamiento del sistema inmune más adelante en la vida.
Hipersensibilidad tipo II (citotóxica)
Las reacciones inmunitarias categorizadas como hipersensibilidad tipo II, o hipersensibilidad citotóxica, están mediadas por anticuerpos IgG e IgM que se unen a antígenos de superficie celular o antígenos asociados a matriz en membranas basales. Estos anticuerpos pueden activar el complemento, dando como resultado una respuesta inflamatoria y lisis de las células diana, o pueden estar involucrados en la citotoxicidad mediada por células dependiente de anticuerpos (ADCC) con células T citotóxicas.
En algunos casos, el antígeno puede ser un autoantígeno, en cuyo caso la reacción también se describiría como una enfermedad autoinmune. (Las enfermedades autoinmunes se describen en Trastornos Autoinmunes). En otros casos, los anticuerpos pueden unirse a moléculas naturales, pero exógenas, de la superficie celular, como los antígenos asociados con la tipificación sanguínea que se encuentran en los glóbulos rojos (RBC). Esto lleva al recubrimiento de los RBC por anticuerpos, activación de la cascada del complemento y lisis mediada por complemento de RBC, así como opsonización de RBC para fagocitosis. Dos ejemplos de reacciones de hipersensibilidad tipo II que involucran RBC son la reacción transfusional hemolítica (HTR) y la enfermedad hemolítica del recién nacido (HDN). Estas reacciones de hipersensibilidad tipo II, que se discutirán con mayor detalle, se resumen en la Tabla\(\PageIndex{4}\).
La inmunohematología es el estudio de la sangre y el tejido formador de sangre en relación con la respuesta inmune. Las respuestas iniciadas por anticuerpos contra las células sanguíneas son hipersensibilidad tipo II, cayendo así en el campo de la inmunohematología. Para los estudiantes que aprenden primero sobre la inmunohematología, comprender los mecanismos inmunológicos involucrados se vuelve aún más desafiante por el complejo sistema de nomenclatura utilizado para identificar diferentes antígenos de grupos sanguíneos, a menudo llamados tipos de sangre. Los primeros antígenos del grupo sanguíneo usaron nombres alfabéticos o fueron nombrados por la primera persona que se sabe que produce anticuerpos contra el antígeno de glóbulos rojos (por ejemplo, Kell, Duffy o Diego). Sin embargo, en 1980, el Grupo de Trabajo sobre Terminología de la Sociedad Internacional de Transfusión de Sangre (ISBT) creó un estándar para la terminología de grupos sanguíneos en un intento de identificar de manera más consistente los antígenos de grupos sanguíneos recién descubiertos. A los nuevos antígenos se les da ahora un número y se les asigna a un sistema, colección o serie de grupos sanguíneos. Sin embargo, incluso con este esfuerzo, la nomenclatura de los grupos sanguíneos sigue siendo inconsistente.
| Nombre común | Causa | Signos y síntomas |
|---|---|---|
| Enfermedad hemolítica del recién nacido (HDN) | La IgG de la madre cruza la placenta, apuntando a los glóbulos rojos del feto para su destrucción | Anemia, edema, agrandamiento del hígado o bazo, hidropesía (líquido en la cavidad corporal), lo que lleva a la muerte del recién nacido en casos graves |
| Reacciones transfusionales hemolíticas (HTR) | IgG e IgM se unen a antígenos en glóbulos rojos transfundidos, dirigidos a los RBC donantes para su destrucción | Fiebre, ictericia, hipotensión, coagulación intravascular diseminada, posiblemente dando lugar a insuficiencia renal y muerte |
Incompatibilidad del grupo sanguíneo ABO
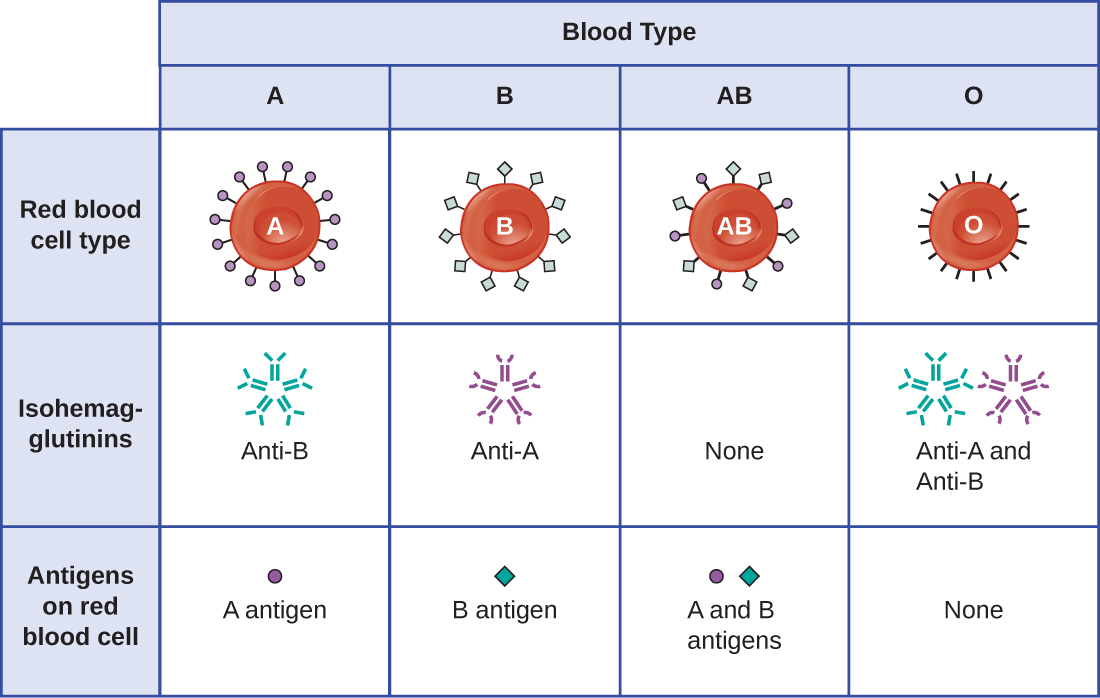
El reconocimiento de que los individuos tienen diferentes tipos de sangre fue descrito por primera vez por Karl Landsteiner (1868—1943) a principios del siglo XX, con base en su observación de que el suero de una persona podría causar una aglomeración de glóbulos rojos de otra. Estos estudios llevaron a Landsteiner a la identificación de cuatro tipos de sangre distintos. Investigaciones posteriores realizadas por otros científicos determinaron que los cuatro tipos sanguíneos se basaban en la presencia o ausencia de glicoproteínas de superficie “A” y “B”, y esto proporcionó la base para el sistema de grupos sanguíneos ABO que todavía se usa hoy en día (Figura\(\PageIndex{3}\)). Se desconocen las funciones de estos antígenos, pero algunos se han asociado con funciones bioquímicas normales de la célula. Además, los tipos de sangre ABO se heredan como alelos (uno de cada progenitor), y muestran patrones de herencia dominante y codominante. Los alelos para los tipos de sangre A y B son codominantes entre sí, y ambos son dominantes sobre el tipo sanguíneo O. Por lo tanto, los individuos con genotipos de AA o AO tienen sangre tipo A y expresan el antígeno de glicoproteína A en la superficie de sus RBC. Las personas con genotipos de BB o BO tienen sangre tipo B y expresan el antígeno de glicoproteína B en la superficie de sus RBC. Aquellos con un genotipo de AB tienen sangre tipo AB y expresan antígenos de glicoproteína A y B en la superficie de sus RBC. Finalmente, los individuos con un genotipo de OO tienen sangre tipo O y carecen de glicoproteínas A y B en la superficie de sus RBC.
Es importante señalar que los glóbulos rojos de los cuatro tipos de sangre ABO comparten una molécula receptora de proteínas común, y es la adición de carbohidratos específicos a los receptores proteicos lo que determina los tipos de sangre A, B y AB. Los genes que se heredan para los tipos de sangre A, B y AB codifican enzimas que agregan el componente carbohidrato al receptor de proteínas. Los individuos con grupo sanguíneo O todavía tienen el receptor proteico pero carecen de las enzimas que agregarían carbohidratos que harían su tipo de glóbulos rojos A, B o AB.
Los anticuerpos IgM en plasma que reaccionan cruzadamente con antígenos del grupo sanguíneo no presentes en los propios RBC de un individuo se denominan isohemaglutininas (Figura\(\PageIndex{3}\)). Las isohemaglutininas se producen dentro de las primeras semanas después del nacimiento y persisten durante toda la vida. Estos anticuerpos se producen en respuesta a la exposición a antígenos ambientales de alimentos y microorganismos. Una persona con sangre tipo A tiene antígenos A en la superficie de sus RBC y producirá anticuerpos anti-B contra antígenos ambientales que se asemejan al componente carbohidrato de los antígenos B. Una persona con sangre tipo B tiene antígenos B en la superficie de sus RBC y producirá anticuerpos anti-A contra antígenos ambientales que son similares al componente carbohidrato de los antígenos A. Las personas con tipo sanguíneo O carecen de antígenos A y B en sus glóbulos rojos y, por lo tanto, producen anticuerpos tanto anti-A como anti-B. Por el contrario, las personas con tipo de sangre AB tienen tanto antígenos A como B en sus RBC y, por lo tanto, carecen de anticuerpos anti-A y anti-B.
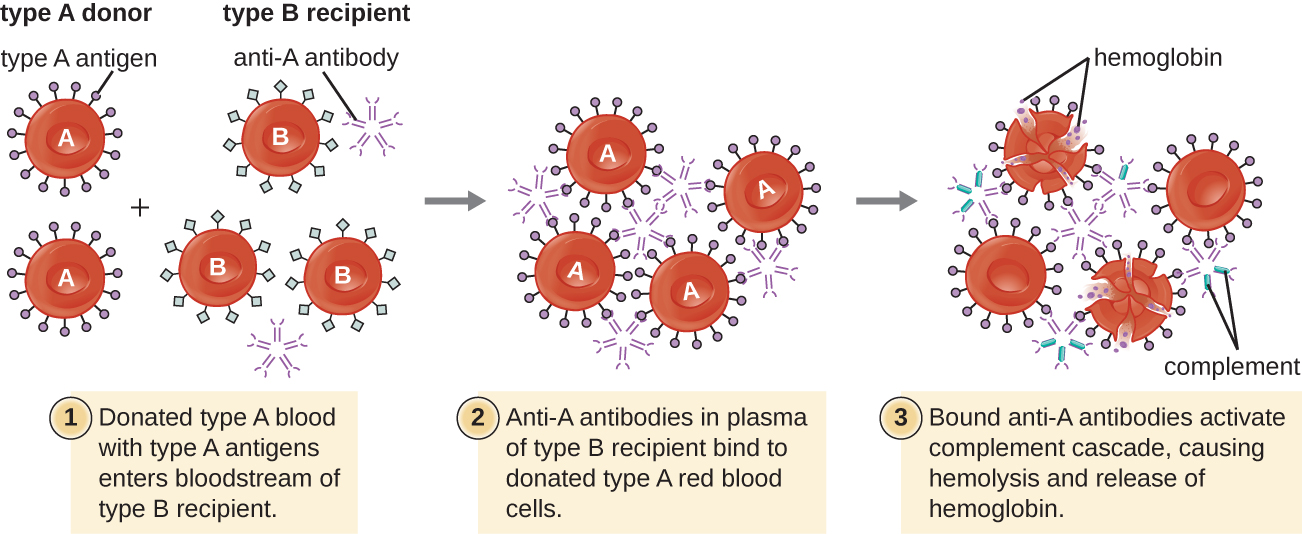
Un paciente puede requerir una transfusión de sangre por carecer de suficientes glóbulos rojos (anemia) o porque ha experimentado una pérdida significativa de volumen sanguíneo a través de un trauma o enfermedad. Si bien la transfusión de sangre se da para ayudar al paciente, es esencial que el paciente reciba una transfusión con el tipo sanguíneo ABO coincidente. Una transfusión con un grupo sanguíneo ABO incompatible puede conducir a una respuesta citotóxica de hipersensibilidad tipo II fuerte y potencialmente letal llamada reacción transfusión hemolítica (HTR) (Figura\(\PageIndex{4}\)).
Por ejemplo, si una persona con sangre tipo B recibe una transfusión de sangre tipo A, sus anticuerpos anti-A se unirán y aglutinarán los RBC transfundidos. Además, la activación de la cascada clásica del complemento conducirá a una fuerte respuesta inflamatoria, y el complejo de ataque a la membrana del complemento (MAC) mediará la hemólisis masiva de los RBC transfundidos. Los restos de glóbulos rojos dañados y destruidos pueden ocluir los vasos sanguíneos en los alvéolos de los pulmones y los glomérulos de los riñones. Dentro de 1 a 24 horas de una transfusión incompatible, el paciente experimenta fiebre, escalofríos, prurito (picor), urticaria (urticaria), disnea, hemoglobinuria (hemoglobina en la orina) e hipotensión (presión arterial baja). En las reacciones más graves, la presión arterial peligrosamente baja puede provocar shock, insuficiencia multiorgánica y muerte del paciente.
Los hospitales, centros médicos y laboratorios clínicos asociados suelen utilizar sistemas de hemovigilancia para minimizar el riesgo de TRs por error administrativo. Los sistemas de hemovigilancia son procedimientos que rastrean la información transfusional desde la fuente donante y los productos sanguíneos obtenidos hasta el seguimiento de los pacientes receptores. Los sistemas de hemovigilancia utilizados en muchos países identifican los TRs y sus resultados a través de informes obligatorios (por ejemplo, a la Administración de Alimentos y Medicamentos de los Estados Unidos), y esta información es valiosa para ayudar a prevenir tales ocurrencias en el futuro. Por ejemplo, si se encuentra que un HTR es el resultado de un error de laboratorio o de oficina, los hemoderivados adicionales recolectados del donante en ese momento pueden localizarse y etiquetarse correctamente para evitar HTRs adicionales. Como resultado de estas medidas, las muertes asociadas a HTR en Estados Unidos ocurren en aproximadamente una por cada 2 millones de unidades transfundidas. 6
Factores Rh
Se han descubierto muchos tipos diferentes de antígenos eritrocitarios desde la descripción de los antígenos de glóbulos rojos ABO. Los segundos antígenos RBC descritos con mayor frecuencia son los factores Rh, llamados así por los factores de macaco rhesus (Macaca mulatta) identificados por Karl Landsteiner y Alexander Weiner en 1940. El sistema Rh de antígenos RBC es el sistema de grupos sanguíneos más complejo e inmunogénico, con más de 50 especificidades identificadas hasta la fecha. De todos los antígenos Rh, el designado Rho (Weiner) o D (Fisher-Race) es el más inmunogénico. Las células se clasifican como Rh positivas (Rh+) si el antígeno Rho/D está presente o como Rh negativas (Rh−) si el antígeno Rho/D está ausente. A diferencia de las moléculas de carbohidratos que distinguen a los grupos sanguíneos ABO y son las dianas de las isohemaglutininas IgM en las HTRs, los antígenos del factor Rh son proteínas. Como se discutió en Linfocitos B e inmunidad humoral, los antígenos proteicos activan las células B y la producción de anticuerpos a través de un mecanismo dependiente de células T, y las células T H 2 estimulan el cambio de clase de IgM a otras clases de anticuerpos. En el caso de los antígenos del factor Rh, las células T H 2 estimulan el cambio de clase a IgG, y esto tiene implicaciones importantes para el mecanismo de la HDN.
Al igual que las incompatibilidades ABO, las transfusiones de sangre de un donante con los antígenos del factor Rh incorrectos pueden causar una hipersensibilidad tipo II HTR. Sin embargo, en contraste con las isohemaglutininas IgM producidas temprano en la vida a través de la exposición a antígenos ambientales, la producción de anticuerpos anti-factor RH requiere la exposición de un individuo con sangre Rh− a RBC Rh+ positivos y la activación de una respuesta primaria de anticuerpos. Aunque esta respuesta primaria de anticuerpos puede causar un HTR en el paciente transfusional, la reacción hemolítica se retrasaría hasta 2 semanas durante el periodo de retraso prolongado de una respuesta primaria de anticuerpos (Linfocitos B e Inmunidad Humoral). Sin embargo, si el paciente recibe una transfusión posterior con RBC Rh+, se produciría un HTR más rápido con el anticuerpo anti-factor Rh ya presente en la sangre. Además, la respuesta rápida de anticuerpos secundarios proporcionaría aún más anticuerpos anti-factor RH para el HTR.
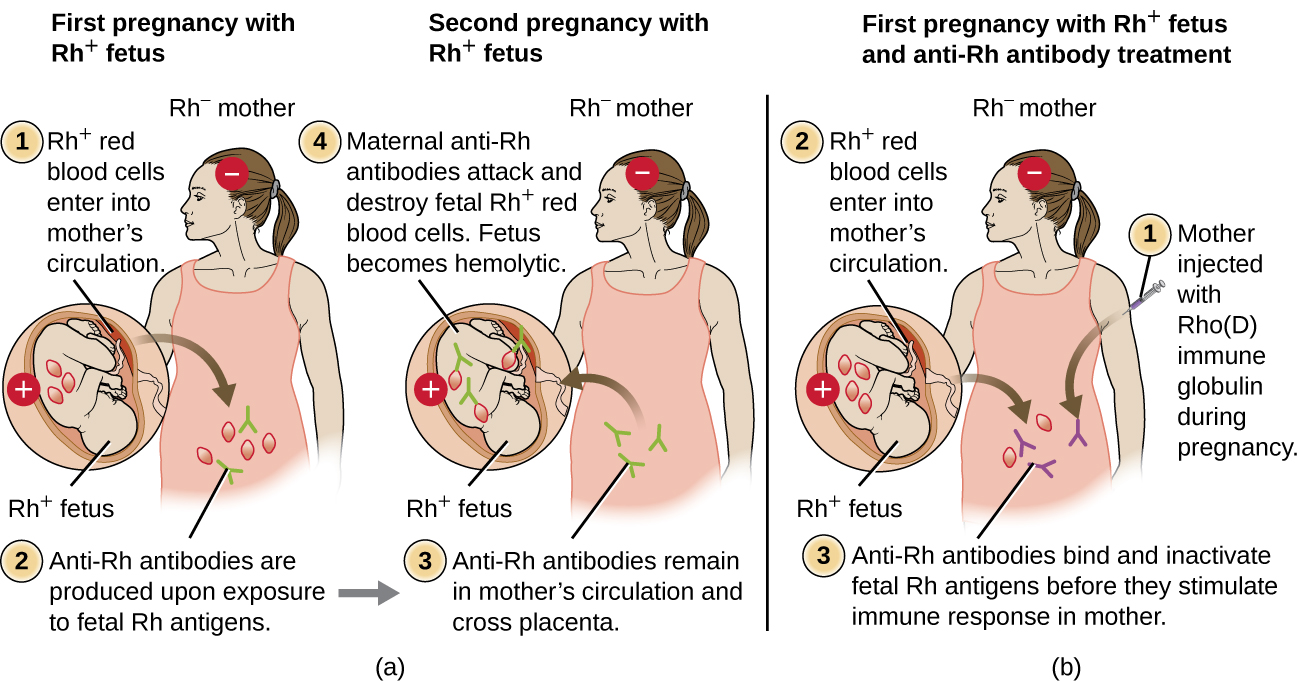
La incompatibilidad del factor Rh entre la madre y el feto también puede causar una reacción hemolítica de hipersensibilidad tipo II, denominada enfermedad hemolítica del recién nacido (HDN) (Figura\(\PageIndex{5}\)). Si una mujer Rh− lleva a término a un bebé Rh+, el sistema inmunitario de la madre puede estar expuesto a los glóbulos rojos fetales Rh+. Esta exposición suele ocurrir durante el último trimestre del embarazo y durante el proceso de parto. Si se produce esta exposición, los RBC fetales Rh+ activarán una respuesta inmune adaptativa primaria en la madre, y se producirán anticuerpos IgG anti-factor RH. Los anticuerpos IgG son la única clase de anticuerpos que pueden atravesar la placenta de madre a feto; sin embargo, en la mayoría de los casos, el primer bebé Rh+ no se ve afectado por estos anticuerpos porque la primera exposición suele ocurrir lo suficientemente tarde en el embarazo como para que la madre no tenga tiempo para montar una primaria suficiente respuesta de anticuerpos antes de que nazca el bebé.
Sin embargo, si se produce un embarazo posterior con un feto Rh+, la segunda exposición de la madre a los antígenos del factor Rh provoca una fuerte respuesta secundaria de anticuerpos que produce mayores cantidades de IgG anti-factor Rh. Estos anticuerpos pueden atravesar la placenta de la madre al feto y causar HDN, una condición potencialmente letal para el bebé (Figura\(\PageIndex{5}\)).
Previo al desarrollo de técnicas de diagnóstico y prevención, la incompatibilidad del factor Rh fue la causa más común de HDN, resultando en miles de muertes infantiles cada año en todo el mundo. 7 Por esta razón, los factores Rh de los futuros padres son examinados regularmente, y se han desarrollado tratamientos para prevenir la HDN causada por la incompatibilidad Rh. Para prevenir la HDN mediada por el factor Rh, la inmunoglobulina Rho (D) humana (por ejemplo, RhoGAM) se inyecta por vía intravenosa o intramuscular en la madre durante la semana 28 de embarazo y dentro de las 72 horas posteriores al parto. Se pueden administrar dosis adicionales después de eventos que pueden resultar en hemorragia transplacentaria (por ejemplo, muestreo de sangre umbilical, muestreo de vellosidades coriónicas, trauma abdominal, amniocentesis). Este tratamiento se inicia durante el primer embarazo con un feto Rh+. Los anticuerpos anti-Rh en la inmunoglobulina Rho (D) se unirán al factor Rh de cualquier RBC fetal que obtenga acceso al torrente sanguíneo de la madre, evitando que estas células Rh+ activen la respuesta primaria de anticuerpos de la madre. Sin una respuesta primaria de anticuerpos anti-factor RH, el próximo embarazo con un Rh+ tendrá un riesgo mínimo de HDN. Sin embargo, la madre necesitará ser retratada con inmunoglobulina Rho (D) durante ese embarazo para prevenir una respuesta primaria de anticuerpos anti-Rh que podría amenazar embarazos posteriores.
Utilice este juego interactivo de tipificación sanguínea para reforzar sus conocimientos sobre la tipificación de la sangre.
Ejercicio\(\PageIndex{3}\)
- ¿Qué sucede con las células que poseen antígenos incompatibles en una reacción de hipersensibilidad tipo II?
- Describir la enfermedad hemolítica del recién nacido y explicar cómo se puede prevenir.
Enfoque Clínico: Parte 2
La médica de atención primaria de Kerry no está segura de por qué Kerry parece desarrollar erupciones después de pasar tiempo al sol, por lo que ordena un análisis de orina y análisis de sangre básicos. Los resultados revelan que Kerry tiene proteinuria (niveles anormales de proteína en la orina), hemoglobinuria (exceso de hemoglobina en la orina) y un hematocrito bajo (recuento de glóbulos rojos). Estas pruebas sugieren que Kerry padece un leve ataque de anemia hemolítica. El médico sospecha que el problema podría ser autoinmune, por lo que remite a Kerry a un reumatólogo para pruebas y diagnósticos adicionales.
Ejercicio\(\PageIndex{4}\)
Los reumatólogos se especializan en enfermedades musculoesqueléticas como artritis, osteoporosis y dolor articular. ¿Por qué el médico de Kerry podría remitirla a este tipo particular de especialista a pesar de que no presenta ninguno de estos síntomas?
Hipersensibilidad Tipo III
Las hipersensibilidad tipo III son reacciones inmunocomplejas que fueron caracterizadas por Nicolas Maurice Arthus (1862-1945) en 1903. Para producir anticuerpos para procedimientos experimentales, Arthus inmunizó conejos inyectándolos con suero de caballos. Sin embargo, mientras inmunizaba a los conejos repetidamente con suero de caballo, Arthus notó una hemorragia subcutánea localizada no reportada e inesperada con edema en el sitio de la inyección. Esta reacción se desarrolló dentro de 3 a 10 horas después de la inyección. Esta reacción localizada a proteínas séricas no propias se denominó reacción de Arthus. Una reacción de Arthus ocurre cuando los antígenos solubles se unen con IgG en una proporción que da como resultado la acumulación de agregados antígeno-anticuerpo llamados complejos inmunes.
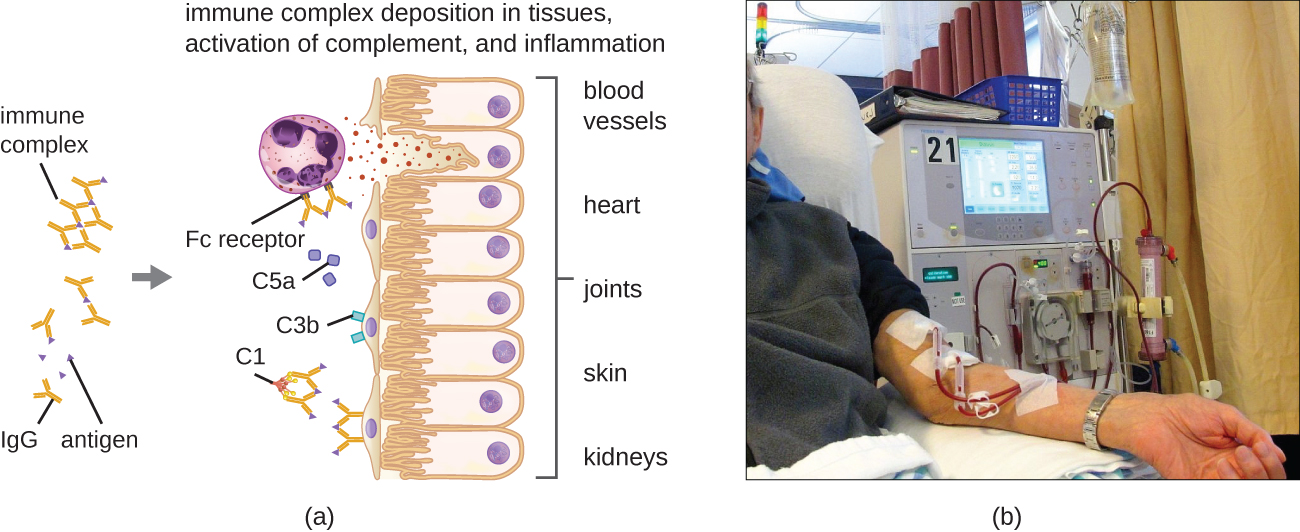
Una característica única de la hipersensibilidad tipo III es el exceso de anticuerpos (principalmente IgG), junto con una concentración relativamente baja de antígeno, lo que resulta en la formación de pequeños complejos inmunes que se depositan en la superficie de las células epiteliales que recubren el lumen interno de pequeños vasos sanguíneos o en las superficies de tejidos (Figura\(\PageIndex{6}\)). Esta acumulación de complejos inmunes conduce a una cascada de eventos inflamatorios que incluyen los siguientes:
- Unión de IgG a receptores de anticuerpos en mastocitos localizados, lo que resulta en la desgranulación de mastocitos
- Activación del complemento con producción de C3a y C5a proinflamatorios (ver Defensas Químicas)
- Aumento de la permeabilidad de los vasos sanguíneos con reclutamiento quimiotáctico de neutrófilos y macrófagos
Debido a que estos complejos inmunes no tienen un tamaño óptimo y se depositan sobre las superficies celulares, no pueden ser fagocitados de la manera habitual por neutrófilos y macrófagos, que, a su vez, a menudo se describen como “frustrados”. Aunque la fagocitosis no ocurre, la desgranulación de neutrófilos da como resultado la liberación de enzimas lisosómicas que provocan la destrucción extracelular del complejo inmune, dañando las células localizadas en el proceso. También se produce la activación de las vías de coagulación, dando como resultado trombos (coágulos sanguíneos) que ocluyen los vasos sanguíneos y causan isquemia que puede conducir a necrosis vascular y hemorragia localizada.
La hipersensibilidad sistémica tipo III (enfermedad del suero) ocurre cuando los complejos inmunes se depositan en diversos sitios del cuerpo, dando como resultado una respuesta inflamatoria sistémica más generalizada. Estos complejos inmunes involucran proteínas no propias, como anticuerpos producidos en animales para inmunidad pasiva artificial (ver Vacunas), ciertos medicamentos o antígenos microbianos que se liberan continuamente a lo largo del tiempo durante infecciones crónicas (p. ej., endocarditis bacteriana subaguda, virus crónica hepatitis). Los mecanismos de la enfermedad del suero son similares a los descritos en la hipersensibilidad localizada tipo III pero implican una activación generalizada de mastocitos, complemento, neutrófilos y macrófagos, lo que provoca destrucción tisular en áreas como los riñones, las articulaciones y los vasos sanguíneos. Como resultado de la destrucción del tejido, los síntomas de la enfermedad del suero incluyen escalofríos, fiebre, sarpullido, vasculitis y artritis. También es posible el desarrollo de glomerulonefritis o hepatitis.
Las enfermedades autoinmunes como el lupus eritematoso sistémico (LES) y la artritis reumatoide también pueden implicar reacciones dañinas de hipersensibilidad tipo III cuando los autoanticuerpos forman complejos inmunes con autoantígenos. Estos padecimientos se discuten en Trastornos Autoinmunes.
Ejercicio\(\PageIndex{5}\)
- ¿Por qué es importante el exceso de anticuerpos en hipersensibilidad tipo III?
- Describir las diferencias entre la reacción de Arthus y la enfermedad del suero.
Antitoxina de la difteria
Los sueros antibacterianos son mucho menos utilizados ahora que en el pasado, habiendo sido reemplazados por vacunas toxoides. Sin embargo, una antitoxina diftérica producida en caballos es un ejemplo de tal tratamiento que todavía se usa en algunas partes del mundo. Aunque no tiene licencia de la FDA para su uso en Estados Unidos, la antitoxina diftérica puede usarse para tratar casos de difteria, los cuales son causados por la bacteria Corynebacterium diphtheriae. 8 El tratamiento no está exento de riesgos, sin embargo. La enfermedad del suero puede ocurrir cuando el paciente desarrolla una respuesta inmune a proteínas de caballo no propias. Los complejos inmunes se forman entre las proteínas del caballo y los anticuerpos circulantes cuando los dos existen en ciertas proporciones. Estos complejos inmunes pueden depositarse en órganos, causando daños como artritis, nefritis, sarpullido y fiebre. La enfermedad del suero suele ser transitoria sin daño permanente a menos que el paciente esté expuesto crónicamente al antígeno, lo que puede resultar en daños irreversibles en sitios corporales como articulaciones y riñones. Con el tiempo, las células fagocíticas como los macrófagos son capaces de limpiar los antígenos séricos del caballo, lo que da como resultado una mejora de la condición del paciente y una disminución de los síntomas a medida que la respuesta inmune se disipa.
Enfoque Clínico: Parte 3
Kerry no llega al reumatólogo. Tiene una convulsión al salir del consultorio de su médico de atención primaria. Rápidamente es trasladada de urgencia al servicio de urgencias, donde su médico de atención primaria relata su historial médico y los resultados recientes de pruebas. El médico del servicio de urgencias llama al reumatólogo al personal del hospital para su consulta. Con base en los síntomas y resultados de las pruebas, el reumatólogo sospecha que Kerry tiene lupus y ordena un par de análisis de sangre: una prueba de anticuerpos antinucleares (ANA) para buscar anticuerpos que se unan al ADN y otra prueba que busca anticuerpos que se unan a un autoantígeno llamado antígeno Smith (Sm).
Ejercicio\(\PageIndex{6}\)
Con base en los análisis de sangre ordenados, ¿qué tipo de reacción sospecha el reumatólogo que está causando la convulsión de Kerry?
Hipersensibilidades Tipo IV
Las hipersensibilidad tipo IV no están mediadas por anticuerpos como los otros tres tipos de hipersensibilidad. Más bien, las hipersensibilidad tipo IV están reguladas por las células T e implican la acción de las células efectoras. Estos tipos de hipersensibilidad pueden organizarse en tres subcategorías basadas en el subtipo de células T, el tipo de antígeno y el mecanismo efector resultante (Tabla\(\PageIndex{5}\)).
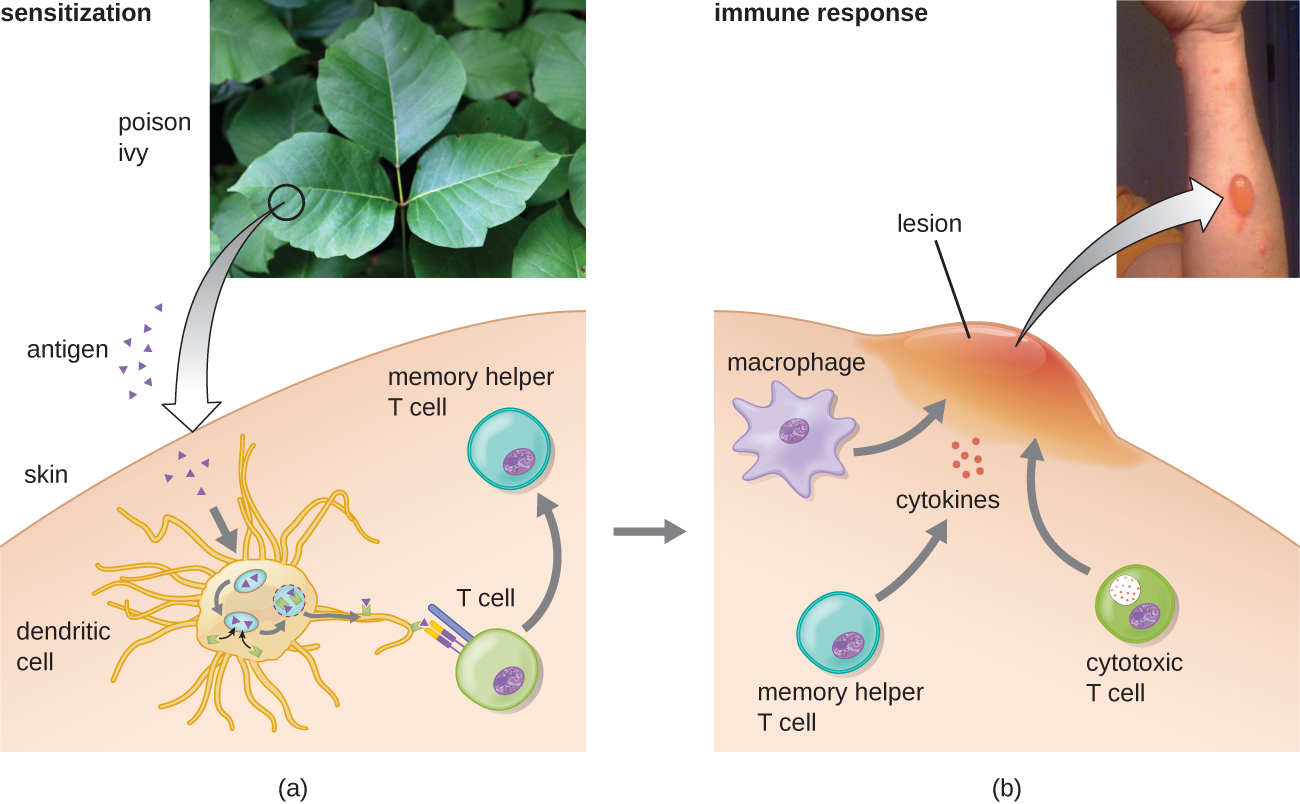
En la primera subcategoría tipo IV, las reacciones mediadas por CD4 T H 1 se describen como hipersensibilidad de tipo retardado (DTH). La etapa de sensibilización implica la introducción de antígeno en la piel y la fagocitosis por células presentadoras de antígeno locales (CPA). Las APCs activan las células T auxiliares, estimulando la proliferación clonal y diferenciación en células T H 1 de memoria. Tras la posterior exposición al antígeno, estas células T H 1 de memoria sensibilizadas liberan citocinas que activan los macrófagos, y los macrófagos activados son responsables de gran parte del daño tisular. Ejemplos de esta hipersensibilidad mediada por T H 1 se observan en la tuberculina, la prueba cutánea de Mantoux y la dermatitis de contacto, como ocurre en las reacciones alérgicas al látex.
En la segunda subcategoría tipo IV, las reacciones mediadas por CD4 T H 2 dan como resultado asma crónica o rinitis alérgica crónica. En estos casos, primero se inhala el antígeno soluble, dando como resultado el reclutamiento y activación de eosinófilos con la liberación de citocinas y mediadores inflamatorios.
En la tercera subcategoría tipo IV, las reacciones mediadas por linfocitos T citotóxicos (CTL) CD8 se asocian con rechazo de trasplante de tejido y dermatitis de contacto (Figura\(\PageIndex{7}\)). Para esta forma de hipersensibilidad mediada por células, las CPA procesan y presentan el antígeno con MHC I a células T CD8 sin tratamiento previo. Cuando estas células T CD8 sin tratamiento previo se activan, proliferan y se diferencian en CTL. Las células T H 1 activadas también pueden potenciar la activación de los CTL. Los CTL activados luego se dirigen e inducen apoptosis mediada por granzimas en células que presentan el mismo antígeno con MHC I. Estas células diana podrían ser células “propias” que han absorbido el antígeno extraño (como con dermatitis de contacto debida a hiedra venenosa), o podrían ser células de tejido trasplantadas que muestran antígeno del donante.
| Subcategoría | Antígeno | Mecanismo efector | Ejemplos |
|---|---|---|---|
| 1 | Antígeno soluble | Los macrófagos activados dañan el tejido y promueven la respuesta inflamatoria | Dermatitis de contacto (por ejemplo, exposición al látex) e hipersensibilidad de tipo retrasado (por ejemplo, reacción a la tuberculina) |
| 2 | Antígeno soluble | Reclutamiento y activación de eosinófilos liberan citocinas y productos químicos proinflamatorios | Asma crónica y rinitis alérgica crónica |
| 3 | Antígeno asociado a células | Citotoxicidad mediada por CTL | Dermatitis de contacto (por ejemplo, contacto con hiedra venenosa) y rechazo de trasplante de tejido |
Ejercicio\(\PageIndex{7}\)
- Describir los tres subtipos de hipersensibilidad tipo IV.
- Explicar cómo las células T contribuyen al daño tisular en la hipersensibilidad tipo IV.
Uso de hipersensibilidad retardada para la prueba de TB
El pediatra austriaco Clemans von Pirquet (1874—1929) describió por primera vez los mecanismos de alergia, incluida la enfermedad del suero tipo III. 9 Su interés llevó al desarrollo de una prueba de tuberculosis (TB), utilizando el antígeno tuberculino, basado en trabajos anteriores de identificación del patógeno de TB realizado por Robert Koch. El método de Pirquet implicó la escarificación, que resulta en múltiples pinchazos simultáneos, utilizando un dispositivo con una matriz de agujas para romper la piel numerosas veces en un área pequeña. El dispositivo utilizado por Pirquet fue similar al dispositivo de prueba de dientes con cuatro agujas que se ven en la Figura\(\PageIndex{8}\).
Las puntas de todas las agujas de la matriz están recubiertas con tuberculina, un extracto proteico de la bacteria TB, introduciendo efectivamente la tuberculina en la piel. De uno a 3 días después, el área puede ser examinada para detectar una reacción de hipersensibilidad retardada, cuyos signos incluyen hinchazón y enrojecimiento.
Como se puede imaginar, la escarificación no fue una experiencia agradable, 10 y las numerosas punciones cutáneas ponen al paciente en riesgo de desarrollar una infección bacteriana de la piel. Mantoux modificó la prueba de Pirquet para usar una sola inyección subcutánea de material de tuberculina purificada. Una prueba positiva, que está indicada por una hinchazón localizada retardada en el sitio de inyección, no significa necesariamente que el paciente esté actualmente infectado con TB activa. Debido a que la hipersensibilidad tipo IV (tipo retardado) está mediada por la reactivación de las células T de memoria, dichas células pueden haber sido creadas recientemente (debido a una infección de corriente activa) o años antes (si un paciente tenía TB y la había aclarado espontáneamente, o si había entrado en latencia). Sin embargo, la prueba puede ser utilizada para confirmar la infección en casos en los que los síntomas en el paciente o los hallazgos en una radiografía sugieren su presencia.

Neumonitis por hipersensibilidad
Algunas enfermedades causadas por hipersensibilidad no son causadas exclusivamente por un tipo. Por ejemplo, la neumonitis por hipersensibilidad (HP), que a menudo es una enfermedad ocupacional o ambiental, ocurre cuando los pulmones se inflaman debido a una reacción alérgica al polvo inhalado, endosporas, plumas de aves, excrementos de aves, mohos o químicos inhalados. HP tiene muchos nombres diferentes asociados con diversas formas de exposición (Figura\(\PageIndex{9}\)). La HP asociada con excrementos de aves a veces se llama pulmón de aficionado a las palomas o pulmón de obrero avícola, ambos comunes en los criadores y manipuladores de aves. La enfermedad del manipulador de queso, el pulmón del agricultor, la enfermedad de los traficantes de sauna y el pulmón de la bañera de hidromasaje son otros nombres para HP asociados con la exposición a mohos en diversos entornos.
La patología asociada a HP puede deberse tanto a hipersensibilidad tipo III (mediada por complejos inmunes) como tipo IV (mediada por células T H 1 y macrófagos). La exposición repetida a alérgenos puede causar alveolitis debido a la formación de complejos inmunes en la pared alveolar del pulmón acompañados de acumulación de líquido, y la formación de granulomas y otras lesiones en el pulmón como resultado de la activación de macrófagos mediada por T H 1. La alveolitis con formación de líquido y granuloma da como resultado una mala perfusión de oxígeno en los alvéolos, lo que a su vez puede causar síntomas como tos, disnea, escalofríos, fiebre, sudoración, mialgias, dolor de cabeza y náuseas. Los síntomas pueden ocurrir tan rápidamente como 2 horas después de la exposición y pueden persistir durante semanas si no se tratan.

Ejercicio\(\PageIndex{8}\)
Explicar por qué la neumonitis por hipersensibilidad se considera una enfermedad ocupacional.
La figura\(\PageIndex{10}\) resume los mecanismos y efectos de cada tipo de hipersensibilidad discutidos en esta sección.
Diagnóstico de Hipersensibilidad
El diagnóstico de hipersensibilidad tipo I es un proceso complejo que requiere varias pruebas diagnósticas además de una historia clínica bien documentada. Se pueden medir los niveles séricos de IgE, pero la IgE elevada sola no confirma la enfermedad alérgica. Como parte del proceso para identificar los antígenos responsables de una alergia de reacción tipo I, se pueden realizar pruebas a través de una prueba cutánea de pinchazo (PPST) o una prueba intradérmica. La PPST se realiza con la introducción de alérgenos en una serie de pinchazos superficiales en la espalda o brazos del paciente (Figura\(\PageIndex{11}\)). Los PPST se consideran la forma más conveniente y menos costosa de diagnosticar alergias, según el Consejo Conjunto de Alergia de Estados Unidos y la Academia Europea de Alergia e Inmunología. El segundo tipo de prueba, la prueba intradérmica, requiere inyección en la dermis con una aguja pequeña. Esta aguja, también conocida como aguja de tuberculina, está unida a una jeringa que contiene una pequeña cantidad de alérgeno. Tanto el PPST como las pruebas intradérmicas se observan durante 15—20 minutos para una reacción de destello de rueda a los alérgenos. La medición de cualquier roncha (un bulto elevado y con picazón) y llamarada (enrojecimiento) en cuestión de minutos indica una hipersensibilidad tipo I, y cuanto mayor es la reacción de la ronca, mayor es la sensibilidad del paciente al alérgeno.
Las hipersensibilidad tipo III a menudo pueden ser mal diagnosticadas debido a su naturaleza inflamatoria inespecífica. Los síntomas son fácilmente visibles, pero pueden estar asociados con cualquiera de una serie de otras enfermedades. Un historial sólido e integral del paciente es crucial para un diagnóstico adecuado y preciso. Las pruebas utilizadas para establecer el diagnóstico de neumonitis por hipersensibilidad (resultante de hipersensibilidad tipo III) incluyen lavado broncoalveolar (BAL), pruebas de función pulmonar y tomografía computarizada de alta resolución (TCAR).
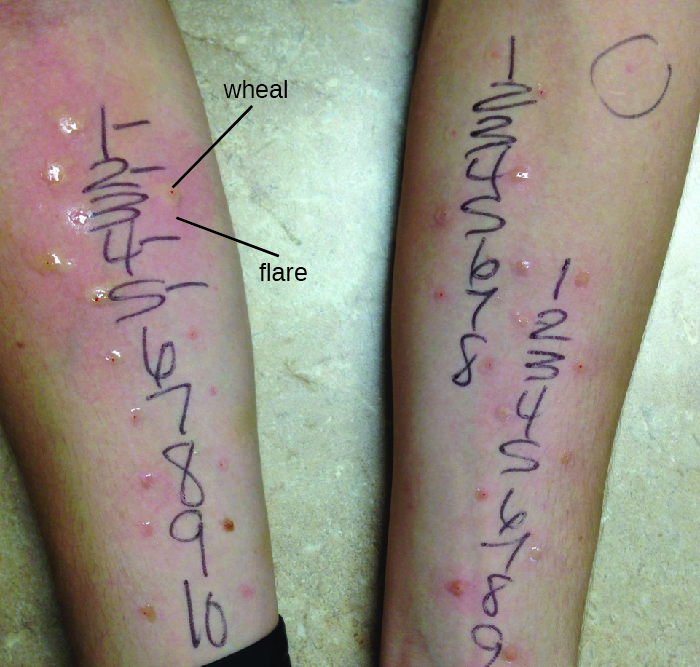
Ejercicio\(\PageIndex{9}\)
- Describir la prueba cutánea de pinchazo.
- Explicar por qué las hipersensibilidad tipo III pueden ser difíciles de diagnosticar
Tratamientos de Hipersensibilidad
Las reacciones alérgicas se pueden tratar de varias maneras. La prevención de las reacciones alérgicas se puede lograr mediante la terapia de desensibilización (hiposensibilización), que se puede utilizar para reducir la reacción de hipersensibilidad a través de inyecciones repetidas de alérgenos. Las concentraciones extremadamente diluidas de alérgenos conocidos (determinadas a partir de las pruebas de alérgenos) se inyectan en el paciente a intervalos prescritos (por ejemplo, semanalmente). La cantidad de alérgeno entregado por las inyecciones se incrementa lentamente a lo largo de un periodo de acumulación hasta que se determina una dosis efectiva y esa dosis se mantiene durante la duración del tratamiento, que puede durar años. Por lo general, se alienta a los pacientes a permanecer en el consultorio del médico durante 30 minutos después de recibir la inyección en caso de que los alérgenos administrados causen una reacción sistémica grave. Los consultorios médicos que administren terapia de desensibilización deben estar preparados para brindar reanimación y tratamiento farmacológico en el caso de tal evento.
La terapia de desensibilización se utiliza para alergias a picaduras de insectos y alergias ambientales. Las inyecciones de alergia provocan la producción de diferentes interleucinas y respuestas de anticuerpos IgG en lugar de IgE. Cuando se producen anticuerpos IgG específicos de alérgeno en exceso y se unen al alérgeno, pueden actuar como anticuerpos bloqueantes para neutralizar el alérgeno antes de que pueda unirse a IgE en mastocitos. Existen estudios tempranos que utilizan terapia oral para la desensibilización de las alergias alimentarias que son prometedores. 11 12 Estos estudios implican alimentar a niños que tienen alergias pequeñas cantidades del alérgeno (por ejemplo, harina de maní) o proteínas relacionadas con el tiempo. Muchos de los sujetos muestran una severidad reducida de reacción al alérgeno alimentario después de la terapia.
También hay terapias diseñadas para tratar reacciones alérgicas graves. La anafilaxia sistémica de emergencia se trata inicialmente con una inyección de epinefrina, lo que puede contrarrestar la caída de la presión arterial. Los individuos con alergias graves conocidas a menudo llevan un autoinyector autoadministrable que puede usarse en caso de exposición al alérgeno (por ejemplo, una picadura de insecto o ingestión accidental de un alimento que causa una reacción grave). Al autoadministrarse una inyección de epinefrina (o a veces dos), el paciente puede detener la reacción el tiempo suficiente para buscar atención médica. El tratamiento de seguimiento generalmente implica administrar al paciente antihistamínicos y corticosteroides de acción lenta durante varios días después de la reacción para prevenir posibles reacciones de fase tardía. Sin embargo, los efectos del tratamiento con antihistamínicos y corticosteroides no están bien estudiados y se utilizan con base en consideraciones teóricas.
El tratamiento de reacciones alérgicas más leves generalmente involucra antihistamínicos y otros medicamentos antiinflamatorios. Hay una variedad de medicamentos antihistamínicos disponibles, tanto en dosis recetadas como de venta libre. También hay medicamentos antileucotrienos y antiprostaglandinas que se pueden usar en tándem con medicamentos antihistamínicos en un régimen de terapia combinada (y más efectiva).
Los tratamientos de hipersensibilidad tipo III incluyen prevenir una mayor exposición al antígeno y el uso de fármacos antiinflamatorios. Algunas afecciones pueden resolverse cuando se previene la exposición al antígeno. Los inhaladores antiinflamatorios de corticosteroides también se pueden usar para disminuir la inflamación y permitir que las lesiones pulmonares sanen. El tratamiento sistémico con corticosteroides, oral o intravenoso, también es común para las hipersensibilidad tipo III que afectan a los sistemas corporales. El tratamiento de la neumonitis por hipersensibilidad incluye evitar el alérgeno, junto con la posible adición de esteroides recetados como la prednisona para reducir la inflamación.
El tratamiento de las hipersensibilidad tipo IV incluye antihistamínicos, antiinflamatorios, analgésicos y, si es posible, eliminar la exposición adicional al antígeno.
Ejercicio\(\PageIndex{10}\)
- Describir la terapia de desensibilización.
- Explicar el papel de la epinefrina en el tratamiento de las reacciones de hipersensibilidad.
Conceptos clave y resumen
- Una alergia es una respuesta inmune adaptativa, a veces potencialmente mortal, a un alérgeno.
- La hipersensibilidad tipo I requiere sensibilización de mastocitos con IgE, implicando una respuesta inicial de anticuerpos IgE y unión de IgE a mastocitos. En la segunda exposición a un alérgeno, la reticulación de moléculas de IgE en mastocitos desencadena la desgranulación y liberación de mediadores químicos preformados y recién formados de la inflamación. La hipersensibilidad tipo I puede ser localizada y relativamente menor (urticaria y fiebre del heno) o en todo el sistema y peligrosa (anafilaxia sistémica).
- Las hipersensibilidad tipo II son el resultado de anticuerpos que se unen a antígenos en las células e inician respuestas citotóxicas. Los ejemplos incluyen la reacción transfusional hemolítica y la enfermedad hemolítica del recién nacido.
- Las hipersensibilidad tipo III son el resultado de la formación y acumulación de complejos inmunes en los tejidos, estimulando respuestas inflamatorias dañinas.
- Las hipersensibilidad tipo IV no están mediadas por anticuerpos, sino por la activación de células T auxiliares de macrófagos, eosinófilos y células T citotóxicas.
Notas al pie
- 1 D.S. Strayer et al (eds). Patología de Rubin: Fundamentos clinicopatológicos de la medicina. 7a ed. 2Filadelfia, PA: Lippincott, Williams & Wilkins, 2014.
- 2 C.M. Fitzsimmons et al. “Alérgenos de helmintos, IgE específica de parásitos y su papel protector en la inmunidad humana”. Frontera en Inmunología 5 (2015) :47.
- 3 S.T. Weiss. “Comer suciedad—La hipótesis de la higiene y las enfermedades alérgicas”. New England Journal of Medicine 347 núm. 12 (2002) :930—931.
- 4 D.P. Strachan “Fiebre del Heno, Higiene y Tamaño del Hogar”. British Medical Journal 299 no. 6710 (1989) :1259.
- 5 H. Okada et al. “La 'hipótesis de higiene' para las enfermedades autoinmunes y alérgicas: una actualización”. Inmunología Clínica y Experimental 160 núm. 1 (2010) :1—9.
- 6 E.C. Vamvakas, M.A. Blajchman. “Mortalidad Relacionada con Transfusiones: Los Riesgos Continuos de la Transfusión de Sangre Alogénica y las Estrategias Disponibles para su Prevención”. Sangre 113 núm. 15 (2009) :3406—3417.
- 7 G. Reali. “Cuarenta Años de Inmunoprofilaxis Anti-D”. Transfusión de sangre 5 núm. 1 (2007) :3—6.
- 8 Centros de Control y Prevención de Enfermedades. “Antitoxina diftérica”. http://www.cdc.gov/diphtheria/dat.html. Consultado el 25 de marzo de 2016.
- 9 B. Huber “100 Jahre Allergie: Clemens von Pirquet—sein Allergiebegriff und das ihm zugrunde liegende Krankheitsverständnis.” Wiener Klinische Wochenschrift 118 núm. 19—20 (2006) :573—579.
- 10 C.A. Stewart. “La Prueba Pirquet: Comparación de la Escarificación y los Métodos de Aplicación de Punción”. Archivos de Pediatría y Medicina del Adolescente 35 núm. 3 (1928) :388—391.
- 11 C.L. Schneider et al. “Un Estudio Piloto de Omalizumab para Facilitar la Desensibilización Oral Rápida en Pacientes Alérgicos al Cacahuete de Alto Riesgo”. Revista de Alergia e Inmunología Clínica 132 núm. 6 (2013) :1368—1374.
- 12 P. Varshney y col. “Un Estudio Aleatorizado Controlado de Inmunoterapia Oral con Cacahuete: Desensibilización Clínica y Modulación de la Respuesta Alérgica”. Revista de Alergia e Inmunología Clínica 127 núm. 3 (2011) :654—660.


