8.1: Energía, Materia y Enzimas
- Page ID
- 54693
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Objetivos de aprendizaje
- Definir y describir el metabolismo
- Comparar y contrastar autótrofos y heterótrofos
- Describir la importancia de las reacciones de oxidación-reducción en el metabolismo
- Describir por qué ATP, FAD, NAD + y NADP + son importantes en una celda
- Identificar la estructura y los componentes estructurales de una enzima
- Describir las diferencias entre inhibidores enzimáticos competitivos y no competitivos
Enfoque Clínico: Parte 1
Hannah es una niña de 15 meses del estado de Washington. Está pasando el verano en Gambia, donde sus padres trabajan para una organización no gubernamental. Alrededor de 3 semanas después de su llegada a Gambia, el apetito de Hannah comenzó a disminuir y sus padres notaron que parecía inusualmente lenta, fatigada y confundida. También parecía muy irritable cuando estaba al aire libre, sobre todo durante el día. Cuando empezó a vomitar, sus padres pensaron que había contraído un virus de 24 horas, pero cuando sus síntomas persistieron, la llevaron a una clínica. El médico local notó que los reflejos de Hannah parecían anormalmente lentos, y cuando le examinó los ojos con una luz, ella parecía inusualmente sensible a la luz. También parecía estar experimentando una rigidez en el cuello.
Ejercicio\(\PageIndex{1}\)
¿Cuáles son algunas posibles causas de los síntomas de Hannah?
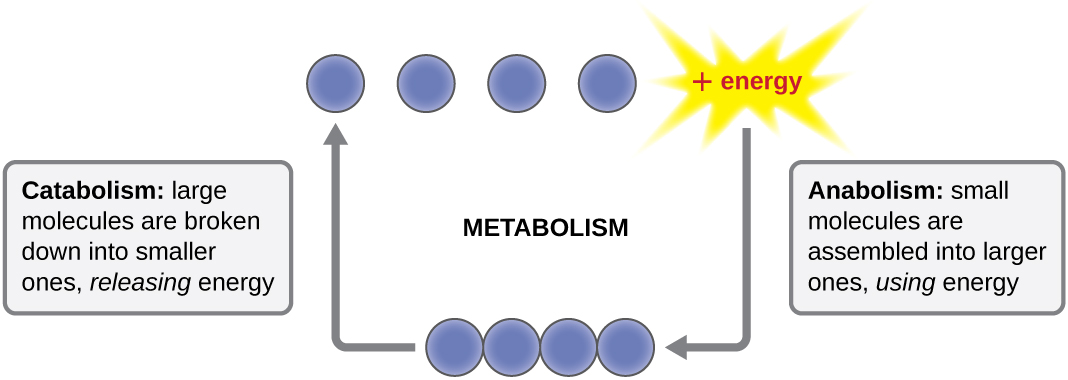
El término utilizado para describir todas las reacciones químicas dentro de una célula es el metabolismo (Figura\(\PageIndex{1}\)). Los procesos celulares como la construcción o descomposición de moléculas complejas ocurren a través de una serie de reacciones químicas interconectadas escalonadas llamadas vías metabólicas. Las reacciones que son espontáneas y liberan energía son reacciones exergónicas, mientras que las reacciones endergónicas requieren energía para proceder. El término anabolismo se refiere a aquellas vías metabólicas endergónicas involucradas en la biosíntesis, convirtiendo bloques de construcción moleculares simples en moléculas más complejas, y alimentadas por el uso de energía celular. Por el contrario, el término catabolismo se refiere a las vías exergónicas que descomponen las moléculas complejas en otras más simples. La energía molecular almacenada en los enlaces de moléculas complejas se libera en vías catabólicas y se recolecta de tal manera que puede ser utilizada para producir moléculas de alta energía, que se utilizan para impulsar vías anabólicas. Así, en términos de energía y moléculas, las células están continuamente equilibrando el catabolismo con el anabolismo.
Clasificación por Carbono y Fuente de Energía
Los organismos pueden identificarse de acuerdo con la fuente de carbono que utilizan para el metabolismo así como su fuente de energía. Los prefijos auto- (“self”) y hetero- (“otro”) se refieren a los orígenes de las fuentes de carbono que pueden utilizar diversos organismos. Los organismos que convierten el dióxido de carbono inorgánico (CO 2) en compuestos orgánicos de carbono son autótrofos. Las plantas y cianobacterias son ejemplos bien conocidos de autótrofos. Por el contrario, los heterótrofos se basan en compuestos orgánicos de carbono más complejos como nutrientes; estos son proporcionados inicialmente por autótrofos. Muchos organismos, que van desde humanos hasta muchos procariotas, incluyendo la bien estudiada Escherichia coli, son heterótrofos.
Los organismos también pueden ser identificados por la fuente de energía que utilizan. Toda la energía se deriva de la transferencia de electrones, pero la fuente de electrones difiere entre varios tipos de organismos. Los prefijos photo- (“light”) y chemo- (“chemical”) se refieren a las fuentes de energía que utilizan diversos organismos. Aquellos que obtienen su energía para la transferencia de electrones de la luz son los fototrofos, mientras que los quimiótrofos obtienen energía para la transferencia de electrones al romper los enlaces químicos. Existen dos tipos de quimiótrofos: organótrofos y litotrofos. Los organótrofos, incluyendo humanos, hongos y muchos procariotas, son quimiótrofos que obtienen energía de compuestos orgánicos. Los litotrofos (“litografía” significa “roca”) son quimiótrofos que obtienen energía de compuestos inorgánicos, incluyendo sulfuro de hidrógeno (H 2 S) y hierro reducido. La litotrofia es única en el mundo microbiano.
Las estrategias utilizadas para obtener tanto carbono como energía se pueden combinar para la clasificación de organismos según el tipo nutricional. La mayoría de los organismos son quimioheterótrofos porque utilizan moléculas orgánicas como fuentes de electrones y carbono. El cuadro\(\PageIndex{1}\) resume esta y las otras clasificaciones.
| Clasificaciones | Fuente de energía | Fuente de Carbono | Ejemplos | |
|---|---|---|---|---|
| Quimiótrofos | Quimioautótrofos | Químico | Inorgánica | Bacterias oxidantes de hidrógeno, azufre, hierro, nitrógeno y monóxido de carbono |
| Quimioheterótrofos | Químico | Compuestos orgánicos | Todos los animales, la mayoría de los hongos, protozoos y bacterias | |
| Fototrofos | Fotoautótrofos | Luz | Inorgánica | Todas las plantas, algas, cianobacterias y bacterias de azufre verdes y moradas |
| Fotoheterótrofos | Luz | Compuestos orgánicos | Bacterias verdes y moradas sin azufre, heliobacterias | |
Ejercicio\(\PageIndex{2}\)
- Explicar la diferencia entre catabolismo y anabolismo.
- Explicar la diferencia entre autótrofos y heterótrofos.
Oxidación y Reducción del Metabolismo
La transferencia de electrones entre moléculas es importante porque la mayor parte de la energía almacenada en átomos y utilizada para las funciones de las celdas de combustible está en forma de electrones de alta energía. La transferencia de energía en forma de electrones permite que la célula transfiera y utilice la energía de manera incremental; es decir, en paquetes pequeños en lugar de una sola ráfaga destructiva. Las reacciones que eliminan electrones de las moléculas donadoras, dejándolos oxidados, son reacciones de oxidación; las que agregan electrones a las moléculas aceptoras, dejándolas reducidas, son reacciones de reducción. Debido a que los electrones pueden moverse de una molécula a otra, la oxidación y reducción ocurren en tándem. Estos pares de reacciones se denominan reacciones de oxidación-reducción, o reacciones redox.
Portadores de energía: NAD +, NADP +, FAD y ATP
La energía liberada por la descomposición de los enlaces químicos dentro de los nutrientes puede almacenarse ya sea a través de la reducción de portadores de electrones o en los enlaces de adenosina trifosfato (ATP). En los sistemas vivos, una pequeña clase de compuestos funciona como portadores de electrones móviles, moléculas que se unen y transportan electrones de alta energía entre los compuestos en rutas. Los principales portadores de electrones que consideraremos provienen del grupo de la vitamina B y son derivados de nucleótidos; son nicotinamida adenina dinucleótido, nicotina adenina dinucleótido fosfato y flavina adenina dinucleótido. Estos compuestos se pueden reducir u oxidar fácilmente. Nicotinamida adenina dinucleótido (NAD + /NADH) es el portador de electrones móvil más común utilizado en el catabolismo. NAD + es la forma oxidada de la molécula; NADH es la forma reducida de la molécula. La nicotina adenina dinucleótido fosfato (NADP +), la forma oxidada de una variante NAD + que contiene un grupo fosfato extra, es otro importante portador de electrones; forma NADPH cuando se reduce. La forma oxidada del dinucleótido flavina adenina es FAD y su forma reducida es FADH 2. Tanto NAD + /NADH como FAD/FADH 2 son ampliamente utilizados en la extracción de energía de azúcares durante el catabolismo en quimioheterótrofos, mientras que NADP + /NADPH juega un papel importante en las reacciones anabólicas y la fotosíntesis. Colectivamente, FADH 2, NADH y NADPH a menudo se denominan tener potencia reductora debido a su capacidad para donar electrones a diversas reacciones químicas.
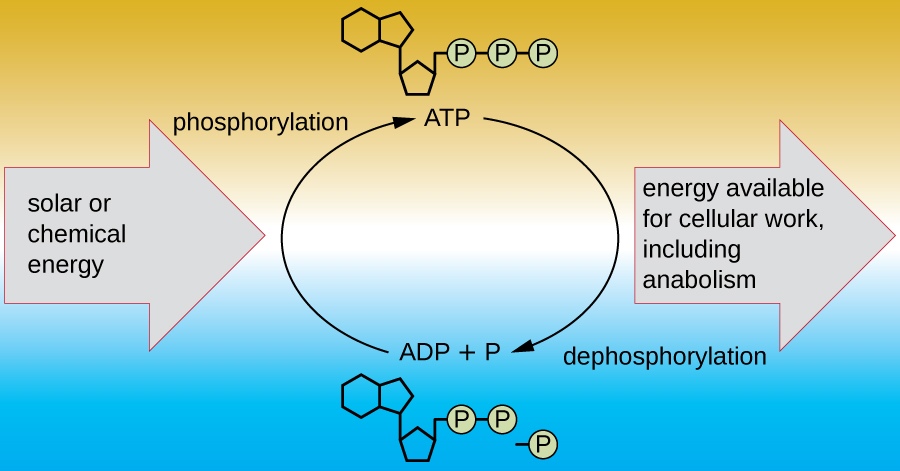
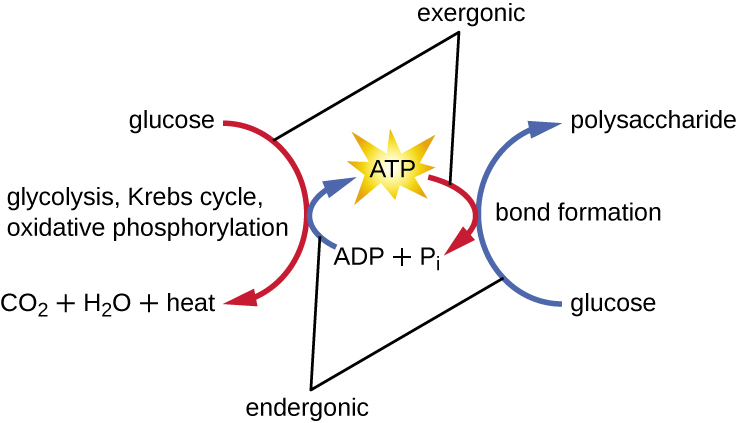
Una célula viva debe ser capaz de manejar la energía liberada durante el catabolismo de una manera que permita que la célula almacene energía de manera segura y la libere para su uso solo según sea necesario. Las células vivas logran esto usando el compuesto trifosfato de adenosina (ATP). El ATP a menudo se llama la “moneda energética” de la célula, y, al igual que la moneda, este compuesto versátil se puede utilizar para llenar cualquier necesidad energética de la célula. En el corazón del ATP se encuentra una molécula de monofosfato de adenosina (AMP), que está compuesta por una molécula de adenina unida a una molécula de ribosa y un solo grupo fosfato. La ribosa es un azúcar de cinco carbonos que se encuentra en el ARN, y AMP es uno de los nucleótidos en el ARN. La adición de un segundo grupo fosfato a esta molécula central da como resultado la formación de adenosina difosfato (ADP); la adición de un tercer grupo fosfato forma ATP (Figura\(\PageIndex{2}\)). Agregar un grupo fosfato a una molécula, un proceso llamado fosforilación, requiere energía. Los grupos fosfato están cargados negativamente y así se repelen entre sí cuando están dispuestos en serie, ya que están en ADP y ATP. Esta repulsión hace que las moléculas de ADP y ATP sean inherentemente inestables. Así, los enlaces entre los grupos fosfato (uno en ADP y dos en ATP) se denominan enlaces fosfato de alta energía. Cuando estos enlaces de alta energía se rompen para liberar un fosfato (llamado fosfato inorgánico [P i]) o dos grupos fosfato conectados (llamados pirofosfato [PP i]) del ATP a través de un proceso llamado desfosforilación, se libera energía para impulsar reacciones endergónicas (Figura\(\PageIndex{3}\)).
Ejercicio\(\PageIndex{3}\)
¿Cuál es la función de un portador de electrones?
Estructura y Función Enzimas
Una sustancia que ayuda a acelerar una reacción química es un catalizador. Los catalizadores no se utilizan ni cambian durante las reacciones químicas y, por lo tanto, son reutilizables. Mientras que las moléculas inorgánicas pueden servir como catalizadores para una amplia gama de reacciones químicas, las proteínas llamadas enzimas sirven como catalizadores para reacciones bioquímicas dentro de las células. Por lo tanto, las enzimas juegan un papel importante en el control del metabolismo celular.
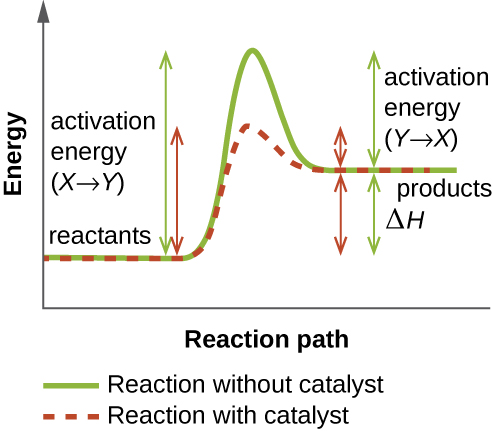
Una enzima funciona disminuyendo la energía de activación de una reacción química dentro de la célula. La energía de activación es la energía necesaria para formar o romper enlaces químicos y convertir los reactivos en productos (Figura\(\PageIndex{4}\)). Las enzimas reducen la energía de activación uniéndose a las moléculas reaccionantes y manteniéndolas de tal manera que aceleren la reacción.
Los reactivos químicos a los que se une una enzima se denominan sustratos, y la ubicación dentro de la enzima donde se une el sustrato se llama sitio activo de la enzima. Las características de los aminoácidos cerca del sitio activo crean un ambiente químico muy específico dentro del sitio activo que induce la idoneidad para unirse, aunque brevemente, a un sustrato específico (o sustratos). Debido a esta coincidencia similar a rompecabezas entre una enzima y sus sustratos, las enzimas son conocidas por su especificidad. De hecho, a medida que una enzima se une a su (s) sustrato (s), la estructura de la enzima cambia ligeramente para encontrar el mejor ajuste entre el estado de transición (un intermedio estructural entre el sustrato y el producto) y el sitio activo, así como un guante de goma se amolda a una mano insertada en él. Esta modificación de sitio activo en presencia de sustrato, junto con la formación simultánea del estado de transición, se denomina ajuste inducido (Figura\(\PageIndex{5}\)). En general, existe una enzima específicamente emparejada para cada sustrato y, por lo tanto, para cada reacción química; sin embargo, también hay cierta flexibilidad. Algunas enzimas tienen la capacidad de actuar sobre diferentes sustratos estructuralmente relacionados.
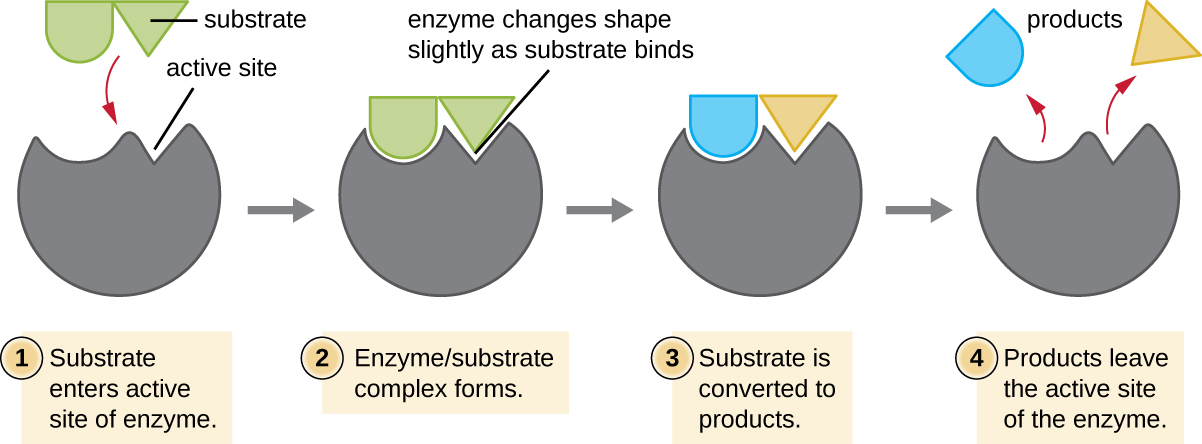
Las enzimas están sujetas a influencias por las condiciones ambientales locales como el pH, la concentración del sustrato y la temperatura. Aunque el aumento de la temperatura ambiental generalmente aumenta las velocidades de reacción, catalizado por enzimas o de otra manera, aumentar o disminuir la temperatura fuera de un rango óptimo puede afectar los enlaces químicos dentro del sitio activo, haciéndolos menos adecuados para unir sustratos. Las altas temperaturas eventualmente harán que las enzimas, como otras moléculas biológicas, se desnaturalicen, perdiendo su estructura y función tridimensionales. Las enzimas también son adecuadas para funcionar mejor dentro de un cierto rango de pH y, al igual que con la temperatura, los valores ambientales extremos de pH (ácidos o básicos) pueden hacer que las enzimas se desnaturalicen. Las cadenas laterales de aminoácidos de sitio activo tienen sus propias propiedades ácidas o básicas que son óptimas para la catálisis y, por lo tanto, son sensibles a los cambios en el pH.
Otro factor que influye en la actividad enzimática es la concentración del sustrato: La actividad enzimática se incrementa a mayores concentraciones de sustrato hasta que alcanza un punto de saturación en el que la enzima no puede unirse a ningún sustrato adicional. En general, las enzimas están optimizadas para funcionar mejor bajo las condiciones ambientales en las que viven los organismos que las producen. Por ejemplo, mientras que los microbios que habitan las aguas termales tienen enzimas que funcionan mejor a altas temperaturas, los patógenos humanos tienen enzimas que funcionan mejor a 37°C.Del mismo modo, mientras que las enzimas producidas por la mayoría de los organismos funcionan mejor a un pH neutro, los microbios que crecen en ambientes ácidos hacen que las enzimas sean optimizadas a pH bajo condiciones, permitiendo su crecimiento en esas condiciones.
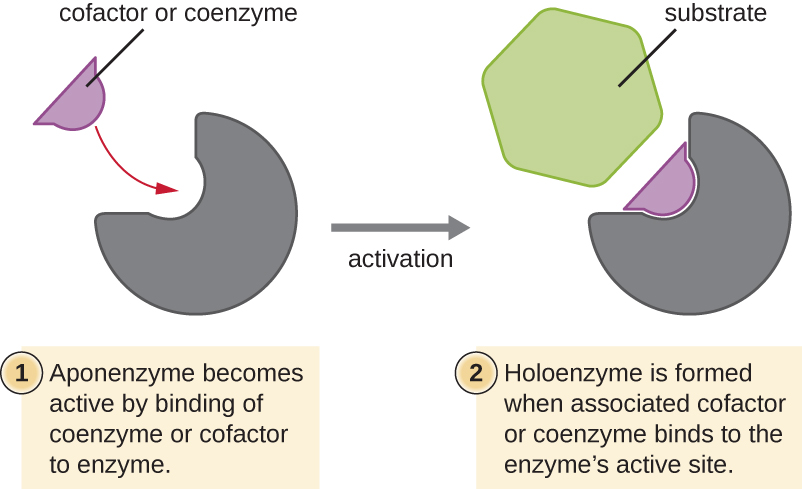
Muchas enzimas no funcionan de manera óptima, o incluso en absoluto, a menos que se unan a otras moléculas colaboradoras no proteicas específicas, ya sea temporalmente a través de enlaces iónicos o de hidrógeno o permanentemente a través de enlaces covalentes más fuertes. La unión a estas moléculas promueve una conformación y función óptimas para sus respectivas enzimas. Dos tipos de moléculas auxiliares son cofactores y coenzimas. Los cofactores son iones inorgánicos como el hierro (Fe 2+) y el magnesio (Mg 2+) que ayudan a estabilizar la conformación y función de las enzimas. Un ejemplo de una enzima que requiere un ion metálico como cofactor es la enzima que construye moléculas de ADN, la ADN polimerasa, que requiere un ion zinc unido (Zn 2+) para funcionar.
Las coenzimas son moléculas auxiliares orgánicas que se requieren para la acción enzimática. Al igual que las enzimas, no se consumen y, por lo tanto, son reutilizables. Las fuentes más comunes de coenzimas son las vitaminas dietéticas. Algunas vitaminas son precursoras de las coenzimas y otras actúan directamente como coenzimas.
Algunos cofactores y coenzimas, como la coenzima A (CoA), a menudo se unen al sitio activo de la enzima, ayudando en la química de la transición de un sustrato a un producto (Figura\(\PageIndex{6}\)). En tales casos, una enzima que carece de un cofactor o coenzima necesario se llama apoenzima y es inactiva. Por el contrario, una enzima con el cofactor o coenzima asociado necesario se llama holoenzima y es activa. El NADH y el ATP también son ejemplos de coenzimas de uso común que proporcionan electrones de alta energía o grupos fosfato, respectivamente, que se unen a las enzimas, activándolas de esta manera.
Ejercicio\(\PageIndex{4}\)
¿Qué papel juegan las enzimas en una reacción química?
Inhibidores de enzimas
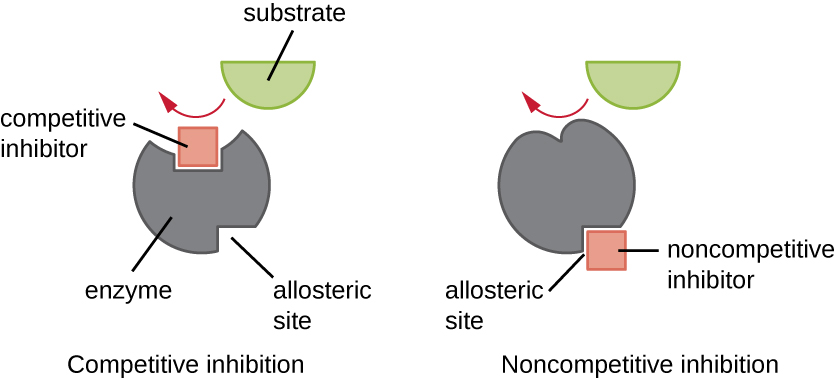
Las enzimas pueden regularse de manera que promuevan o reduzcan su actividad. Existen muchos tipos diferentes de moléculas que inhiben o promueven la función enzimática, y existen diversos mecanismos para hacerlo (Figura\(\PageIndex{7}\)). Un inhibidor competitivo es una molécula lo suficientemente similar a un sustrato que puede competir con el sustrato para unirse al sitio activo simplemente bloqueando el sustrato de la unión. Para que un inhibidor competitivo sea efectivo, la concentración de inhibidor necesita ser aproximadamente igual a la concentración de sustrato. Los sulfa proporcionan un buen ejemplo de competencia competitiva. Se utilizan para tratar infecciones bacterianas porque se unen al sitio activo de una enzima dentro de la vía de síntesis de ácido fólico bacteriano. Cuando está presente en una dosis suficiente, un fármaco sulfa impide la síntesis de ácido fólico y las bacterias son incapaces de crecer porque no pueden sintetizar ADN, ARN y proteínas. Los humanos no se ven afectados porque obtenemos ácido fólico de nuestras dietas.
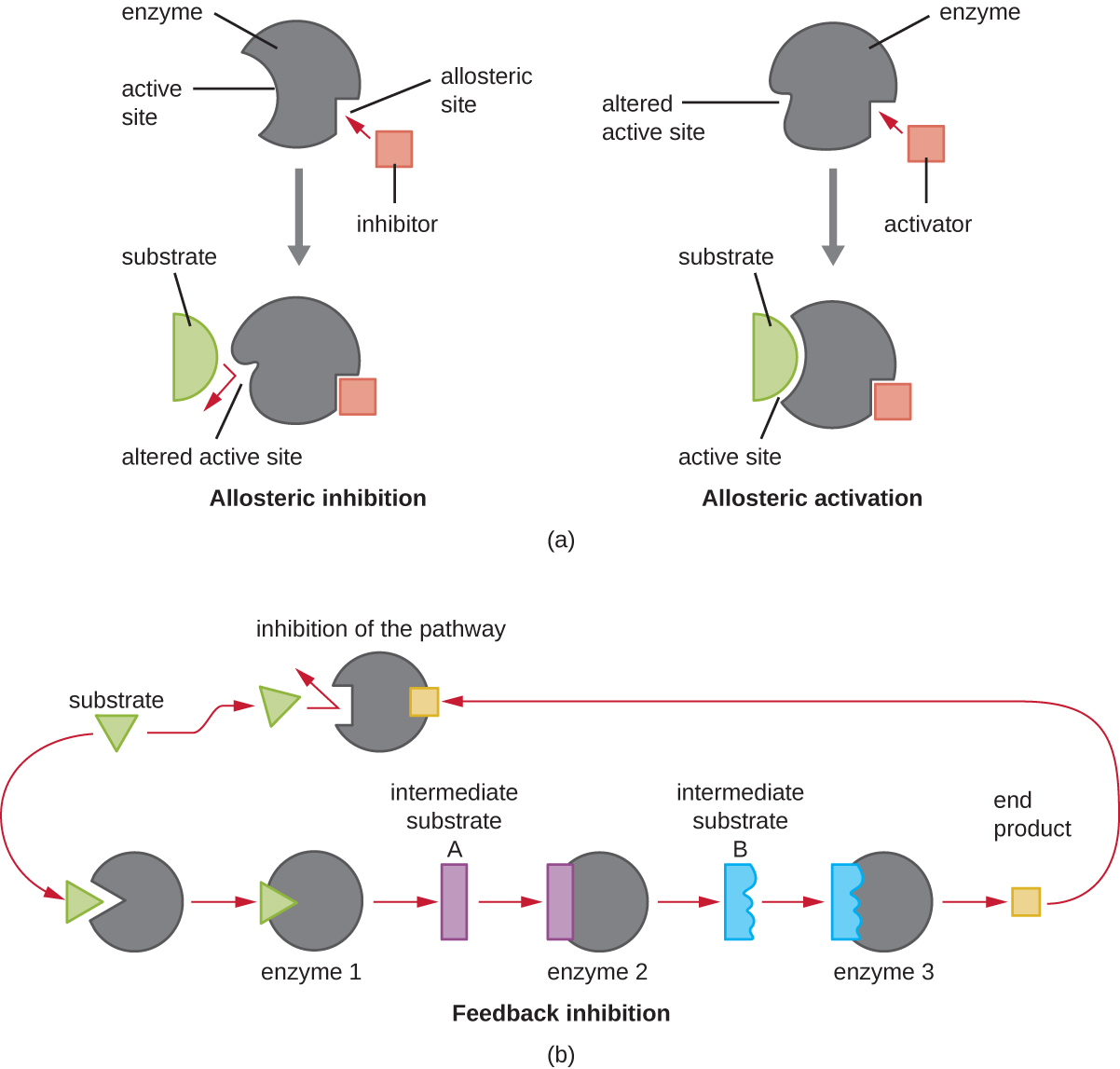
Por otro lado, un inhibidor no competitivo (alostérico) se une a la enzima en un sitio alostérico, una ubicación distinta del sitio activo, y aún logra bloquear la unión del sustrato al sitio activo induciendo un cambio conformacional que reduce la afinidad de la enzima por su sustrato (Figura \(\PageIndex{8}\)). Debido a que solo se necesita una molécula inhibidora por enzima para una inhibición efectiva, la concentración de inhibidores necesaria para la inhibición no competitiva es típicamente mucho menor que la concentración de sustrato.
Además de los inhibidores alostéricos, existen activadores alostéricos que se unen a ubicaciones en una enzima alejada del sitio activo, induciendo un cambio conformacional que aumenta la afinidad del sitio o sitios activos de la enzima por su sustrato o sustratos.
El control alostérico es un importante mecanismo de regulación de las vías metabólicas involucradas tanto en el catabolismo como en el anabolismo. De una manera más eficiente y elegante, las células han evolucionado también para utilizar los productos de sus propias reacciones metabólicas para la inhibición por retroalimentación de la actividad enzimática. La inhibición de retroalimentación implica el uso de un producto de ruta para regular su propia producción adicional. La célula responde a la abundancia de productos específicos al ralentizar la producción durante las reacciones anabólicas o catabólicas (Figura\(\PageIndex{8}\)).
Ejercicio\(\PageIndex{5}\)
Explicar la diferencia entre un inhibidor competitivo y un inhibidor no competitivo.
Conceptos clave y resumen
- El metabolismo incluye reacciones químicas que descomponen moléculas complejas (catabolismo) y aquellas que construyen moléculas complejas (anabolismo).
- Los organismos pueden clasificarse de acuerdo a su fuente de carbono. Los autótrofos convierten el dióxido de carbono inorgánico en carbono orgánico; los heterótrofos utilizan compuestos de carbono orgánicos fijos.
- Los organismos también pueden clasificarse de acuerdo a su fuente de energía. Los fototrofos obtienen su energía de la luz. Los quimiótrofos obtienen su energía a partir de compuestos químicos. Los organótrofos utilizan moléculas orgánicas y las litotrofas utilizan productos químicos inorgánicos.
- Los portadores de electrones celulares aceptan electrones de alta energía de los alimentos y luego sirven como donantes de electrones en reacciones redox posteriores. FAD/FADH 2, NAD + /NADH y NADP + /NADPH son portadores de electrones importantes.
- El trifosfato de adenosina (ATP) sirve como moneda de energía de la célula, almacenando de manera segura la energía química en sus dos enlaces de fosfato de alta energía para su uso posterior para impulsar procesos que requieren energía.
- Las enzimas son catalizadores biológicos que aumentan la velocidad de reacciones químicas dentro de las células al disminuir la energía de activación requerida para que la reacción continúe.
- En la naturaleza, las reacciones exergónicas no requieren energía más allá de la energía de activación para proceder, y liberan energía. Pueden proceder sin enzimas, pero a un ritmo lento. Por el contrario, las reacciones endergónicas requieren energía más allá de la energía de activación para ocurrir En las células, las reacciones endergónicas se acoplan a reacciones exergónicas, lo que hace que la combinación sea energéticamente favorable.
- Los sustratos se unen al sitio activo de la enzima. Este proceso típicamente altera las estructuras tanto del sitio activo como del sustrato, favoreciendo la formación en estado de transición; esto se conoce como ajuste inducido.
- Los cofactores son iones inorgánicos que estabilizan la conformación y función de las enzimas. Las coenzimas son moléculas orgánicas necesarias para la función enzimática adecuada y a menudo se derivan de vitaminas. Una enzima que carece de un cofactor o coenzima es una apoenzima; una enzima con un cofactor o coenzima unido es una holoenzima.
- Los inhibidores competitivos regulan las enzimas al unirse al sitio activo de una enzima, evitando la unión al sustrato. Los inhibidores no competitivos (alostéricos) se unen a sitios alostéricos, induciendo un cambio conformacional en la enzima que impide que funcione. La inhibición de retroalimentación ocurre cuando el producto de una vía metabólica se une de manera no competitiva a una enzima al principio de la ruta, impidiendo finalmente la síntesis del producto.


