15.3: Factores de Virulencia
- Page ID
- 54621
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Objetivos de aprendizaje
- Explicar cómo los factores de virulencia contribuyen a los signos y síntomas de la enfermedad infecciosa
- Diferenciar entre endotoxinas y exotoxinas
- Describir y diferenciar entre diversos tipos de exotoxinas
- Describir los mecanismos que utilizan los virus para la adhesión y la variación antigénica
En el apartado anterior, explicamos que algunos patógenos son más virulentos que otros. Esto se debe a los factores de virulencia únicos que producen los patógenos individuales, los cuales determinan la extensión y gravedad de la enfermedad que pueden causar. Los factores de virulencia de un patógeno están codificados por genes que pueden identificarse mediante postulados moleculares de Koch. Cuando los genes que codifican factores de virulencia son inactivados, la virulencia en el patógeno disminuye. En esta sección, examinamos diversos tipos y ejemplos específicos de factores de virulencia y cómo contribuyen a cada paso de la patogénesis.
Factores de Virulencia para la Adhesión
Como se discutió en el apartado anterior, los dos primeros pasos en la patogénesis son la exposición y la adhesión. Recordemos que una adhesina es una proteína o glicoproteína que se encuentra en la superficie de un patógeno que se adhiere a los receptores en la célula huésped. Las adhesinas se encuentran en patógenos bacterianos, virales, fúngicos y protozoarios. Un ejemplo de adhesina bacteriana es la adhesina fimbrial tipo 1, una molécula que se encuentra en las puntas de las fimbrias de E. coli enterotoxigénica (ETEC). Recordemos que las fimbrias son cerdas proteicas parecidas al pelo en la superficie celular. La adhesina fimbrial tipo 1 permite que las fimbrias de las células ETEC se unan a los glicanos de manosa expresados en las células epiteliales intestinales. En la tabla se\(\PageIndex{1}\) enumeran las adhesinas comunes que se encuentran en algunos de los patógenos que hemos discutido o veremos más adelante en este capítulo.
| Patógeno | Enfermedad | Adhesina | Sitio de adjunto | |
|---|---|---|---|---|
| Streptococcus pyogenes | garganta estreptocócica | Proteína F | Células epiteliales respiratorias | |
| Streptococcus mutans | Caries | Adhesina P1 | Dientes | |
| Neisseria gonorrhoeae | Gonorrea | Pili tipo IV | Células epiteliales uretrales | |
| E. coli enterotoxigénica (ETEC) | Diarrea del viajero | Fimbrias tipo 1 | Células epiteliales intestinales | |
| Vibrio cholerae | Cólera | Pili de N-metilfenilalanina | Células epiteliales intestinales |
Enfoque Clínico: Parte 3
La presencia de bacterias en la sangre de Michael es un signo de infección, ya que la sangre normalmente es estéril. No hay indicios de que la bacteria ingresara a la sangre a través de una lesión. En cambio, parece que el portal de entrada fue la vía gastrointestinal. Con base en los síntomas de Michael, los resultados de su análisis de sangre, y el hecho de que Michael fue el único de la familia en participar de los hot dogs, el médico sospecha que Michael está sufriendo un caso de listeriosis.
Listeria monocytogenes, el patógeno intracelular facultativo que causa la listeriosis, es un contaminante común en alimentos listos para comer como carnes para el almuerzo y productos lácteos. Una vez ingeridas, estas bacterias invaden las células epiteliales intestinales y se translocan al hígado, donde crecen dentro de las células hepáticas. La listeriosis es fatal en aproximadamente una de cada cinco personas sanas normales, y las tasas de mortalidad son ligeramente superiores en pacientes con afecciones preexistentes que debilitan la respuesta inmune. Un grupo de genes de virulencia codificados en una isla de patogenicidad es responsable de la patogenicidad de L. monocytogenes. Estos genes están regulados por un factor transcripcional conocido como factor de liberación de cadena peptídica 1 (prfA). Uno de los genes regulados por prfA es hyl, que codifica una toxina conocida como listeriolisina O (LLO), que permite que la bacteria escape de las vacuolas al entrar en una célula hospedadora. Un segundo gen regulado por prfA es ActA, que codifica una proteína de superficie conocida como proteína inductora de ensamblaje de actina (ActA). ActA se expresa en la superficie de Listeria y polimeriza actina huésped. Esto permite que la bacteria produzca colas de actina, se mueva alrededor del citoplasma de la célula y se extienda de célula a célula sin salir al compartimento extracelular.
La condición de Michael ha comenzado a empeorar. Ahora experimenta rigidez en el cuello y hemiparesia (debilidad de un lado del cuerpo). Preocupado de que la infección se esté propagando, el médico decide realizar pruebas adicionales para determinar qué es lo que está causando estos nuevos síntomas.
Ejercicio\(\PageIndex{1}\)
- ¿Qué tipo de patógeno causa la listeriosis y qué factores de virulencia contribuyen a los signos y síntomas que experimenta Michael?
- ¿Es probable que la infección se propague de la sangre de Michael? Si es así, ¿cómo podría explicar esto sus nuevos síntomas?
Exoenzimas bacterianas y toxinas como factores de virulencia
Después de la exposición y adhesión, el siguiente paso en la patogénesis es la invasión, que puede involucrar enzimas y toxinas. Muchos patógenos logran la invasión al ingresar al torrente sanguíneo, un medio efectivo de diseminación porque los vasos sanguíneos pasan cerca de todas las células del cuerpo. La desventaja de este mecanismo de dispersión es que la sangre también incluye numerosos elementos del sistema inmune. Se utilizan diversos términos que terminan en —emia para describir la presencia de patógenos en el torrente sanguíneo. La presencia de bacterias en la sangre se llama bacteriemia. La bacteriemia que involucra piógenos (bacterias formadoras de pus) se llama piemia. Cuando se encuentran virus en la sangre, se llama viremia. El término toxemiadescribe el padecimiento cuando se encuentran toxinas en la sangre. Si las bacterias están presentes y se multiplican en la sangre, esta afección se llama septicemia.
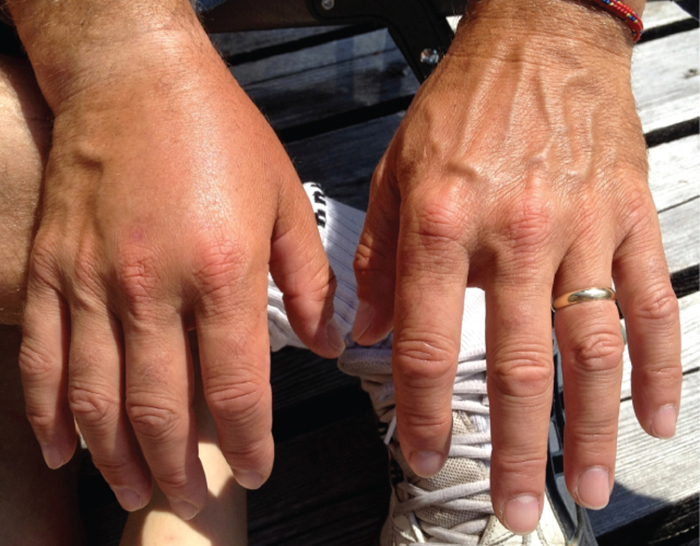
Los pacientes con septicemia son descritos como sépticos, lo que puede provocar shock, una disminución de la presión arterial potencialmente mortal (presión sistólica <90 mm Hg) que impide que las células y órganos reciban suficiente oxígeno y nutrientes. Algunas bacterias pueden causar choque a través de la liberación de toxinas (factores de virulencia que pueden causar daño tisular) y conducir a una presión arterial baja. Las bacterias gramnegativas son engullidas por fagocitos del sistema inmune, que luego liberan el factor de necrosis tumoral, una molécula involucrada en la inflamación y la fiebre. El factor de necrosis tumoral se une a los capilares sanguíneos para aumentar su permeabilidad, permitiendo que los fluidos pasen fuera de los vasos sanguíneos y hacia los tejidos, causando hinchazón, o edema (Figura\(\PageIndex{1}\)). Con altas concentraciones de factor de necrosis tumoral, la reacción inflamatoria es severa y se pierde suficiente líquido del sistema circulatorio para que la presión arterial disminuya a niveles peligrosamente bajos. Esto puede tener consecuencias nefastas porque el corazón, los pulmones y los riñones dependen de la presión arterial normal para su correcto funcionamiento; así, pueden ocurrir fallas multiorgánicas, shock y muerte.
Exoenzimas
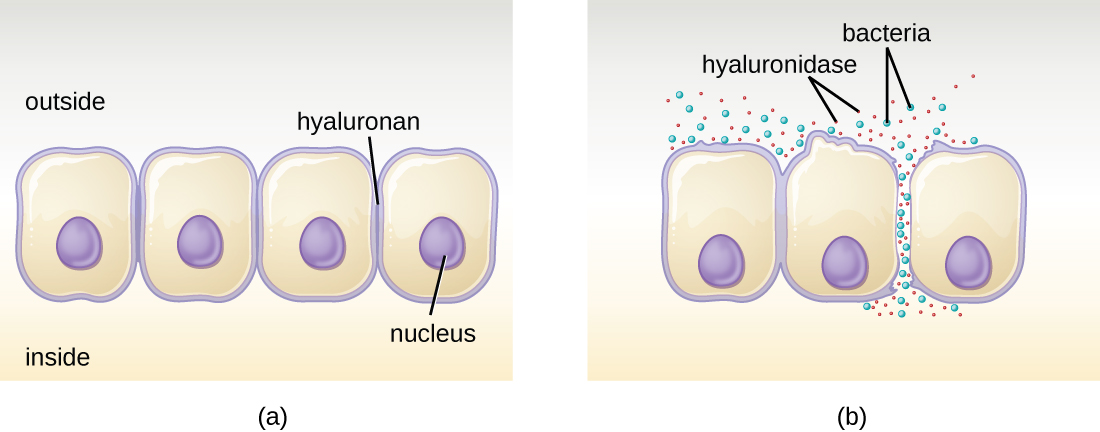
Algunos patógenos producen enzimas extracelulares, o exoenzimas, que les permiten invadir células hospedadoras y tejidos más profundos. Las exoenzimas tienen una amplia variedad de dianas. Algunas clases generales de exoenzimas y patógenos asociados se enumeran en la Tabla\(\PageIndex{2}\). Cada una de estas exoenzimas funciona en el contexto de una estructura tisular particular para facilitar la invasión o apoyar su propio crecimiento y defenderse contra el sistema inmune. Por ejemplo, la hialuronidasa S, una enzima producida por patógenos como Staphylococcus aureus, Streptococcus pyogenes y Clostridium perfringens, degrada el glucósido hylauronan (ácido hialurónico), que actúa como un cemento intercelular entre células adyacentes en tejido (Figura\(\PageIndex{2}\)). Esto permite que el patógeno pase a través de las capas de tejido en el portal de entrada y se disemine en otra parte del cuerpo (Figura\(\PageIndex{2}\)).
| Clase | Ejemplo | Función |
|---|---|---|
| Glicohidrolasas | Hialuronidasa S en Staphylococcus aureus | Degrada el ácido hialurónico que une las células para promover la propagación a través de los tejidos |
| Nucleasas | DNasa producida por S. aureus | Degrada el ADN liberado por las células moribundas (bacterias y células hospedadoras) que pueden atrapar a las bacterias, promoviendo así la propagación |
| Fosfolipasas | Fosfolipasa C de Bacillus anthracis | Degrada la bicapa fosfolipídica de las células hospedadoras, causando lisis celular y degradando la membrana de los fagosomas para permitir el escape al citoplasma |
| Proteasas | Colagenasa en Clostridium perfringens | Degrada el colágeno en el tejido conectivo para promover la propagación |
Las nucleasas producidas por patógenos, como la DNasa producida por S. aureus, degradan el ADN extracelular como medio de escape y diseminación a través del tejido. A medida que las células bacterianas y hospedadoras mueren en el sitio de infección, se lisan y liberan su contenido intracelular. El cromosoma del ADN es la más grande de las moléculas intracelulares, y las masas de ADN extracelular pueden atrapar bacterias y prevenir su propagación. S. aureus produce una DNasa para degradar la malla de ADN extracelular para que pueda escapar y extenderse a los tejidos adyacentes. Esta estrategia también es utilizada por S. aureus y otros patógenos para degradar y escapar de las redes de ADN extracelular producidas por los fagocitos del sistema inmune para atrapar a las bacterias.
Las enzimas que degradan los fosfolípidos de las membranas celulares se denominan fosfolipasas. Sus acciones son específicas en cuanto al tipo de fosfolípidos sobre los que actúan y donde escinden enzimáticamente las moléculas. El patógeno responsable del ántrax, B. anthracis, produce fosfolipasa C. Cuando B. anthracis es ingerido por células fagocíticas del sistema inmune, la fosfolipasa C degrada la membrana del fagosoma antes de que pueda fusionarse con el lisosoma, permitiendo que el patógeno escape al interior del citoplasma y multiplicar. Las fosfolipasas también pueden dirigirse a la membrana que encierra el fagosoma dentro de las células fagocíticas. Como se describió anteriormente en este capítulo, este es el mecanismo utilizado por patógenos intracelulares como L. monocytogenes y Rickettsia para escapar del fagosoma y multiplicarse dentro del citoplasma de las células fagocíticas. El papel de las fosfolipasas en la virulencia bacteriana no se limita al escape fagosómico. Muchos patógenos producen fosfolipasas que actúan degradando las membranas celulares y causan la lisis de las células diana. Estas fosfolipasas están involucradas en la lisis de glóbulos rojos, glóbulos blancos y células tisulares.
Los patógenos bacterianos también producen diversas enzimas que digieren proteínas, o proteasas. Las proteasas pueden clasificarse de acuerdo con su sustrato diana (por ejemplo, las serina proteasas se dirigen a proteínas con el aminoácido serina) o si contienen metales en su sitio activo (por ejemplo, las metaloproteasas de zinc contienen un ion zinc, que es necesario para la actividad enzimática).
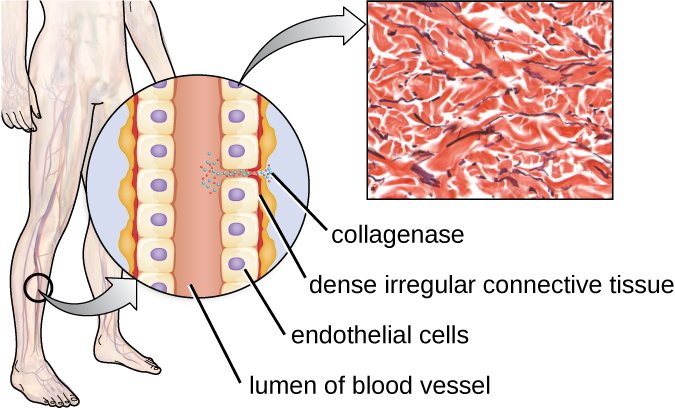
Un ejemplo de una proteasa que contiene un ión metálico es la exoenzima colagenasa. La colagenasa digiere el colágeno, la proteína dominante en el tejido conectivo. El colágeno se puede encontrar en la matriz extracelular, especialmente cerca de membranas mucosas, vasos sanguíneos, nervios y en las capas de la piel. Similar a la hialuronidasa, la colagenasa permite que el patógeno penetre y se propague a través del tejido huésped al digerir esta proteína del tejido conectivo. La colagenasa producida por la bacteria grampositiva Clostridium perfringens, por ejemplo, permite a la bacteria abrirse paso a través de las capas tisulares y posteriormente entrar y multiplicarse en la sangre (septicemia). C. perfringens luego usa toxinas y una fosfolipasa para causar lisis celular y necrosis. Una vez que las células hospedadoras han muerto, la bacteria produce gas fermentando los carbohidratos musculares. La necrosis generalizada del tejido y el gas acompañante son característicos de la condición conocida como gangrena gaseosa (Figura\(\PageIndex{3}\)).
Toxinas
Además de las exoenzimas, ciertos patógenos son capaces de producir toxinas, venenos biológicos que ayudan en su capacidad de invadir y causar daño a los tejidos. La capacidad de un patógeno para producir toxinas para causar daño a las células hospedadoras se llama toxigenicidad.
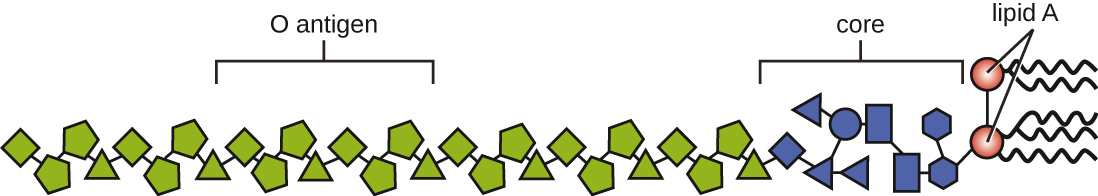
Las toxinas pueden ser categorizadas como endotoxinas o exotoxinas. El lipopolisacárido (LPS) que se encuentra en la membrana externa de bacterias gramnegativas se denomina endotoxina (Figura\(\PageIndex{4}\)). Durante la infección y la enfermedad, los patógenos bacterianos gramnegativos liberan endotoxina ya sea cuando la célula muere, dando como resultado la desintegración de la membrana, o cuando la bacteria sufre fisión binaria. El componente lipídico de la endotoxina, el lípido A, es responsable de las propiedades tóxicas de la molécula de LPS. El lípido A está relativamente conservado en diferentes géneros de bacterias gramnegativas; por lo tanto, las propiedades tóxicas del lípido A son similares independientemente del patógeno gramnegativo. De manera similar a la del factor de necrosis tumoral, el lípido A desencadena la respuesta inflamatoria del sistema inmunitario (ver Inflamación y Fiebre). Si la concentración de endotoxina en el cuerpo es baja, la respuesta inflamatoria puede proporcionar al huésped una defensa efectiva contra la infección; por otro lado, las altas concentraciones de endotoxina en la sangre pueden provocar una respuesta inflamatoria excesiva, lo que lleva a una caída severa de la presión arterial, multiorgánica fracaso, y muerte.
Un método clásico de detección de endotoxinas es mediante el uso de la prueba de lisado de amebocitos de Limulus (LAL). En este procedimiento, las células sanguíneas (amebocitos) del cangrejo herradura (Limulus polyphemus) se mezclan con suero de un paciente. Los amebocitos reaccionarán ante la presencia de cualquier endotoxina. Esta reacción se puede observar ya sea cromogénicamente (color) o buscando que la coagulación (reacción de coagulación) se produzca dentro del suero. Un método alternativo que se ha utilizado es un ensayo inmunoabsorbente ligado a enzimas (ELISA) que utiliza anticuerpos para detectar la presencia de endotoxina.
A diferencia del lípido tóxico A de la endotoxina, las exotoxinas son moléculas proteicas que son producidas por una amplia variedad de bacterias patógenas vivas. Aunque algunos patógenos gramnegativos producen exotoxinas, la mayoría son producidos por patógenos grampositivos. Las exotoxinas difieren de la endotoxina en varias otras características clave, resumidas en la Tabla\(\PageIndex{3}\). A diferencia de la endotoxina, que estimula una respuesta inflamatoria sistémica general cuando se libera, las exotoxinas son mucho más específicas en su acción y en las células con las que interactúan. Cada exotoxina se dirige a receptores específicos en células específicas y daña esas células a través de mecanismos moleculares únicos. La endotoxina permanece estable a altas temperaturas, y requiere calentamiento a 121 °C (250 °F) durante 45 minutos para inactivarse. Por el contrario, la mayoría de las exotoxinas son lábiles al calor debido a su estructura proteica, y muchas se desnaturalizan (inactivan) a temperaturas superiores a 41 °C (106 °F). Como se discutió anteriormente, la endotoxina puede estimular una respuesta inflamatoria letal a concentraciones muy altas y tiene una LD medida 50 de 0.24 mg/kg. Por el contrario, concentraciones muy pequeñas de exotoxinas pueden ser letales. Por ejemplo, la toxina botulínica, que causa botulismo, tiene una LD 50 de 0.000001 mg/kg (240,000 veces más letal que la endotoxina).
| Característica | Endotoxina | Exotoxina |
|---|---|---|
| Fuente | Bacterias Gram-negativas | Bacterias grampositivas (principalmente) y gramnegativas |
| Composición | Componente lípido A del lipopolisacárido | Proteína |
| Efecto en el anfitrión | Síntomas sistémicos generales de inflamación y fiebre | Daño específico a las células dependiente de la focalización mediada por receptores de las células y mecanismos específicos de acción |
| Estabilidad al calor | Estable al calor | La mayoría son lábiles al calor, pero algunos son estables al calor |
| LD 50 | Alto | Bajo |
Las exotoxinas se pueden agrupar en tres categorías en función de su objetivo: diana intracelular, disrupción de membrana y superantígenos. \(\PageIndex{4}\)La tabla proporciona ejemplos de toxinas bien caracterizadas dentro de cada una de estas tres categorías.
| Categoría | Ejemplo | Patógeno | Mecanismo y enfermedad |
|---|---|---|---|
| Toxinas intracelulares | Toxina del cólera | Vibrio cholerae | Activación de adenilato ciclasa en células intestinales, provocando aumento de los niveles de adenosina monofosfato cíclico (AMPc) y secreción de fluidos y electrolitos fuera de las células, causando diarrea |
| Toxina tetánica | Clostridium teta ni | Inhibe la liberación de neurotransmisores inhibitorios en el sistema nervioso central, causando parálisis espástica | |
| Toxina botulínica | Clostridium botulinum | Inhibe la liberación del neurotransmisor acetilcolina de las neuronas, lo que resulta en parálisis flácida | |
| Toxina de la difteria | Corynebacterium diphtheriae | Inhibición de la síntesis proteica, causando muerte celular | |
| Toxinas que alteran la membrana | Estreptolisina | Streptococcus pyogenes | Proteínas que se ensamblan en poros en las membranas celulares, alterando su función y matando a la célula |
| Neumolisina | Streptococcus pneumoniae | ||
| Toxina alfa | Staphylococcus aureus | ||
| Toxina alfa | Clostridium perfringens | Fosfolipasas que degradan los fosfolípidos de la membrana celular, alterando la función de la membrana y matando la célula | |
| Fosfolipasa C | Pseudomonas aeruginosa | ||
| Toxina beta | Staphylococcus aureus | ||
| Superantígenos | Toxina del síndrome de choque | Staphylococcus aureus | Estimula la activación excesiva de las células del sistema inmune y la liberación de citocinas (mediadores químicos) de las células del sistema inmune. Fiebre potencialmente mortal, inflamación y shock son el resultado. |
| Exotoxina mitogénica estreptocócica | Streptococcus pyogenes | ||
| Toxinas pirógenas estreptocócicas | Streptococcus pyogenes |
Las toxinas diana intracelulares comprenden dos componentes: A para la actividad y B para la unión. Así, estos tipos de toxinas se conocen como exotoxinas A-B (Figura\(\PageIndex{5}\)). El componente B es responsable de la especificidad celular de la toxina y media la unión inicial de la toxina a receptores específicos de la superficie celular. Una vez que la toxina A-B se une a la célula huésped, es llevada a la célula por endocitosis y atrapada en una vacuola. Las subunidades A y B se separan a medida que la vacuola se acidifica. La subunidad A luego ingresa al citoplasma celular e interfiere con la función celular interna específica a la que se dirige.
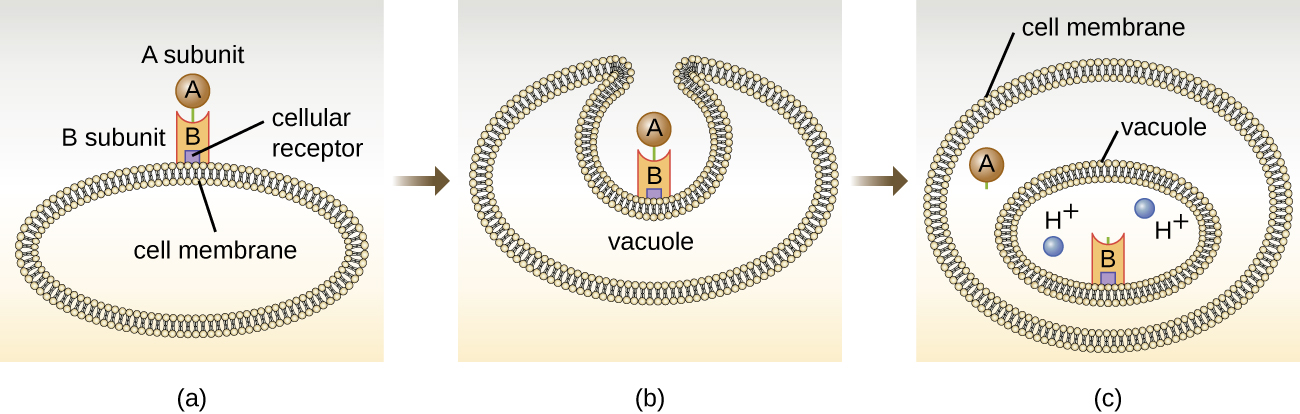
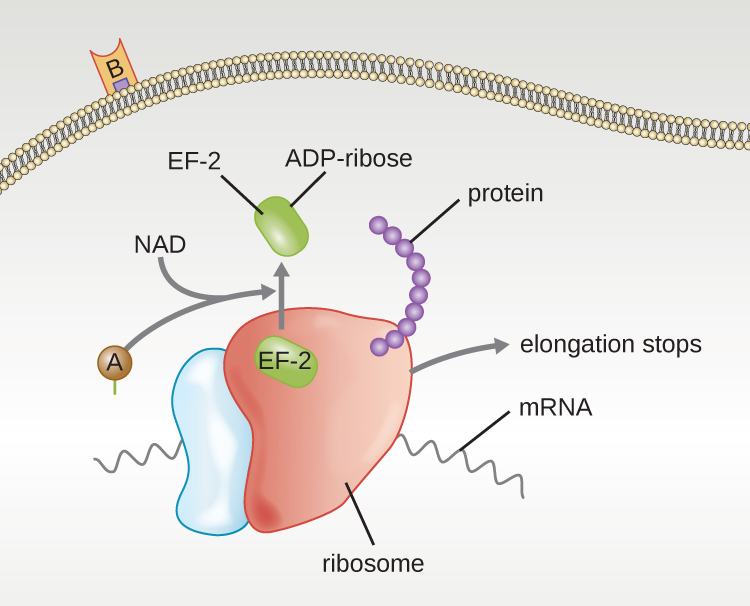
Cuatro ejemplos únicos de toxinas A-B son las toxinas difteria, cólera, botulínica y tetánica. La toxina diftérica es producida por la bacteria grampositiva Corynebacterium diphtheriae, agente causante de la difteria nasofaríngea y cutánea. Después de que la subunidad A de la toxina diftérica se separa y obtiene acceso al citoplasma, facilita la transferencia de adenosina difosfato (ADP) -ribosa a una proteína factor de elongación (EF-2) que es necesaria para la síntesis de proteínas. De ahí que la toxina de la difteria inhibe la síntesis de proteínas en la célula hospedadora, matando finalmente a la célula (Figura\(\PageIndex{6}\)).
La toxina del cólera es una enterotoxina producida por la bacteria gramnegativa Vibrio cholerae y está compuesta por una subunidad A y cinco subunidades B. El mecanismo de acción de la toxina del cólera es complejo. Las subunidades B se unen a receptores en la célula epitelial intestinal del intestino delgado. Después de ingresar al citoplasma de la célula epitelial, la subunidad A activa una proteína G intracelular. La proteína G activada, a su vez, conduce a la activación de la enzima adenilciclasa, que comienza a producir un aumento en la concentración de AMP cíclico (una molécula mensajera secundaria). El aumento de cAMP altera la fisiología normal de las células epiteliales intestinales y provoca que secreten cantidades excesivas de líquido y electrolitos en la luz del tracto intestinal, resultando en diarrea severa de “heces de agua de arroz” característica del cólera.
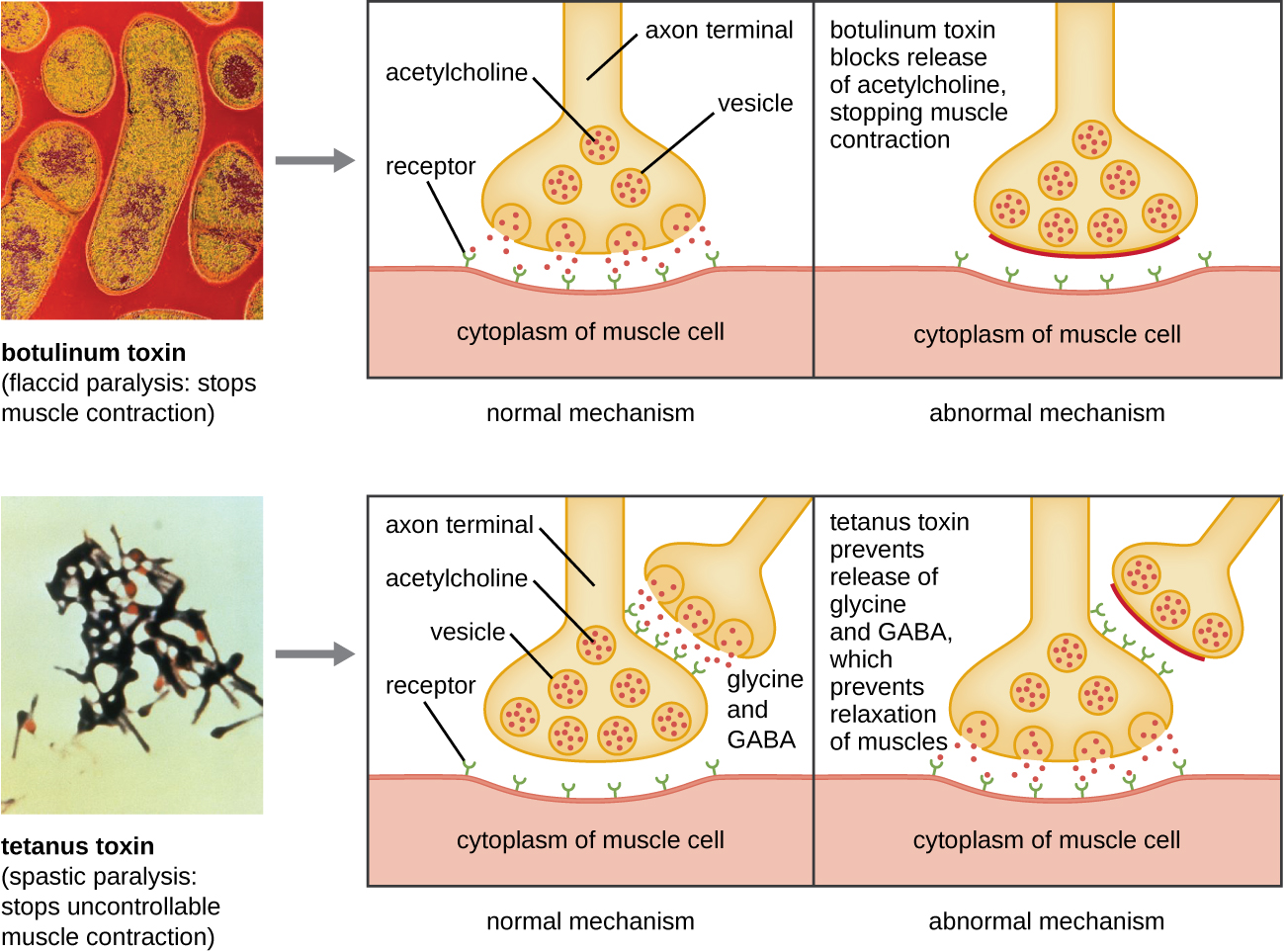
La toxina botulínica (también conocida como botox) es una neurotoxina producida por la bacteria grampositiva Clostridium botulinum. Es la sustancia más agudamente tóxica conocida hasta la fecha. La toxina está compuesta por una subunidad A ligera y una subunidad B de la cadena proteica pesada. La subunidad B se une a las neuronas para permitir que la toxina botulínica entre en las neuronas en la unión neuromuscular. La subunidad A actúa como proteasa, escindiendo proteínas involucradas en la liberación de acetilcolina, una molécula neurotransmisora por parte de las neuronas. Normalmente, las neuronas liberan acetilcolina para inducir contracciones de fibra muscular. La capacidad de la toxina para bloquear la liberación de acetilcolina resulta en la inhibición de las contracciones musculares, lo que lleva a la relajación muscular. Esto tiene el potencial de dejar de respirar y causar la muerte. Debido a su acción, se utilizan bajas concentraciones de botox para procedimientos cosméticos y médicos, incluyendo la eliminación de arrugas y el tratamiento de la vejiga hiperactiva.
Otra neurotoxina es la toxina tetánica, la cual es producida por la bacteria grampositiva Clostridium tetani. Esta toxina también tiene una subunidad A ligera y una subunidad B de cadena proteica pesada. A diferencia de la toxina botulínica, la toxina tetánica se une a las interneuronas inhibidoras, las cuales son responsables de la liberación de los neurotransmisores inhibitorios glicina y ácido gamma-aminobutírico (GABA). Normalmente, estos neurotransmisores se unen a las neuronas en la unión neuromuscular, resultando en la inhibición de la liberación de acetilcolina. La toxina tetánica inhibe la liberación de glicina y GABA de la interneurona, lo que resulta en una contracción muscular permanente. El primer síntoma suele ser la rigidez de la mandíbula (mandíbula cerrada). Siguen espasmos musculares violentos en otras partes del cuerpo, que suelen culminar con insuficiencia respiratoria y muerte. La figura\(\PageIndex{7}\) muestra las acciones de las toxinas botulínicas y tetánicas.
Las toxinas que alteran la membrana afectan la función de la membrana celular, ya sea formando poros o alterando la bicapa fosfolipídica en las membranas de las células hospedadoras. Dos tipos de exotoxinas que interrumpen la membrana son las hemolisinas y las leucocidinas, que forman poros en las membranas celulares, provocando fugas del contenido citoplásmico y lisis celular. Originalmente se pensaba que estas toxinas se dirigían a los glóbulos rojos (eritrocitos) y a los glóbulos blancos (leucocitos), respectivamente, pero ahora sabemos que también pueden afectar a otras células. La bacteria grampositiva Streptococcus pyogenes produce estreptolisinas, hemolisinas solubles en agua que se unen a los restos de colesterol en la membrana de la célula huésped para formar un poro. Los dos tipos de estreptolisinas, O y S, se clasifican por su capacidad para causar hemólisis en eritrocitos en ausencia o presencia de oxígeno. La estreptolisina O no es activa en presencia de oxígeno, mientras que la estreptolisina S es activa en presencia de oxígeno. Otras toxinas importantes que interrumpen la membrana son la toxina alfa de Staphylococcus aureus y la neumolisina de Streptococcus pneumoniae.
Las fosfolipasas bacterianas son toxinas que alteran la membrana que degradan la bicapa fosfolipídica de las membranas celulares en lugar de formar poros. Ya hemos discutido las fosfolipasas asociadas a especies de B. anthracis, L. pneumophila y Rickettsia que permiten que estas bacterias efectúen la lisis de los fagosomas. Estas mismas fosfolipasas también son hemolisinas. Otras fosfolipasas que funcionan como hemolisinas incluyen la toxina alfa de Clostridium perfringens, la fosfolipasa C de P. aeruginosa y la toxina beta de Staphylococcus aureus.
Algunas cepas de S. aureus también producen una leucocidina llamada leucocidina Panton-Valentine (PVL). El PVL consiste en dos subunidades, S y F. El componente S actúa como la subunidad B de una exotoxina A-B en que se une a glicolípidos en la membrana plasmática externa de las células animales. El componente F actúa como la subunidad A de una exotoxina A-B y lleva la actividad enzimática. La toxina se inserta y se ensambla en un poro en la membrana. Los genes que codifican PVL están más frecuentemente presentes en cepas de S. aureus que causan infecciones cutáneas y neumonía. 1 La PVL promueve infecciones de la piel al causar edema, eritema (enrojecimiento de la piel debido a la dilatación de los vasos sanguíneos) y necrosis cutánea. También se ha demostrado que la PVL causa neumonía necrotizante. La PVL promueve efectos proinflamatorios y citotóxicos sobre los leucocitos alveolares. Esto da como resultado la liberación de enzimas de los leucocitos, que, a su vez, provocan daños en el tejido pulmonar.
La tercera clase de exotoxinas son los superantígenos. Se trata de exotoxinas que desencadenan una estimulación excesiva e inespecífica de las células inmunitarias para secretar citoquinas (mensajeros químicos). La producción excesiva de citocinas, a menudo llamada tormenta de citocinas, provoca una fuerte respuesta inmune e inflamatoria que puede causar fiebre alta potencialmente mortal, presión arterial baja, falla multiorgánica, shock y muerte. El superantígeno prototipo es la toxina del síndrome de choque tóxico de S. aureus. La mayoría de los casos de síndrome de choque tóxico se asocian con colonización vaginal por S. aureus productora de toxinas en mujeres menstruantes; sin embargo, también puede ocurrir colonización de otros sitios corporales. Algunas cepas de Streptococcus pyogenes también producen superantígenos; se les conoce como las exotoxinas mitogénicas estreptocócicas y las toxinas pirogénicas estreptocócicas.
Ejercicio\(\PageIndex{2}\)
- Describir cómo las exoenzimas contribuyen a la invasión bacteriana.
- Explicar la diferencia entre exotoxinas y endotoxinas.
- Nombrar las tres clases de exotoxinas.
Factores de Virulencia para Supervivencia en el Huésped y Evasión Inmune
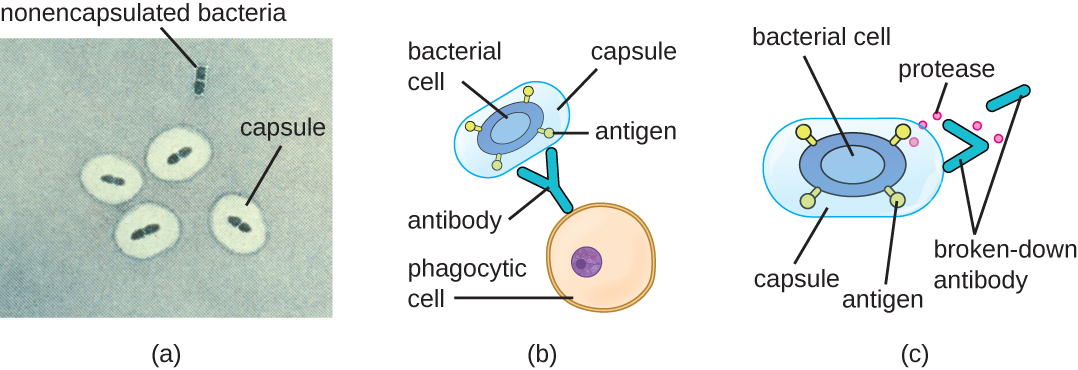
Evadir el sistema inmunológico también es importante para la invasividad. Las bacterias utilizan una variedad de factores de virulencia para evadir la fagocitosis por parte de las células del sistema inmune. Por ejemplo, muchas bacterias producen cápsulas, que se utilizan en la adhesión pero también ayudan en la evasión inmune al prevenir la ingestión por los fagocitos. La composición de la cápsula evita que las células inmunitarias puedan adherirse y luego fagocitar la célula. Además, la cápsula hace que la célula bacteriana sea mucho más grande, lo que dificulta que las células inmunitarias engullen al patógeno (Figura\(\PageIndex{8}\)). Una bacteria productora de cápsulas notable es el patógeno grampositivo Streptococcus pneumoniae, que causa neumonía neumocócica, meningitis, septicemia y otras infecciones del tracto respiratorio. Las cepas encapsuladas de S. pneumoniae son más virulentas que las no encapsuladas y tienen más probabilidades de invadir el torrente sanguíneo y causar septicemia y meningitis.
Algunos patógenos también pueden producir proteasas para protegerse contra la fagocitosis. Como se describe en Adaptive Specific Host Defensses, el sistema inmune humano produce anticuerpos que se unen a moléculas superficiales que se encuentran en bacterias específicas (por ejemplo, cápsulas, fimbrias, flagelos, LPS). Esta unión inicia la fagocitosis y otros mecanismos de eliminación y eliminación antibacteriana. Las proteasas combaten la destrucción y eliminación mediada por anticuerpos atacando y digiriendo las moléculas del anticuerpo (Figura\(\PageIndex{8}\)).
Además de las cápsulas y proteasas, algunos patógenos bacterianos producen otros factores de virulencia que les permiten evadir el sistema inmunológico. Las fimbrias de ciertas especies de Streptococcus contienen proteína M, que altera la superficie de Streptococcus e inhibe la fagocitosis al bloquear la unión de las moléculas del complemento que ayudan a los fagocitos a ingerir patógenos bacterianos. La bacteria ácido-resistente Mycobacterium tuberculosis (el agente causante de la tuberculosis) produce una sustancia cerosa conocida como ácido micólico en su envoltura celular. Cuando es engullido por fagocitos en el pulmón, la capa protectora de ácido micólico permite que la bacteria resista algunos de los mecanismos de destrucción dentro del fagolisosoma.
Algunas bacterias producen factores de virulencia que promueven la infección al explotar moléculas producidas naturalmente por el huésped. Por ejemplo, la mayoría de las cepas de Staphylococcus aureus producen la exoenzima coagulasa, que explota el mecanismo natural de coagulación de la sangre para evadir el sistema inmunológico. Normalmente, la coagulación de la sangre se desencadena en respuesta al daño de los vasos sanguíneos; las plaquetas comienzan a tapar el coágulo, y se produce una cascada de reacciones en las que el fibrinógeno, una proteína soluble producida por el hígado, se escinde en fibrina. La fibrina es una proteína insoluble similar a un hilo que se une a las plaquetas de la sangre, se entrecruza y se contrae para formar una malla de plaquetas agrupadas y glóbulos rojos. El coágulo resultante evita una mayor pérdida de sangre de los vasos sanguíneos dañados. Sin embargo, si las bacterias liberan coagulasa en el torrente sanguíneo, la cascada de fibrinógeno a fibrina se desencadena en ausencia de daño en los vasos sanguíneos. El coágulo resultante recubre la bacteria en fibrina, protegiendo a las bacterias de la exposición a las células inmunitarias fagocíticas que circulan en el torrente sanguíneo.
Mientras que la coagulasa provoca la coagulación de la sangre, las quinasas tienen el efecto contrario al desencadenar la conversión del plasminógeno en plasmina, la cual está involucrada en la digestión de los coágulos de fibrina. Al digerir un coágulo, las quinasas permiten que los patógenos atrapados en el coágulo escapen y se propaguen, de manera similar a la forma en que la colagenasa, hialuronidasa y DNasa facilitan la propagación de la infección. Ejemplos de quinasas incluyen estafiloquinasas y estreptoquinasas, producidas por Staphylococcus aureus y Streptococcus pyogenes, respectivamente. Es intrigante que S. aureus pueda producir tanto coagulasa para promover la coagulación como estafiloquinasa para estimular la digestión de los coágulos. La acción de la coagulasa proporciona una importante barrera protectora contra el sistema inmune, pero cuando disminuyen los suministros de nutrientes u otras condiciones señalan la necesidad de que el patógeno escape y se propague, la producción de estafiloquinasa puede iniciar este proceso.
Un mecanismo final que los patógenos pueden usar para protegerse contra el sistema inmune se llama variación antigénica, que es la alteración de las proteínas de superficie para que un patógeno ya no sea reconocido por el sistema inmune del huésped. Por ejemplo, la bacteria Borrelia burgdorferi, el agente causante de la enfermedad de Lyme, contiene una lipoproteína de superficie conocida como VLSe. Debido a la recombinación genética durante la replicación y reparación del ADN, esta proteína bacteriana experimenta variación antigénica. Cada vez que se produce fiebre, la proteína VlSe en B. burgdorferi puede diferir tanto que los anticuerpos contra secuencias previas de VlSe no son efectivos. Se cree que esta variación en el VlSE contribuye a la capacidad de B. burgdorferi para causar enfermedad crónica. Otro patógeno bacteriano humano importante que utiliza variación antigénica para evitar el sistema inmunológico es Neisseria gonorrhoeae, que causa la enfermedad de transmisión sexual gonorrea. Esta bacteria es bien conocida por su capacidad de sufrir variación antigénica de sus pili tipo IV para evitar defensas inmunitarias.
Ejercicio\(\PageIndex{3}\)
- Nombra al menos dos formas en que una cápsula brinde protección contra el sistema inmunológico.
- Además de las cápsulas, nombrar otros dos factores de virulencia utilizados por las bacterias para evadir el sistema inmunológico.
Foco Clínico: Resolución
Con base en los síntomas reportados de Michael de rigidez en el cuello y hemiparesia, el médico sospecha que la infección puede haberse extendido a su sistema nervioso. El médico decide ordenar una punción espinal para buscar cualquier bacteria que pueda haber invadido las meninges y el líquido cefalorraquídeo (LCR), que normalmente sería estéril. Para realizar la punción espinal, la parte baja de la espalda de Michael se frota con un antiséptico de yodo y luego se cubre con una lámina estéril. La aguja se retira asépticamente del empaque de plástico sellado del fabricante por las manos enguantadas del médico. Se inserta la aguja y se introduce un pequeño volumen de fluido en un tubo de muestra adjunto. Se retira el tubo, se tapa y se le fija una etiqueta preparada con los datos de Michael. Esta muestra STAT (requiere análisis urgente o inmediato) se divide en tres tubos estériles separados, cada uno con 1 mL de LCR. Estos tubos son llevados inmediatamente al laboratorio del hospital, donde se analizan en los departamentos de química clínica, hematología y microbiología. Los resultados preliminares de los tres departamentos indican que se produce una infección cefalorraquídea, y el departamento de microbiología reportó la presencia de una varilla grampositiva en el LCR de Michael.
Estos resultados confirman lo que su médico había sospechado: los nuevos síntomas de Michael son el resultado de meningitis, inflamación aguda de las membranas que protegen el cerebro y la médula espinal. Debido a que la meningitis puede poner en peligro la vida y debido a que la primera terapia antibiótica no fue efectiva para prevenir la propagación de la infección, a Michael se le prescribe un tratamiento agresivo de dos antibióticos, ampicilina y gentamicina, para ser entregados por vía intravenosa. Michael permanece en el hospital durante varios días para recibir atención de apoyo y observación. Después de una semana, se le permite regresar a casa para reposo en cama y antibióticos orales. Después de 3 semanas de este tratamiento, realiza una recuperación completa.
Virulencia Viral
Aunque los patógenos virales no son similares a los patógenos bacterianos en términos de estructura, algunas de las propiedades que contribuyen a su virulencia son similares. Los virus usan adhesinas para facilitar la adhesión a las células hospedadoras, y ciertos virus envueltos dependen de la variación antigénica para evitar las defensas inmunitarias del huésped. Estos factores de virulencia se discuten con más detalle en las siguientes secciones.
Adhesinas Virales
Uno de los primeros pasos en cualquier infección viral es la adhesión del virus a receptores específicos en la superficie de las células. Este proceso está mediado por adhesinas que forman parte de la cápside viral o envoltura de membrana. La interacción de adhesinas virales con receptores celulares específicos define el tropismo (focalización preferencial) de virus para células, tejidos y órganos específicos del cuerpo. La proteína pico hemaglutinina que se encuentra en Influenzavirus es un ejemplo de adhesina viral; permite que el virus se una al ácido siálico en la membrana de las células respiratorias e intestinales del huésped. Otra adhesina viral es la glicoproteína gp20, que se encuentra en el VIH. Para que el VIH infecte células del sistema inmune, debe interactuar con dos receptores en la superficie de las células. La primera interacción implica la unión entre gp120 y el marcador celular CD4 que se encuentra en algunas células esenciales del sistema inmune. Sin embargo, antes de que pueda ocurrir la entrada viral en la célula, debe ocurrir una segunda interacción entre gp120 y uno de los dos receptores de quimiocinas (CCR5 y CXCR4). La tabla\(\PageIndex{5}\) enumera las adhesinas para algunos patógenos virales comunes y los sitios específicos a los que estas adhesinas permiten que los virus se adhieran.
| Patógeno | Enfermedad | Adhesina | Sitio de adjunto |
|---|---|---|---|
| Influenzavirus | Influenza | Hemaglutinina | Ácido siálico de las células respiratorias e intestinales |
| Virus del herpes simple I o II | Herpes oral, herpes genital | Glicoproteínas gB, gC, gD | Sulfato de heparán en las superficies mucosas de la boca y los genitales |
| Virus de la inmunodeficiencia humana | VIH/SIDA | Glicoproteína gp120 | CD4 y CCR5 o CXCR4 de células del sistema inmune |
Variación antigénica en virus
La variación antigénica también ocurre en ciertos tipos de virus envueltos, entre ellos los virus influenza, que presentan dos formas de variación antigénica: deriva antigénica y desplazamiento antigénico (Figura\(\PageIndex{9}\)). La deriva antigénica es el resultado de mutaciones puntuales que provocan ligeros cambios en las proteínas espigas hemaglutinina (H) y neuraminidasa (N). Por otro lado, el cambio antigénico es un cambio importante en las proteínas espigas debido al reordenamiento génico. Este reordenamiento para el cambio antigénico ocurre típicamente cuando dos virus de influenza diferentes infectan al mismo huésped.
La tasa de variación antigénica en los virus de la influenza es muy alta, lo que dificulta que el sistema inmunitario reconozca las diferentes cepas de Influenzavirus. Aunque el cuerpo puede desarrollar inmunidad a una cepa a través de la exposición natural o la vacunación, la variación antigénica da como resultado la aparición continua de nuevas cepas que el sistema inmunitario no reconocerá. Esta es la razón principal por la que las vacunas contra Influenzavirus deben darse anualmente. La vacuna contra la influenza de cada año brinda protección contra las cepas más prevalentes para ese año, pero las cepas nuevas o diferentes pueden ser más prevalentes al año siguiente.
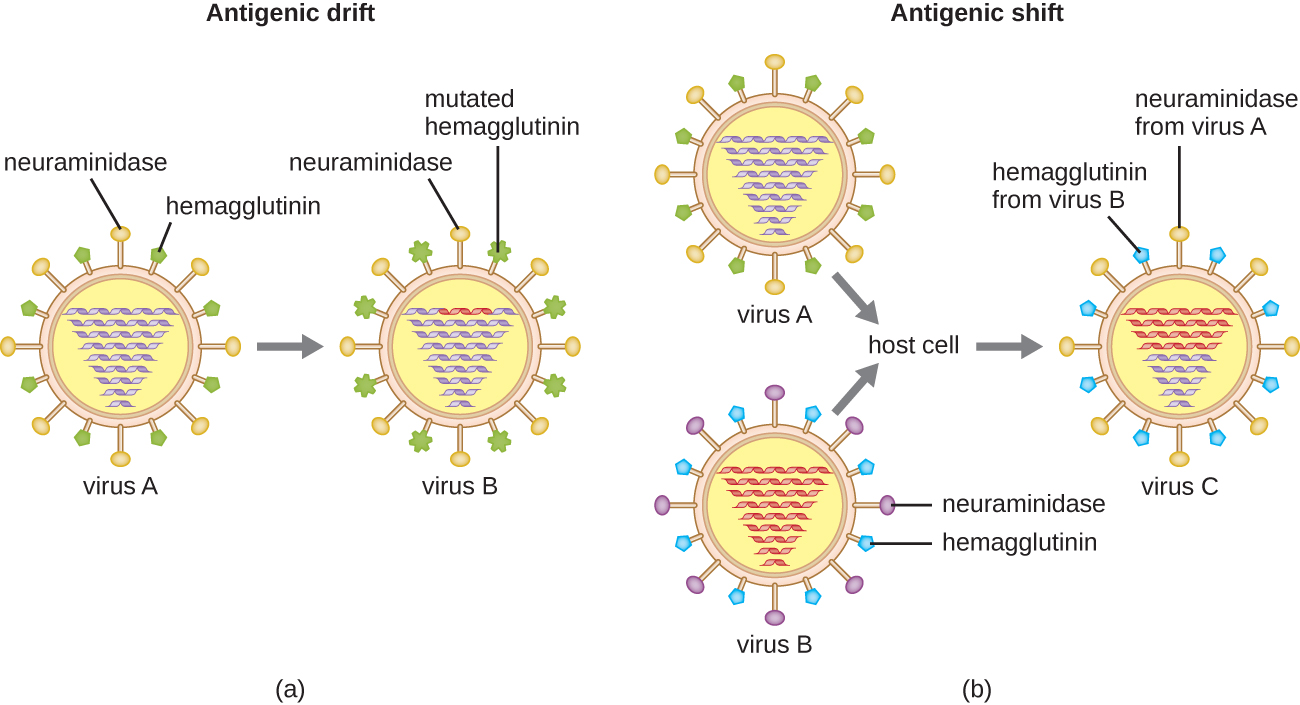
Para otra explicación de cómo ocurren el desplazamiento antigénico y la deriva, mira este video.
Ejercicio\(\PageIndex{4}\)
- Describir el papel de las adhesinas en el tropismo viral.
- Explicar la diferencia entre deriva antigénica y desplazamiento antigénico.
Conceptos clave y resumen
Los factores de virulencia contribuyen a la capacidad de un patógeno para causar enfermedades. Las exoenzimas y toxinas permiten que los patógenos invadan el tejido del huésped y causen daño tisular. Las exoenzimas se clasifican según la macromolécula a la que se dirigen y las exotoxinas se clasifican en función de su mecanismo de acción. Las toxinas bacterianas incluyen endotoxinas y exotoxinas. La endotoxina es el componente lipídico A del LPS de la envoltura celular gramnegativa. Las exotoxinas son proteínas secretadas principalmente por bacterias grampositivas, pero también son secretadas por bacterias gramnegativas. Los patógenos bacterianos pueden evadir la respuesta inmune del huésped al producir cápsulas para evitar la fagocitosis, sobrevivir al ambiente intracelular de los fagocitos, degradar anticuerpos o mediante variación antigénica. Los patógenos virales utilizan adhesinas para iniciar infecciones y variación antigénica para evitar defensas inmunitarias. Los virus de influenza utilizan tanto deriva antigénica como desplazamiento antigénico para evitar ser reconocidos por el sistema inmune.
Notas al pie
- 1 V. Meka. “Leucocidina Pantón-Valentine”. http://www.antimicrobe.org/h04c.file...L-S-aureus.asp


