Introducción
- Page ID
- 74921
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Habilidades para Desarrollar
- Comprender algunos de los aspectos históricamente fundamentales de la química
La química es diferente de la física. Las teorías químicas que utilizamos para entender y predecir no están escritas en matemáticas. Tampoco se basan en nada que podamos ver directamente, como una bola cayendo. En cambio, se basan en imágenes, patrones, simetría e imaginación. ¿Cómo sabemos qué metáforas podemos usar para imaginar, y predecir con precisión, cosas que no podemos ver? Cuando lo piensas, es increíble lo mucho que los químicos pudieron averiguar.
John Dalton propuso su teoría atómica alrededor de 1805. Dijo:
- Toda la materia está compuesta por átomos
- Los átomos vienen en diferentes tipos, llamados elementos
- Los átomos de cada elemento tienen una masa distinta
- Cada átomo de un elemento dado es idéntico a cualquier otro átomo de ese elemento
- Los átomos no se crean, destruyen o cambian cuando ocurren cambios químicos
Los científicos se burlaron, se rieron de él, o al menos permanecieron escépticos, durante al menos 50 años después de eso, porque ¿cómo podría saberlo? Pero tenía casi toda la razón.
Un poco más tarde, en 1830, Jons Jacob Berzelius propuso que aunque tengas la misma composición (el mismo número de átomos de cada elemento) puedes tener dos moléculas distintas (una combinación de átomos), porque los átomos están dispuestos de manera diferente. El primer ejemplo descubierto fue el fulminato de plata (AgCnO, muy explosivo) y el cianato de plata (AgoCN, un polvo grisáceo no explosivo).
Y luego en 1874 Jacobus Henricus van 't Hoff propuso que cuando los átomos de carbono forman enlaces a otros cuatro átomos, esos otros átomos a su alrededor tienen una disposición particular en el espacio: un tetraedro. Un crítico dijo:
“Un Dr. J. H. van 't Hoff que trabaja en la Escuela de Veterinaria de Utrecht parece encontrar la investigación química exacta inadecuada a sus gustos. Lo encuentra más adecuado para montar Pegaso (obviamente prestado de la Escuela de Veterinaria) y proclamar... cómo, durante su vuelo a la cima del químico Parnaso, los átomos parecían estar dispuestos en el universo”. (En la mitología griega antigua, Pegaso es un caballo con alas, y Parnaso es una montaña asociada con el arte y el conocimiento porque se decía que las Musas vivían allí.)
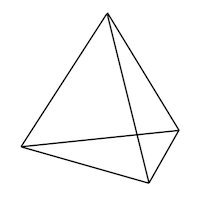
De eso se puede decir lo raro que parecía, en su momento, reclamar una disposición espacial particular de partículas diminutas que nadie había visto jamás. Pero van 't Hoff, como Dalton y Berzelius, tenía razón. ¿Cómo lograron esto? Esa será una de las preguntas que respondamos en esta clase.
De hecho, antes de que los físicos hubieran admitido que existen átomos, antes de que se hubieran probado directamente, los químicos ya habían publicado muchas estructuras químicas que mostraban cómo se disponían los átomos en moléculas.
Resumen
La química es el estudio de la composición y estructura de las sustancias químicas y los cambios que sufren. Un elemento es un tipo de átomo. Un átomo es la partícula más pequeña de un elemento que conserva todas las propiedades del elemento. Una molécula es una combinación de átomos del mismo elemento. La composición química de una sustancia implica que una pieza de la sustancia esté hecha del mismo número de átomos así como del mismo tipo (s) de átomos.
Colaboradores y Atribuciones
Emily V Eames (City College of San Francisco)

