1.12: Ácidos y Bases
- Page ID
- 107983
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)
Ácidos y bases. ¿Por qué estos son importantes en biología?
Se remonta a una serie de procesos biológicos. Por ejemplo, las enzimas funcionan mejor en niveles específicos de ácidos o bases. Toma tu estómago, un ambiente muy ácido. Las enzimas que trabajan en ese ambiente no podrían funcionar en tu boca. ¿A qué sabría tu comida si tu boca también fuera un ambiente muy ácido?
Ácidos y Bases
El agua es el ingrediente principal de muchas soluciones. Una solución es una mezcla de dos o más sustancias que tiene la misma composición en todas partes. Algunas soluciones son ácidos y otras son bases. Para entender ácidos y bases, necesitas saber más sobre el agua pura. En el agua pura (como el agua destilada), una pequeña fracción de las moléculas de agua se descompone naturalmente para formar iones. Un ion es un átomo o molécula cargada eléctricamente. La descomposición del agua está representada por la ecuación química
2 H 2 O → H 3 O + OH -
Los productos de esta reacción son un ion hidronio (H 3 O +) y un ion hidróxido (OH -). El ion hidróxido, que tiene una carga negativa, se forma cuando una molécula de agua cede un ión de hidrógeno cargado positivamente (H +). El ion hidronio, que tiene carga positiva, se forma cuando otra molécula de agua acepta el ión hidrógeno.
Acidez y pH
La concentración de iones hidronio en una solución se conoce como acidez. En agua pura, la concentración de iones hidronio es muy baja; solo aproximadamente 1 de cada 10 millones de moléculas de agua se descompone naturalmente para formar un ion hidronio. Como resultado, el agua pura es esencialmente neutra. La acidez se mide en una escala llamada pH, como se muestra en la Figura a continuación. El agua pura tiene un pH de 7, por lo que el punto de neutralidad en la escala de pH es 7.
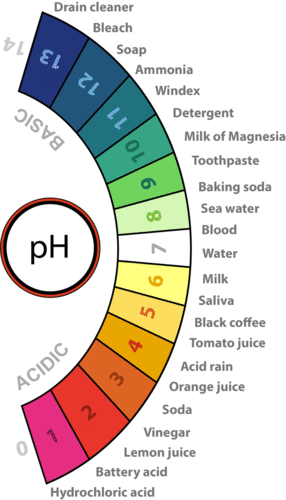 Acidez y Escala de pH El agua tiene un pH de 7, por lo que este es el punto de neutralidad en la escala de pH. Los ácidos tienen un pH menor a 7, y las bases tienen un pH mayor a 7. Se muestran los pH aproximados de los ejemplos.
Acidez y Escala de pH El agua tiene un pH de 7, por lo que este es el punto de neutralidad en la escala de pH. Los ácidos tienen un pH menor a 7, y las bases tienen un pH mayor a 7. Se muestran los pH aproximados de los ejemplos. Ácidos
Si una solución tiene una mayor concentración de iones hidronio que el agua pura, tiene un pH inferior a 7. Una solución con un pH inferior a 7 se llama ácido. A medida que aumenta la concentración de iones hidronio, el valor del pH disminuye. Por lo tanto, cuanto más ácida es una solución, menor es su valor de pH. ¿Alguna vez probaste el vinagre? Al igual que otros ácidos, tiene un sabor agrio. Los ácidos más fuertes pueden ser dañinos para los organismos. Por ejemplo, el ácido estomacal comería a través del estómago si no estuviera revestido con una capa de moco. Los ácidos fuertes también pueden dañar materiales, incluso materiales duros como el vidrio.
Bases
Si una solución tiene una concentración menor de iones hidronio que el agua pura, tiene un pH superior a 7. Una solución con un pH superior a 7 se llama base. Las bases, como el bicarbonato de sodio, tienen un sabor amargo. Al igual que los ácidos fuertes, las bases fuertes pueden dañar los organismos y dañar los materiales. Por ejemplo, la lejía puede quemar la piel y la lejía puede eliminar el color de la ropa.
Ácidos y Bases en Organismos
Los ácidos y bases son importantes en los seres vivos porque la mayoría de las enzimas pueden hacer su trabajo solo a cierto nivel de acidez. Las células secretan ácidos y bases para mantener el pH adecuado para que las enzimas funcionen. Por ejemplo, cada vez que digieres los alimentos, los ácidos y las bases están trabajando en tu sistema digestivo. Considera el ambiente ácido del estómago. El ambiente ácido ayuda con la digestión de los alimentos. La enzima pepsina, que ayuda a descomponer las proteínas en el estómago solo puede funcionar de manera óptima en el ambiente de pH bajo. El estómago secreta un ácido fuerte que permite que la pepsina funcione, y que el estómago haga su trabajo. Sin embargo, cuando el contenido del estómago ingresa al intestino delgado, el ácido debe ser neutralizado. Esto se debe a que las enzimas en el intestino delgado necesitan un ambiente básico para funcionar. Un órgano llamado páncreas secreta una base fuerte en el intestino delgado, y esta base neutraliza el ácido.
Resumen
- Una solución es una mezcla de dos o más sustancias que tiene la misma composición en todas partes. Algunas soluciones son ácidos, algunas son bases.
- El agua pura tiene un pH de 7, por lo que el punto de neutralidad en la escala de pH es 7.
- Los ácidos tienen una mayor concentración de iones hidronio que el agua pura, y un pH inferior a 7.
- Las bases tienen una menor concentración de iones hidronio que el agua pura, y un pH superior a 7.
- Los ácidos y bases son importantes en los organismos vivos porque la mayoría de las enzimas funcionan mejor a un pH específico.
Revisar
- ¿Cuál es el pH de una solución neutra?
- Distinguir entre un ácido y una base.
- Describir un ejemplo de un ácido o una base que interviene en la digestión humana.
- Suponga que prueba una solución desconocida y encuentre que tiene un pH de 7.2. ¿Qué tipo de solución es? ¿Cómo lo sabes?
- ¿Son los siguientes ácidos o bases?
- leche
- café
- jabón
| Imagen | Referencia | Atribuciones |
 |
[Figura 1] | Licencia: CC BY-NC |
 |
[Figura 2] | Crédito: Hana Zavadska y Mariana Ruiz Villarreal (LadyOFHats) para Fundación CK-12 Fuente: Fundación CK-12 Licencia: CC BY-NC 3.0 |

