1.6: Reacciones Energéticas y Bioquímicas
- Page ID
- 107970
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)
¿Qué es la energía? ¿De dónde viene tu energía? ¿Se puede reciclar la energía?
Este equipo de hormigas está rompiendo un árbol muerto. Un ejemplo clásico de trabajo en equipo. Y todo ese trabajo requiere energía. De hecho, cada reacción química -las reacciones químicas que permiten que las células de esas hormigas hagan el trabajo - necesita energía para comenzar. Y toda esa energía viene de la comida que comen las hormigas. Lo que se come a las hormigas obtiene su energía de las hormigas. La energía pasa a través de un ecosistema en una sola dirección.
Reacciones Químicas y Energía
Las reacciones químicas siempre implican energía. La energía es una propiedad de la materia que se define como la capacidad de hacer trabajo. Cuando el metano se quema, por ejemplo, libera energía en forma de calor y luz. Otras reacciones químicas absorben energía en lugar de liberarla.
Reacciones exotérmicas
Una reacción química que libera energía (como calor) se llama reacción exotérmica. Este tipo de reacción puede representarse mediante una ecuación química general:
Reactivos → Productos + Calor
Además de la quema de metano, otro ejemplo de una reacción exotérmica es el cloro combinándose con el sodio para formar sal de mesa. Esta reacción también libera energía.
Reacción endotérmica
Una reacción química que absorbe energía se llama reacción endotérmica. Este tipo de reacción también se puede representar por una ecuación química general:
Reactivos + Calor → Productos
¿Alguna vez usaste un paquete frío químico? El paquete se enfría debido a una reacción endotérmica. Cuando se rompe un tubo dentro del paquete, libera un químico que reacciona con el agua dentro del paquete. Esta reacción absorbe la energía térmica y enfría rápidamente el paquete.
Energía de activación
Todas las reacciones químicas necesitan energía para comenzar. Incluso las reacciones que liberan energía necesitan un impulso de energía para comenzar. La energía necesaria para iniciar una reacción química se llama energía de activación. La energía de activación es como el empuje que un niño necesita para comenzar a bajar por un tobogán de juegos. El empujón le da al niño la energía suficiente para comenzar a moverse, pero una vez que comienza, sigue moviéndose sin ser empujada de nuevo. La energía de activación se ilustra en la Figura a continuación.
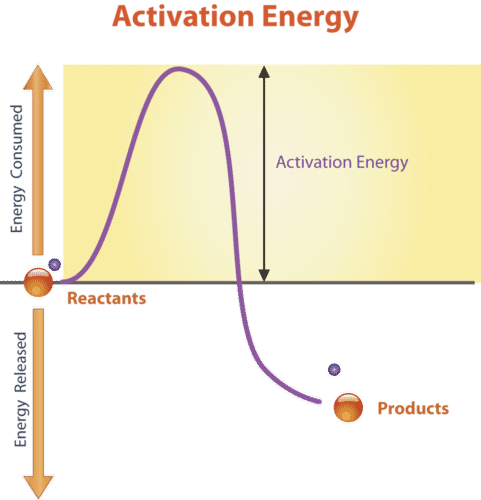 Energía de Activación. La energía de activación proporciona el “empuje” necesario para iniciar una reacción química. ¿La reacción química en esta figura es una reacción exotérmica o endotérmica?
Energía de Activación. La energía de activación proporciona el “empuje” necesario para iniciar una reacción química. ¿La reacción química en esta figura es una reacción exotérmica o endotérmica? ¿Por qué todas las reacciones químicas necesitan energía para comenzar? Para que las reacciones comiencen, las moléculas reaccionantes deben chocar entre sí, por lo que deben estar moviéndose, y el movimiento requiere energía. Cuando las moléculas reaccionantes se juntan, pueden repelerse entre sí debido a las fuerzas intermoleculares que las separan. Superar estas fuerzas para que las moléculas puedan unirse y reaccionar también requiere energía.
Al ver la energía de activación, concéntrese en estos conceptos:
- el papel de la energía de activación,
- lo que demuestra un diagrama de energía.
Resumen
- Las reacciones químicas siempre implican energía. Una reacción química que libera energía es una reacción exotérmica, y una reacción química que absorbe energía es una reacción endotérmica. La energía necesaria para iniciar una reacción química es la energía de activación.
Revisar
- ¿Qué es una reacción exotérmica?
- ¿Cuál es la ecuación química general para una reacción endotérmica?
- ¿Cuál es la energía de activación?
- ¿Por qué todas las reacciones químicas requieren energía de activación?
| Imagen | Referencia | Atribuciones |
 |
[Figura 1] | Licencia: CC BY-NC |
 |
[Figura 2] | Crédito: Hana Zavadska Fuente: Fundación CK-12 Licencia: CC BY-NC 3.0 |

