12.8: La naturaleza de onda de la materia causa cuantización
- Page ID
- 133790
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Objetivos de aprendizaje
- Dibuje una conexión entre la cuantificación de Bohr del momento angular y la onda electrónica.
Cuando Bohr propuso que se cuantificara el momento angular orbital de los electrones en átomos, no tenía una muy buena razón, aparte de que esta suposición ad hoc condujo a resultados correctos. Si recordamos que todo el asunto, incluidos los electrones en átomos, tiene propiedad de onda, podemos dar un modelo intuitivo de por qué habría que cuantificar el momento angular orbital.
Siguiendo el trabajo inicial de Bohr sobre el átomo de hidrógeno, iba a pasar una década antes de que de Broglie propusiera que la materia tiene propiedades de onda. Las propiedades onduladas de la materia fueron confirmadas posteriormente por observaciones de interferencia electrónica cuando se dispersaron de los cristales. Los electrones solo pueden existir en lugares donde interfieran constructivamente. ¿Cómo afecta esto a los electrones en las órbitas atómicas? Cuando un electrón está unido a un átomo, su longitud de onda debe caber en un espacio pequeño, algo así como una onda estacionaria en una cuerda. (Ver Figura\(\PageIndex{1}\).) Las órbitas permitidas son aquellas órbitas en las que un electrón interfiere constructivamente consigo mismo. No todas las órbitas producen interferencias constructivas. Por lo tanto, solo se permiten ciertas órbitas, las órbitas se cuantifican.

Para una órbita circular, la interferencia constructiva ocurre cuando la longitud de onda del electrón encaja perfectamente en la circunferencia, de manera que las crestas de onda siempre se alinean con las crestas y los canales de onda se alinean con los canales, como se muestra en la Figura\(\PageIndex{1}\) (b). Más precisamente, cuando un múltiplo integral de la longitud de onda del electrón es igual a la circunferencia de la órbita, se obtiene interferencia constructiva. En forma de ecuación, la condición para la interferencia constructiva y una órbita electrónica permitida es
\[n \lambda_{n}=2 \pi r_{n}(n=1,2,3 \ldots), \nonumber \]
donde\(\lambda_{n}\) está la longitud de onda del electrón y\(r_{n}\) es el radio de esa órbita circular. La longitud de onda de Broglie es\(\lambda=h / p=h / m v\), y así aquí\(\lambda=h / m_{e} v\). Sustituir esto en la condición anterior por interferencia constructiva produce un resultado interesante:
\[\frac{n h}{m_{e} v}=2 \pi r_{n}. \nonumber \]
Reordenando términos, y señalando que\(L=m v r\) para una órbita circular, obtenemos la cuantificación del momento angular como condición para órbitas permitidas:
\[L=m_{e} v r_{n}=n \frac{h}{2 \pi}(n=1,2,3 \ldots). \nonumber \]
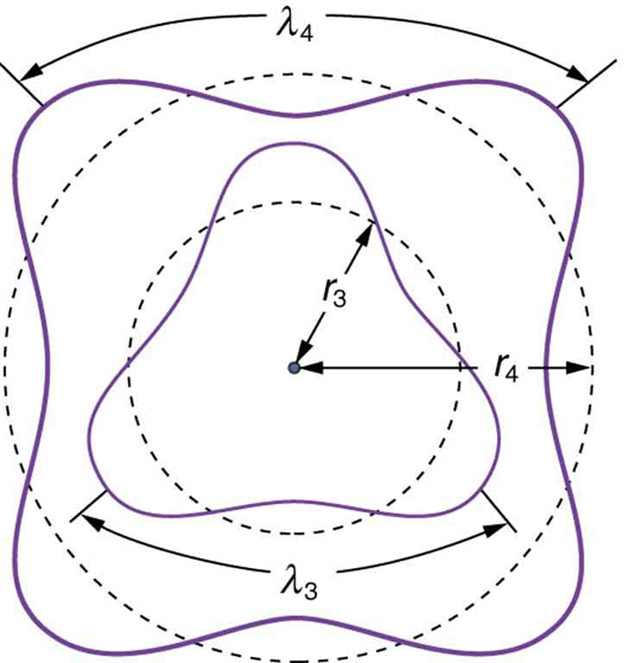
Esto es lo que Bohr se vio obligado a hipotetizar como regla para órbitas permitidas, como se dijo anteriormente. Ahora nos damos cuenta de que es la condición para la interferencia constructiva de un electrón en una órbita circular. La figura\(\PageIndex{2}\) ilustra esto para\(n=3\) y\(n=4\).
ONDAS Y CUANTIZACIÓN
La naturaleza de onda de la materia es responsable de la cuantificación de los niveles de energía en los sistemas ligados. Sólo aquellos estados donde la materia interfiere constructivamente existen, o están “permitidos”. Dado que existe una órbita más baja donde esto es posible en un átomo, el electrón no puede entrar en espiral hacia el núcleo. No puede existir más cerca o dentro del núcleo. La naturaleza ondulada de la materia es lo que impide que la materia colapse y da a los átomos sus tamaños.
Por el carácter de onda de la materia, la idea de órbitas bien definidas da paso a un modelo en el que hay una nube de probabilidad, consistente con el principio de incertidumbre de Heisenberg. La figura\(\PageIndex{3}\) muestra cómo esto se aplica al estado fundamental del hidrógeno. Si intentas seguir el electrón en alguna órbita bien definida usando una sonda que tiene una longitud de onda lo suficientemente pequeña como para obtener algunos detalles, en su lugar sacarás al electrón de su órbita. Cada medición de la posición del electrón encontrará que está en una ubicación definida en algún lugar cerca del núcleo. Las mediciones repetidas revelan una nube de probabilidad como la de la figura, con cada mota la ubicación determinada por una sola medición. No hay un tipo de distribución bien definido, de órbita circular. La naturaleza vuelve a demostrar ser diferente a pequeña escala que en una escala macroscópica.

Hay muchos ejemplos en los que la naturaleza de onda de la materia provoca la cuantificación en sistemas ligados como el átomo. Siempre que una partícula está confinada o unida a un espacio pequeño, sus longitudes de onda permitidas son las que encajan en ese espacio. Por ejemplo, la partícula en un modelo de caja describe una partícula libre para moverse en un pequeño espacio rodeado de barreras impenetrables. Esto es cierto en los radiadores de cuerpo negro (átomos y moléculas) así como en los espectros atómicos y moleculares. Diversos átomos y moléculas tendrán diferentes conjuntos de órbitas de electrones, dependiendo del tamaño y complejidad del sistema. Cuando un sistema es grande, como un grano de arena, las pequeñas ondas de partículas en él pueden caber de tantas maneras que se vuelve imposible ver que los estados permitidos son discretos. Así se satisface el principio de correspondencia. A medida que los sistemas se hacen grandes, gradualmente se ven menos granulados y la cuantificación se vuelve menos evidente. Los sistemas no unidos (pequeños o no), como un electrón liberado de un átomo, no tienen energías cuantificadas, ya que sus longitudes de onda no están obligadas a caber en cierto volumen.
Resumen de la Sección
- La cuantificación de la energía orbital es causada por la naturaleza de onda de la materia. Las órbitas permitidas en los átomos ocurren para la interferencia constructiva de electrones en la órbita, requiriendo un número integral de longitudes de onda para encajar en la circunferencia de una órbita; es decir,
\[n \lambda_{n}=2 \pi r_{n}(n=1,2,3 \ldots), \nonumber\]
donde\(\lambda_{n}\) está la longitud de onda de Broglie del electrón. - Debido a la naturaleza de onda de los electrones y al principio de incertidumbre de Heisenberg, no hay órbitas bien definidas; más bien, hay nubes de probabilidad.
- Bohr propuso correctamente que se cuantificaran la energía y los radios de las órbitas de electrones en átomos, con energía para transiciones entre órbitas dada por
\[\Delta E=h f=E_{\mathrm{i}}-E_{\mathrm{f}}, \nonumber\]
donde\(\Delta E\) es el cambio de energía entre las órbitas inicial y final y\(h f\) es la energía de un fotón absorbido o emitido. - Es útil para trazar energías orbitales en una gráfica vertical llamada diagrama de nivel de energía.
- Las órbitas permitidas son circulares, propuesta por Bohr, y deben tener un momento angular orbital cuantificado dado por
\[L=m_{e} v r_{n}=n \frac{h}{2 \pi}(n=1,2,3 \ldots), \nonumber\]
donde\(L\) está el momento angular,\(r_{n}\) es el radio de órbita\(n\), y\(h\) es la constante de Planck.


