12.1: Introducción
- Page ID
- 128333
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)objetivos de aprendizaje
- Describir el gas usando la teoría cinética de los gases
Introducción a la temperatura y a la teoría cinética
La teoría cinética de los gases describe un gas como un gran número de partículas pequeñas (átomos o moléculas), todas las cuales están en constante movimiento aleatorio. Las partículas que se mueven rápidamente chocan constantemente entre sí y con las paredes del contenedor. La teoría cinética explica las propiedades macroscópicas de los gases (como presión, temperatura y volumen) considerando su composición molecular y movimiento. Esencialmente, la teoría postula que la presión no se debe a la repulsión estática entre moléculas (como fue la conjetura de Isaac Newton) sino a colisiones entre moléculas que se mueven a diferentes velocidades a través del movimiento browniano. Además, la temperatura de un gas monatómico ideal es una medida de la energía cinética promedio de sus átomos, como se ilustra en.
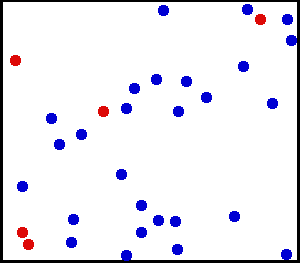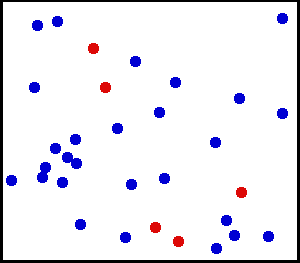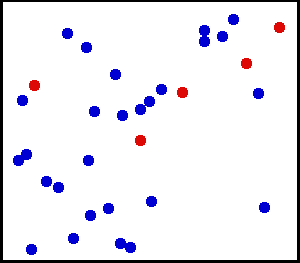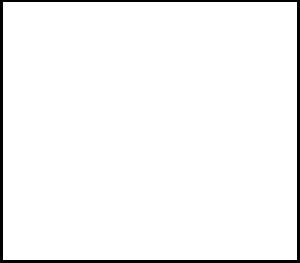
Movimiento Traslacional del Helio: Los gases reales no siempre se comportan de acuerdo con el modelo ideal bajo ciertas condiciones, como la alta presión. Aquí, el tamaño de los átomos de helio en relación con su espaciamiento se muestra a escala bajo 1950 atmósferas de presión.
La teoría cinética de los gases utiliza el modelo del gas ideal para relacionar la temperatura con la energía cinética traslacional promedio de las moléculas en un contenedor de gas en equilibrio termodinámico. La mecánica clásica define la energía cinética traslacional de una molécula de gas de la siguiente manera:
\[\mathrm{E_k=\dfrac{1}{2}mv^2,}\]
donde m es la masa de partícula y v su velocidad (la magnitud de su velocidad). La distribución de las velocidades (que determinan las energías cinéticas de traslación) de las partículas en un gas ideal clásico se denomina distribución Maxwell-Boltzmann. En teoría cinética, la temperatura de un gas ideal clásico se relaciona con su energía cinética promedio por grado de libertad E k a través de la ecuación:
\[\mathrm{\bar{E}_k=\dfrac{1}{2}kT,}\]
(k: La constante de Boltzmann). Derivaremos esta relación en los siguientes átomos. También derivaremos la ley de gas ideal:
\[\mathrm{pV=nRT,}\]
(R: constante de gas ideal, n: número de moles de gas) a partir de una teoría microscópica.
Teoría atómica de la materia
La teoría atómica es una teoría científica de la naturaleza de la materia que establece que la materia está compuesta por unidades discretas llamadas átomos.
objetivos de aprendizaje
- Formular cinco postulados de la teoría atómica de John Dalton
La teoría atómica es una teoría científica de la naturaleza de la materia que establece que la materia está compuesta por unidades discretas llamadas átomos, a diferencia de la noción obsoleta de que la materia podría dividirse en cualquier cantidad arbitrariamente pequeña. Si bien los físicos descubrieron que el llamado “átomo indivisible” era en realidad un conglomerado de diversas partículas subatómicas, el concepto de átomos sigue siendo importante porque son bloques de construcción de la materia y forman la base de la química.

Ilustración del átomo de helio: Esta es una ilustración del átomo de helio, que representa el núcleo (rosa) y la distribución de nubes de electrones (negro). El núcleo (superior derecha) en helio-4 es en realidad esféricamente simétrico y se asemeja mucho a la nube de electrones, aunque para núcleos más complicados no siempre es así. La barra negra es de un angstrom (10-10 m, o 100pm).
Hipótesis atómica de Dalton
Las propuestas filosóficas sobre los átomos se han sugerido desde los años de los antiguos griegos, pero John Dalton fue el primero en proponer una teoría científica de los átomos. Basó su estudio en dos leyes sobre reacciones químicas que surgieron (sin referirse a la noción de teoría atómica) a finales del siglo XVIII. El primero fue la ley de conservación de la masa, formulada por Antoine Lavoisier en 1789, que establece que la masa total en una reacción química permanece constante (es decir, los reactivos tienen la misma masa que los productos). El segundo fue la ley de proporciones definidas, probada primero por el químico francés Joseph Louis Proust.
Dalton propuso que cada elemento químico está compuesto por átomos de un tipo único y único, y aunque no pueden ser alterados o destruidos por medios químicos, pueden combinarse para formar estructuras más complejas (compuestos químicos). Esto marcó la primera teoría verdaderamente científica del átomo, ya que Dalton llegó a sus conclusiones mediante la experimentación y el examen de los resultados de una manera empírica. Por esta razón, Dalton es considerado el creador de la teoría atómica moderna.
5 Puntos Principales
La teoría atómica de Dalton tenía 5 puntos principales:
- Los elementos están hechos de partículas extremadamente pequeñas llamadas átomos.
- Los átomos de un elemento dado son idénticos en tamaño, masa y otras propiedades; los átomos de diferentes elementos difieren en tamaño, masa y otras propiedades.
- Los átomos no pueden ser subdivididos, creados o destruidos.
- Los átomos de diferentes elementos se combinan en simples proporciones de números enteros para formar compuestos químicos.
- En las reacciones químicas, los átomos se combinan, separan o reordenan.
De estos cinco, sólo tres siguen siendo considerados válidos hoy en día. 1, 4 y 5 son válidos, mientras que 2 y 3 han resultado no ser así. Los átomos se pueden descomponer en trozos más pequeños, y los átomos de un elemento dado pueden variar en masa y otras propiedades (ver isótopos e iones).
Sabiendo que un gas está compuesto por pequeñas partículas atómicas y moleculares, es natural tratar de explicar las propiedades del gas desde un punto de vista microscópico. Este esfuerzo condujo al desarrollo de la teoría cinética de los gases, donde las propiedades macroscópicas de los gases, como la presión, la temperatura y el volumen, se explican considerando su composición molecular y movimiento.

John Dalton Un nuevo sistema de filosofía química: varios átomos y moléculas como se representa en Un nuevo sistema de filosofía química de John Dalton (1808).
Puntos Clave
- La teoría cinética postula que la presión se debe a colisiones entre moléculas que se mueven a diferentes velocidades a través del movimiento browniano.
- La temperatura de un gas monatómico ideal es una medida de la energía cinética promedio de sus átomos. En teoría cinética, se relaciona con su energía cinética promedio por grado de libertad E k a través de la ecuación:\(\mathrm{\bar{E}_k=\dfrac{1}{2} kT}\).
- La teoría cinética de los gases utiliza el modelo del gas ideal para relacionar la temperatura con la energía cinética traslacional promedio de las moléculas en un contenedor de gas en equilibrio termodinámico.
- John Dalton fue el primero en proponer una teoría científica de los átomos. Basó su estudio en dos leyes: la ley de conservación de la masa y la ley de proporciones definidas.
- Dalton propuso que cada elemento químico está compuesto por átomos de un tipo único y único, y aunque no pueden ser alterados o destruidos por medios químicos, pueden combinarse para formar estructuras más complejas.
- La teoría cinética de los gases explica las propiedades macroscópicas de los gases, como la presión, la temperatura y el volumen, considerando su composición molecular y movimiento.
- Si bien la idea de Dalton de que la materia se componía de varios átomos era correcta, estaba equivocado acerca de algunas de sus propiedades. Los átomos se pueden descomponer en partes más pequeñas. Los átomos del mismo elemento pueden tener masas ligeramente diferentes y comportarse de manera diferente. Ver isótopos e iones para ejemplos.
Términos Clave
- gas ideal: Un gas hipotético cuyas moléculas no exhiben interacción y experimentan colisión elástica entre sí y con las paredes del contenedor.
- grado de libertad: Cualquiera de las coordenadas, de las cuales se necesita un número mínimo para especificar el movimiento de un sistema mecánico.
- Movimiento browniano: Movimiento aleatorio de partículas suspendidas en un fluido, que surge de que esas partículas son golpeadas por moléculas individuales del fluido.
- átomo: La menor cantidad posible de materia que aún conserva su identidad como elemento químico, ahora conocido por consistir en un núcleo rodeado de electrones.
- Teoría cinética de los gases: La teoría cinética de los gases describe un gas como un gran número de pequeñas partículas (átomos o moléculas), todas las cuales están en constante movimiento aleatorio.
- reacción química: Un proceso, que implica la ruptura o fabricación de enlaces interatómicos, en el que una o más sustancias se transforman en otras.
LICENCIAS Y ATRIBUCIONES
CONTENIDO CON LICENCIA CC, COMPARTIDO PREVIAMENTE
- Curación y Revisión. Proporcionado por: Boundless.com. Licencia: CC BY-SA: Atribución-CompartirIgual
CC CONTENIDO LICENCIADO, ATRIBUCIÓN ESPECÍFICA
- gas ideal. Proporcionado por: Wikcionario. Ubicado en: http://en.wiktionary.org/wiki/ideal_gas. Licencia: CC BY-SA: Atribución-CompartirIgual
- grado de libertad. Proporcionado por: Wikcionario. Ubicado en: http://en.wiktionary.org/wiki/degree_of_freedom. Licencia: CC BY-SA: Atribución-CompartirIgual
- Temperatura. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Temperatura%23Teoría_cinética_de_gases. Licencia: CC BY-SA: Atribución-CompartirIgual
- Teoría cinética. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Teoría_Cinética%23Temperatura_y_Kinetic_Energy. Licencia: CC BY-SA: Atribución-CompartirIgual
- Movimiento browniano. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/Brownian_motion. Licencia: CC BY-SA: Atribución-CompartirIgual
- Teoría cinética. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Kinetic_Theory. Licencia: Dominio Público: No Conocido Derechos de Autor
- reacción química. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/chemical_reaction. Licencia: CC BY-SA: Atribución-CompartirIgual
- Teoría atómica. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Atomic_Theory. Licencia: CC BY-SA: Atribución-CompartirIgual
- Teoría cinética. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Kinetic_Theory. Licencia: CC BY-SA: Atribución-CompartirIgual
- teoría cinética de los gases. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Kinetic%20Teoria%20de%20Gases. Licencia: CC BY-SA: Atribución-CompartirIgual
- átomo. Proporcionado por: Wikcionario. Ubicado en: es.wiktionary.org/wiki/atom. Licencia: CC BY-SA: Atribución-CompartirIgual
- Teoría cinética. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Kinetic_Theory. Licencia: Dominio Público: No Conocido Derechos de Autor
- Átomo. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/Atom. Licencia: CC BY: Atribución
- John Dalton. Proporcionado por: Wikipedia. Ubicado en: es.wikipedia.org/wiki/John_Dalton. Licencia: Dominio Público: No Conocido Derechos de Autor


