6.2: Teoría cinética de los gases
- Page ID
- 75080
- Exponer los principales conceptos detrás de la teoría cinética de los gases.
- Relacionar las propiedades generales de los gases con la teoría cinética.
Los gases estuvieron entre las primeras sustancias estudiadas en términos del método científico moderno, el cual se desarrolló en el siglo 1600. No tardó en reconocer que todos los gases compartían ciertos comportamientos físicos, lo que sugiere que todos los gases podrían ser descritos por una teoría que lo abarca todo. Hoy, esa teoría es la teoría cinética de los gases. La teoría cinética de los gases se basa en los siguientes enunciados:
- Los gases consisten en diminutas partículas de materia que están en constante movimiento.
- Las partículas de gas chocan constantemente entre sí y con las paredes de un contenedor. Estas colisiones son elásticas, es decir, no hay pérdida neta de energía de las colisiones.
- Las partículas de gas están separadas por grandes distancias, con el tamaño de una partícula de gas minúsculo en comparación con las distancias que las separan.
- No hay fuerzas interactivas (es decir, atracción o repulsión) entre las partículas de un gas.
- La velocidad promedio de las partículas de gas depende de la temperatura del gas.
La figura\(\PageIndex{1}\) muestra una representación de cómo se representa mentalmente la fase gaseosa.
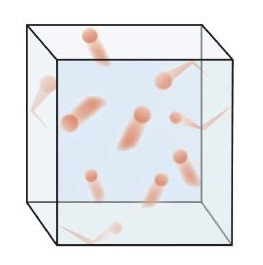
Este modelo de gases explica algunas de las propiedades físicas de los gases. Debido a que la mayor parte de un gas es espacio vacío, un gas tiene una baja densidad y puede expandirse o contraerse bajo la influencia apropiada. El hecho de que las partículas de gas estén en constante movimiento significa que dos o más gases siempre se mezclarán, ya que las partículas de los gases individuales se mueven y chocan entre sí.
Un gas ideal es un gas que sigue exactamente las afirmaciones de la teoría cinética. Desafortunadamente, los gases reales no son ideales. Muchos gases se desvían ligeramente de estar perfectamente de acuerdo con la teoría cinética de los gases. Sin embargo, la mayoría de los gases se adhieren a las afirmaciones, y la teoría cinética de los gases es bien aceptada por la comunidad científica.
- El comportamiento físico de los gases se explica por la teoría cinética de los gases.
- Un gas ideal se adhiere exactamente a la teoría cinética de los gases.


