17.3: La regla de la fase Gibbs
- Page ID
- 127694
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Hasta este punto los sistemas termodinámicos que hemos estado considerando han consistido en un solo componente y, en su mayor parte, en una sola fase, pero ahora vamos a discutir sistemas que constan de más de una fase y más de un componente. La Ley de Fase Gibbs proporciona una relación entre el número de fases, el número de componentes y el número de grados de libertad. Pero ¡Guau, ahí! Hemos estado usando varios términos técnicos aquí: Fase, Componente, Grados de Libertad. Tenemos que describir lo que significan estos.
El estado de un sistema que consiste en un solo componente en una sola fase (por ejemplo, un solo gas, no una mezcla de diferentes gases) puede describirse mediante tres variables de estado intensivo, P, V y T. (Aquí V es el volumen molar —es decir, el recíproco de la densidad en moles por unidad de volumen— y es una variable intensiva.) Es decir, el estado del sistema es descrito por un punto en el espacio PVT tridimensional. Sin embargo, las variables de estado intensivas están conectadas por una ecuación de estado f (P, V, T) = 0, de manera que el sistema está restringido a estar en la superficie bidimensional descrita por esta ecuación. Así, debido a la restricción, sólo dos variables de estado intensivas bastan para describir el estado del sistema. Solo dos de las variables de estado intensivo pueden variarse independientemente. El sistema tiene dos grados de libertad.
Definición. Una fase es un volumen químicamente homogéneo, sólido, líquido o gas, con un límite que lo separa de otras fases.
Definición. El número de variables de estado intensivas que se pueden variar independientemente sin cambiar el número de fases en un sistema se denomina el número de grados de libertad del sistema.
Estos son fáciles. Definir el número de componentes en un sistema requiere un poco de cuidado. Doy una definición, pero lo que significa la definición puede, espero, hacerse un poco más claro dando algunos ejemplos.
Definición. El número de componentes en un sistema es el menor número de constituyentes que son necesarios para describir la composición de cada fase.
Veamos algunos ejemplos para tratar de comprender lo que esto significa.
Primero, consideremos una solución acuosa de los cloruros y bromuros de sodio y potasio que coexisten con los sólidos cristalinos NaCl, KCl, NaBr, KBr, ilustrados esquemáticamente en la figura XVII.1.
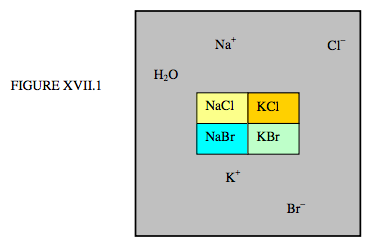
Hay cinco fases —cuatro sólidas y una líquida— pero ¿cuántos componentes? Hay seis elementos: H, O, Na, K, Cl, B —pero las cantidades de cada uno no pueden variarse independientemente. Hay dos restricciones: n (H) = 2 n (O), y n (Na) + n (K) = n (Cl) + n (Br). Es decir, si conocemos el número de átomos de hidrógeno, entonces se conoce el número de átomos de oxígeno. Y si conocemos el número de tres cualquiera de Na, K, Cl o Br, entonces se conoce al cuarto. Así, el número de constituyentes que pueden variarse independientemente es de cuatro. El número de componentes es de cuatro.
O nuevamente, considere una solución acuosa de un mol de H 2 SO 4 en b moles de agua. Sólo hay una fase. Hay tres elementos: H, O y S. Estos pueden distribuirse entre varias especies, como H 2 O, H 2 SO 4, H 3 O +, OH −, SO 4 −−, pero eso no importa. Solo hay una restricción, a saber, que
2 (a + b) n (H) = an (S) + (4 a + b) n (O).
Es decir, si conocemos el número de dos cualesquiera de H, O o S, también conocemos el número del tercero. El número de componentes es de dos.
O de nuevo, considere la reacción reversible
CaCo 3 (s) ↔ CaO (s) + CO 2 (g).
Si el sistema está en equilibrio, y conocemos los números de dos cualesquiera de estas tres moléculas, el número de la tercera está determinado por la constante de equilibrio. Por lo tanto, el número de componentes es de dos.
En cada uno de estos tres ejemplos, fue fácil indicar el número de fases y un poco más difícil determinar el número de componentes. Ahora tenemos que preguntarnos cuál es el número de grados de libertad. Esto es lo que nos va a decir la ley de fase Gibbs.
Si hay componentes C en un sistema, la composición de una fase en particular se describe completamente si conocemos la fracción molar de C − 1 de los componentes, ya que la suma de las fracciones molares de todos los componentes debe ser 1. Esto es así para cada una de las fases P, de manera que hay en todas las fracciones molares P (C − 1) a especificar, así como dos cualesquiera de las variables de estado intensivo P, V y T. Así, hay P (C − 1) + 2 variables de estado intensivas a especificar. (La fracción molar de cada componente es una variable de estado intensivo). Pero no todos estos pueden variarse independientemente, porque las funciones molares de Gibbs de cada componente son las mismas en todas las fases. (Para entender esta importante afirmación, vuelva a leer este argumento en el Capítulo 14 sobre la ecuación Clausius-Clapeyron.) Para cada uno de los componentes C hay ecuaciones P − 1 que afirman la igualdad de las funciones específicas de Gibbs en todas las fases. Así, el número de variables de estado intensivas que se pueden variar independientemente sin cambiar el número de fases, es decir, el número de grados de libertad, F − es P (C − 1) + 2 − C (P − 1), o
\[F = C − P + 2.\]
Esta es la regla de la fase Gibbs.
En nuestro ejemplo de las sales de sodio y potasio, en las que había C = 4 componentes distribuidos a través de P = 5 fases, solo hay un grado de libertad. No se puede cambiar más de una variable de estado intensivo sin cambiar el número de fases.
En nuestro ejemplo de ácido sulfúrico, había una fase y dos componentes, y de ahí tres grados de libertad.
En el sistema de carbonato de calcio, hubo tres fases y dos componentes, y de ahí solo un grado de libertad.
Si tenemos un gas puro, hay una fase y un componente, y de ahí dos grados de libertad. (Podemos variar dos cualquiera de P, V o T independientemente).
Si tenemos un líquido y su vapor en equilibrio, hay dos fases y un componente, y de ahí F = 1. Podemos variar P o T, pero no ambos independientemente si el sistema va a permanecer en equilibrio. Si aumentamos T, la presión del vapor que permanece en equilibrio con su líquido aumenta. El sistema está restringido a estar en una línea en el espacio PVT.
Si tenemos un líquido, un sólido y un gas coexistiendo en equilibrio, hay tres fases y un componente y por lo tanto no hay grados de libertad. El sistema existe en un solo punto en el espacio PVT, es decir, el punto triple.
A menudo me ha llamado la atención la similitud de la regla de fase de Gibbs con la relación topológica entre el número de caras F, bordes E y vértices V de un poliedro sólido (sin agujeros topológicos a través de él). Esta relación es F = E − V + 2. Por ejemplo,
\[ \begin{array} ~ & E & V & F \\ \text{Tetrahedron:} & 6 & 4 & 4 \\ \text{Cube:} & 12 & 8 & 6 \\ \text{Octahedron:} & 12 & 6 & 8 \end{array}\]
Por lo que sé, no hay una conexión concebible entre esto y la regla de fase de Gibbs, y ni siquiera la encuentro útil como mnemotécnico. Creo que sólo hay que dejarlo como una de las pequeñas curiosidades de la vida.
Desde que escribí esta sección, he agregado algún material adicional sobre aleaciones binarias y ternarias, que proporcionan ejemplos adicionales de la regla de fase Gibbs. Las he agregado al final del capítulo, como las secciones 17.9 y 17.10.


