1.7: Ciclo de Nutrientes del Suelo
- Page ID
- 89521
Joann Whalen, Noura Ziadi, Jeff Schoenau, Maxime C. Paré, David Burton y Tom Bruulsema
Objetivos de aprendizaje
Al concluir este capítulo, los alumnos podrán:
- Conocer las formas de nutrientes del suelo que pueden ser adquiridos por las plantas
- Conocer los factores que controlan las transformaciones de nutrientes en formas disponibles para plantas
- Comprender cómo evaluar la fertilidad del suelo con pruebas de suelo y análisis de plantas
- Entender que se pueden aplicar fertilizantes inorgánicos y orgánicos para reponer el suministro de nutrientes del suelo
- Familiarizarse con el enfoque de administración de nutrientes 4R para el manejo de nutrientes del suelo
- Ser conscientes de las implicaciones ambientales del manejo de los nutrientes del suelo
- Familiarízate con algunos ejemplos de mejora de la fertilidad del suelo en Canadá
INTRODUCCIÓN
Los suelos apoyan el crecimiento de las plantas. Las semillas germinan en el ambiente cálido y húmedo del suelo. La plántula emerge en la superficie del suelo, que necesita ser porosa y no compactada, sin costra superficial. El alargamiento del radical y el desarrollo del sistema radicular se produce fácilmente en suelos con una estructura desmenuzable y suelta. El sistema radicular tiene dos funciones vitales. El primero es el anclaje. Muchas plantas cultivan una raíz primaria gruesa y fuerte que es aproximadamente tan alta como el tallo. Una planta que está firmemente arraigada en el suelo es poco probable que sea desalojada por eventos normales de lluvia y tormentas de viento. La segunda función vital es la adquisición de recursos, ya que la mayor parte del agua y muchos elementos esenciales para el crecimiento de las plantas son absorbidos a través de los pelos radiculares (Cuadro 7.1).
Cuadro 7.1. Elementos vegetales esenciales, y las formas de cationes nutritivos, aniones y moléculas absorbidas por las raíces de las plantas (adaptado de Havlin et al., 2014)
| Elemento esencial | Concentración | Forma (s) nutritiva (s) absorbida | ||
|---|---|---|---|---|
| (μg g -1 masa seca) | Catión | anión | Molécula | |
| C | 450000 | CO 2 1 | ||
| H | 450000 | H 2 O 2 | ||
| O | 60000 | CO 2, H 2 O | ||
| N | 15000 | NH 4 + | NO 3 - | N 2 3 |
| K | 10000 | K + | ||
| Ca | 5000 | Ca 2+ | ||
| P | 2000 | HPO 4 2-, H 2 PO 4 - | ||
| S | 2000 | SO 4 2- | SO 2 4 | |
| Mg | 1000 | Mg 2+ | ||
| Fe | 100 | Fe 2 +, Fe 3 + | Quelato soluble 5 | |
| Cl | 100 | Cl - | ||
| Mn | 50 | Mn 2+ | Quelato soluble | |
| B | 20 | H 2 BO 3 - | H 3 BO 3, quelato soluble | |
| Zn | 20 | Zn 2+ | Quelato soluble | |
| Cu | 6 | Cu 2+ | Quelato soluble | |
| Mo | 0.1 | MoO 4 - | Quelato soluble | |
| Ni | 0.01 | Ni 2 + | Quelato soluble | |
| 1 CO 2 gas se absorbe a través de las hojas y se convierte en carbohidratos (CH 2 O) n vía fotosíntesis. 2 H 2 O, como vapor de agua o agua líquida, se absorbe a través del follaje y las raíces. 3 Los procariotas simbióticos y asociativos fijadores de N 2 que crecen con la planta transforman el gas N 2 en NH 4 + mediante la fijación biológica de nitrógeno, y luego se transportan a las células vegetales. 4 Menos del 10% del requerimiento de azufre de la planta proviene del gas SO 2 absorbido a través de las hojas. 5 Los quelatos solubles son fácilmente absorbidos por la raíz. |
||||
La fertilidad del suelo se refiere a la capacidad del suelo para suministrar iones nutritivos para el crecimiento de las plantas. Los suelos tienen fertilidad inherente, la cual depende de cuatro factores:
- material parental, que se meteoriza para liberar nutrientes;
- vegetación, que produce residuos orgánicos que se descomponen para liberar nutrientes;
- organismos que participan en la meteorización y son responsables de la descomposición y el ciclo de nutrientes; y
- clima, que determina las tasas de procesos biológicos, químicos y físicos que contribuyen o agotan el suministro de nutrientes del suelo.
La fertilidad inherente del suelo es un buen predictor de qué especies de plantas crecerán en un área determinada bajo condiciones naturales, sin intervención humana. Cuando cosechamos cultivos agrícolas para alimentar a las personas y al ganado, eliminamos algunos nutrientes del sistema suelo-planta. En consecuencia, los agroecosistemas suelen ser fertilizados para reponer o aumentar el suministro de nutrientes del suelo. Seleccionar el fertilizante adecuado y otras modificaciones del suelo requiere una decisión cuidadosa, ya que es costoso comprar y aplicar estos materiales a tierras agrícolas, y porque el uso excesivo puede tener consecuencias ambientales negativas. Las granjas de Canadá pueden seguir planes de manejo de nutrientes para guiar la aplicación de materiales fertilizantes a suelos agrícolas, para obtener los mejores resultados agronómicos, económicos y ambientales.
NUTRIENTES EN EL SISTEMA SUELO-PLANTA
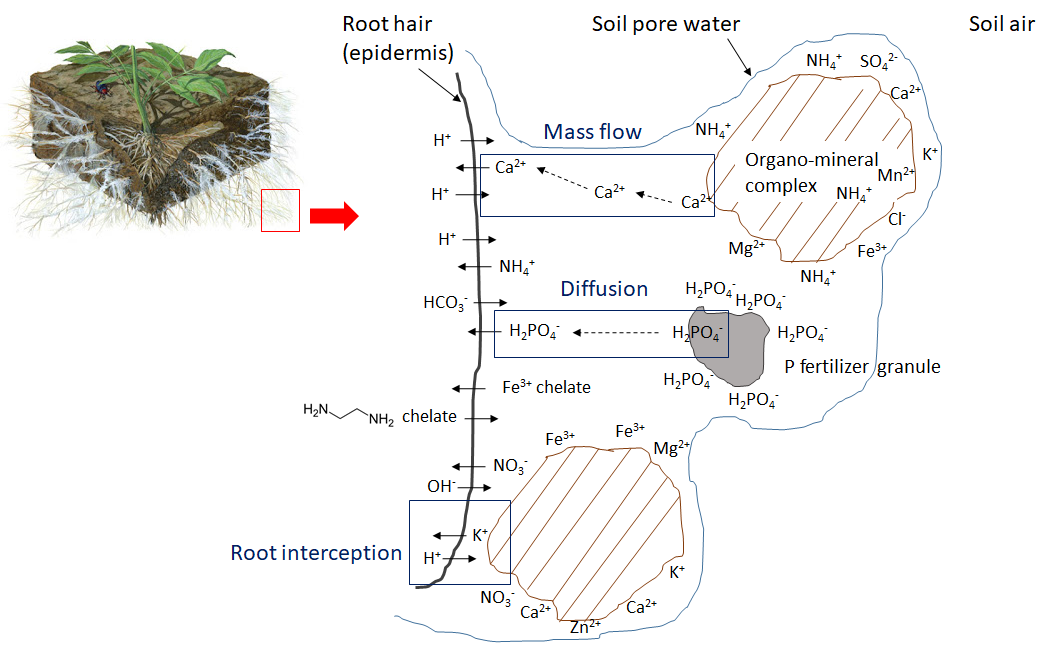
Las raíces finas y los pelos radiculares crecen en los poros del suelo, que contienen aire y agua. El agua de poro del suelo es una solución electrolítica diluida que contiene iones nutritivos solubles Para satisfacer sus necesidades de agua, las plantas absorben agua del suelo por ósmosis y dependen de las acuaporinas para conducir selectivamente moléculas de agua dentro y fuera de las células, lo que regula el volumen celular y la presión osmótica interna. Los iones solubles en agua en el agua de los poros del suelo ingresan a los pelos radiculares y se difunden Sin embargo, la superficie de la raíz debe mantener la neutralidad eléctrica. Cualquier ion que entre en la raíz provoca la liberación de un contraión como H +, OH — o HCO 3 — (Figura 7.1). Por ejemplo, cuando un ion cargado positivamente como el potasio (K +, un catión) pasa a través de la epidermis de la raíz, la raíz libera un ion H + en el agua de poro del suelo circundante, y la absorción de un ion calcio (Ca 2 +) da como resultado la liberación de 2 H + en el agua de poro del suelo. La absorción de aniones se equilibra de manera similar, de tal manera que la absorción de nitrato (NO 3 —) hace que la raíz libere un ion OH — o un ion HCO 3 — en el agua de poro del suelo.
Una vez dentro de la raíz, los iones solubles en agua pueden moverse por el apoplasto de la corteza, una vía de transporte que transporta agua y sustancias disueltas a lo largo de las paredes celulares y el espacio extracelular fuera de las membranas plasmáticas. Existen otras dos vías para el movimiento iónico soluble en agua: las vías simplásica y transmembrana. En la vía simplásica, el agua y los solutos se mueven a lo largo del citosol y cruzan las membranas plasmáticas de las células adyacentes a través de los plasmodesmas. Alternativamente, en la vía transmembrana, los minerales disueltos y el agua se mueven de célula a célula cruzando la pared celular, saliendo de una célula antes de que entren en la siguiente célula. La capa suberizada que rodea la endodermis actúa como una barrera física, y los iones deben ser transportados a través de la membrana plasmática a través de canales proteicos uniéndose con proteínas transportadoras. Algunas de las proteínas transportadoras responsables del flujo de iones nutritivos en las plantas se enumeran en el Cuadro 7.2. A continuación, los iones nutritivos ingresan al xilema y se transportan junto con el agua hasta el tallo, las hojas, las flores, las semillas y otros componentes. Los iones nutritivos pueden incorporarse en compuestos estructurales dentro de estos órganos vegetales, o apoyar procesos metabólicos en el citoplasma. Además, los iones nutritivos pueden ser remobilizados y translocados a otros tejidos u órganos si son necesarios en otra parte de la planta.
Cuadro 7.2. Las proteínas transportadoras median el flujo de iones nutritivos a través de las membranas plasmáticas de las plantas vasculares. Adaptado de Reid y Hayes (2003)
| Ión nutrimental | Proteína transportadora | Comentarios |
|---|---|---|
| NH 4 + | Proteínas del transportador AMT de alta afinidad | |
| NO 3 - | Familia de la proteína transportadora de nitrato (NRT2) | |
| H 2 PO 4 - y HPO 4 2- |
Proteína transportadora PHT1 | PHT1; 1 a PHT1; 9 fueron identificados en Arabidopsis thaliana |
| K + | Familia de proteína transportadora K + (Trk) | |
| SO 4 2- | SO 4 2- proteínas del transportador | Las plantas también poseen el transportador de cisteína (Cys), el transportador de metionina (Met) y el transportador de glucosinolato (GSL) |
| Ca 2+ | Transportadores Ca 2+, Ca 2+ -ATPasas y antitransportadores H + /Ca 2+ | Las proteínas transportadoras que mueven Ca 2+ a través de la membrana, contra el gradiente electroquímico, se denominan específicamente bomba de iones. |
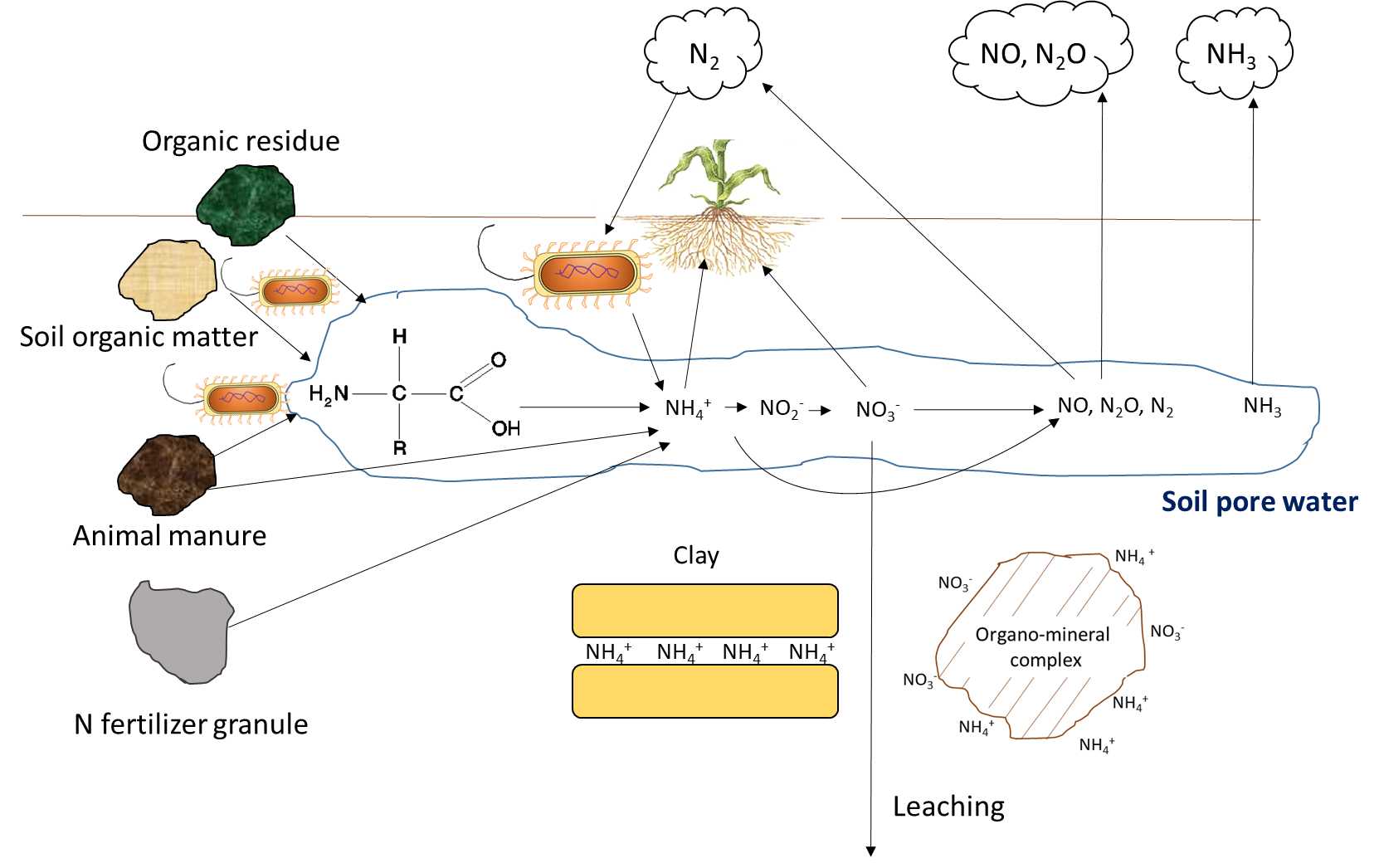
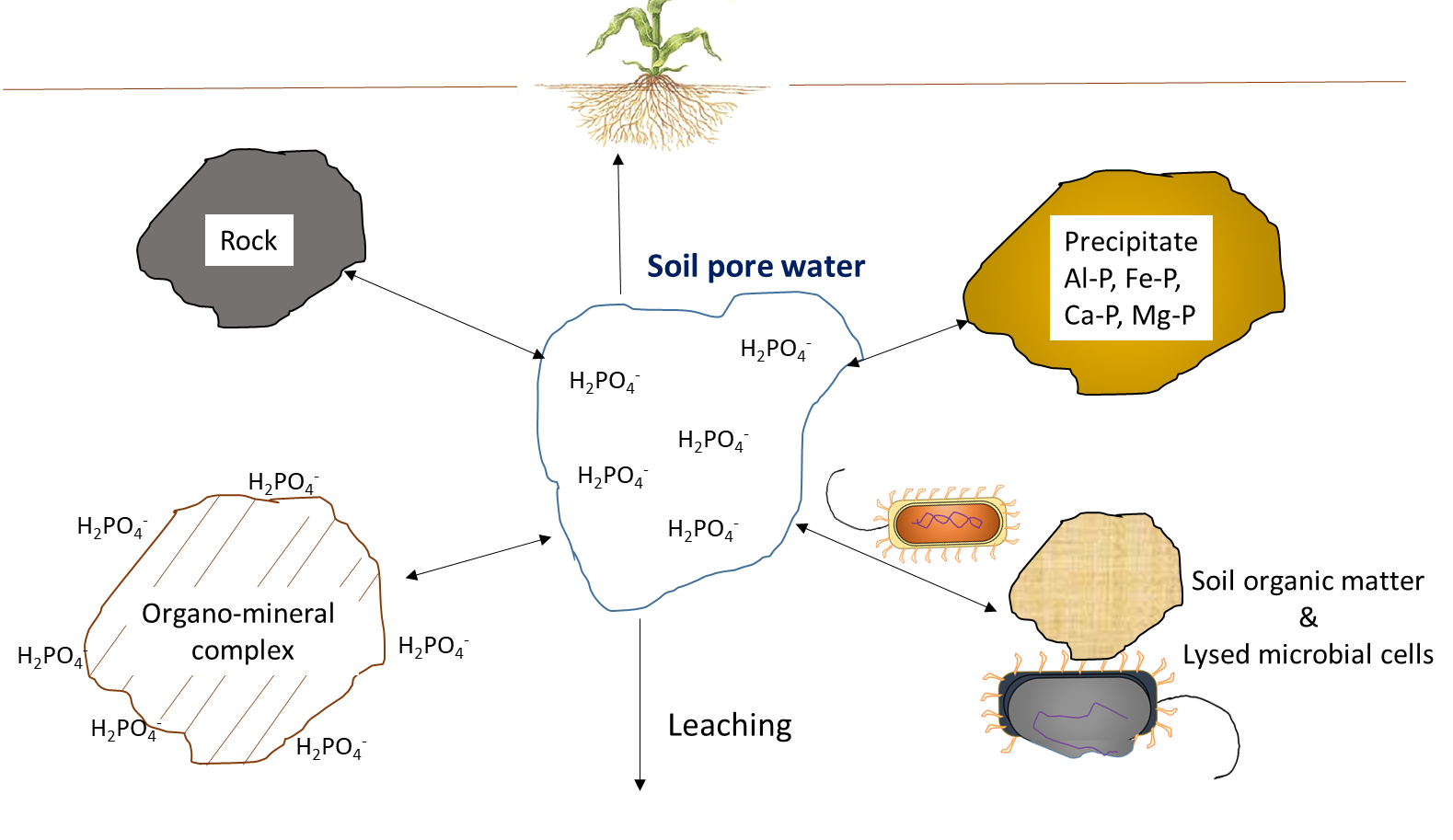
La absorción de plantas agota la concentración de iones nutritivos en el suelo. Los iones pueden moverse junto con el agua a través del flujo másico o ser interceptados por raíces en crecimiento que hacen contacto con iones intercambiables en superficies organo-minerales, proceso denominado interceptación de raíces (Figura 7.1). Los iones también pueden moverse a través de gradientes de difusión desde una zona de alta concentración hasta una zona de baja concentración en el agua de poro cerca de la raíz (Figura 7.1). La concentración de iones nutritivos en el agua de poro del suelo también se ve afectada por múltiples procesos biológicos, químicos y físicos simultáneos, ilustrados en la Figura 7.2.
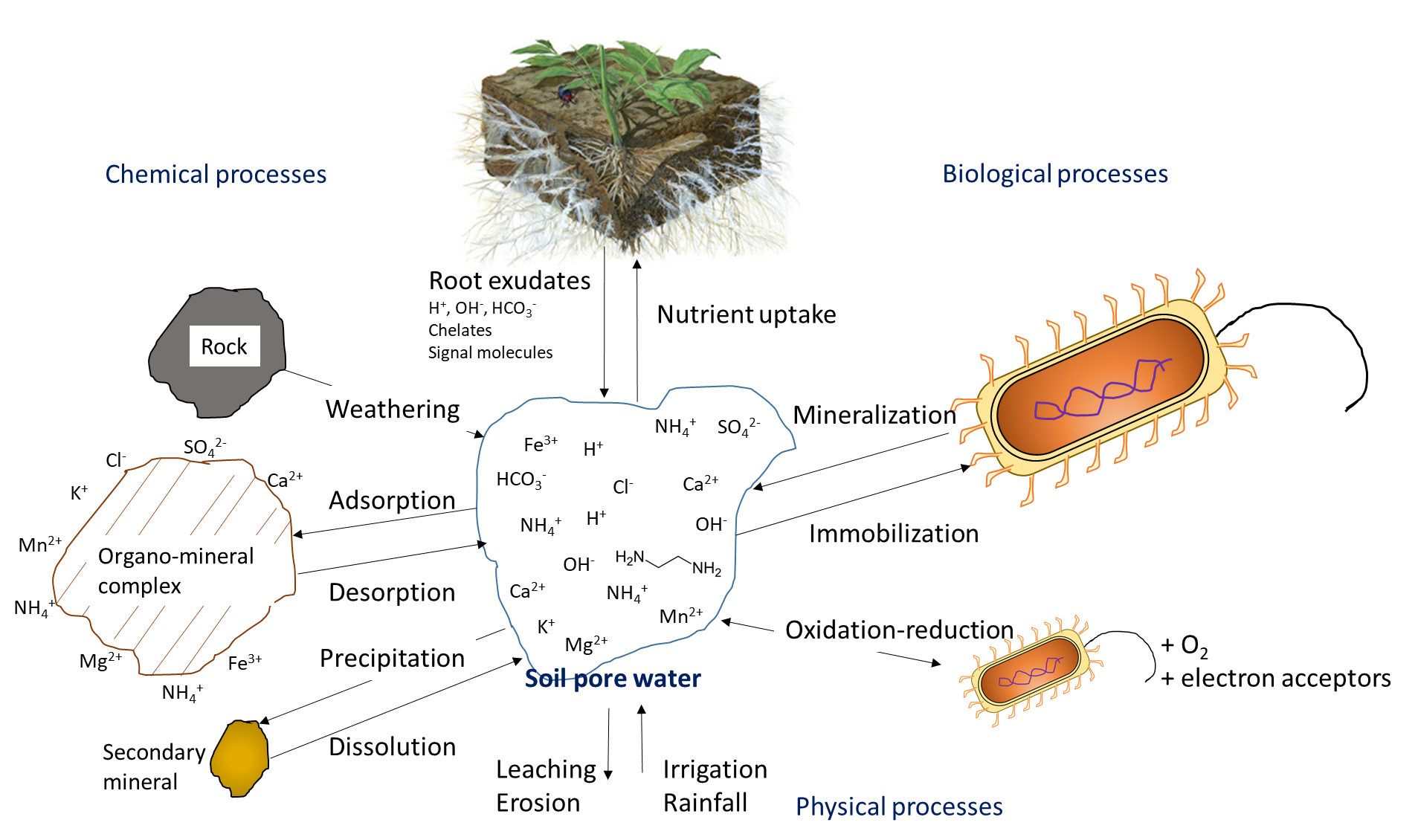
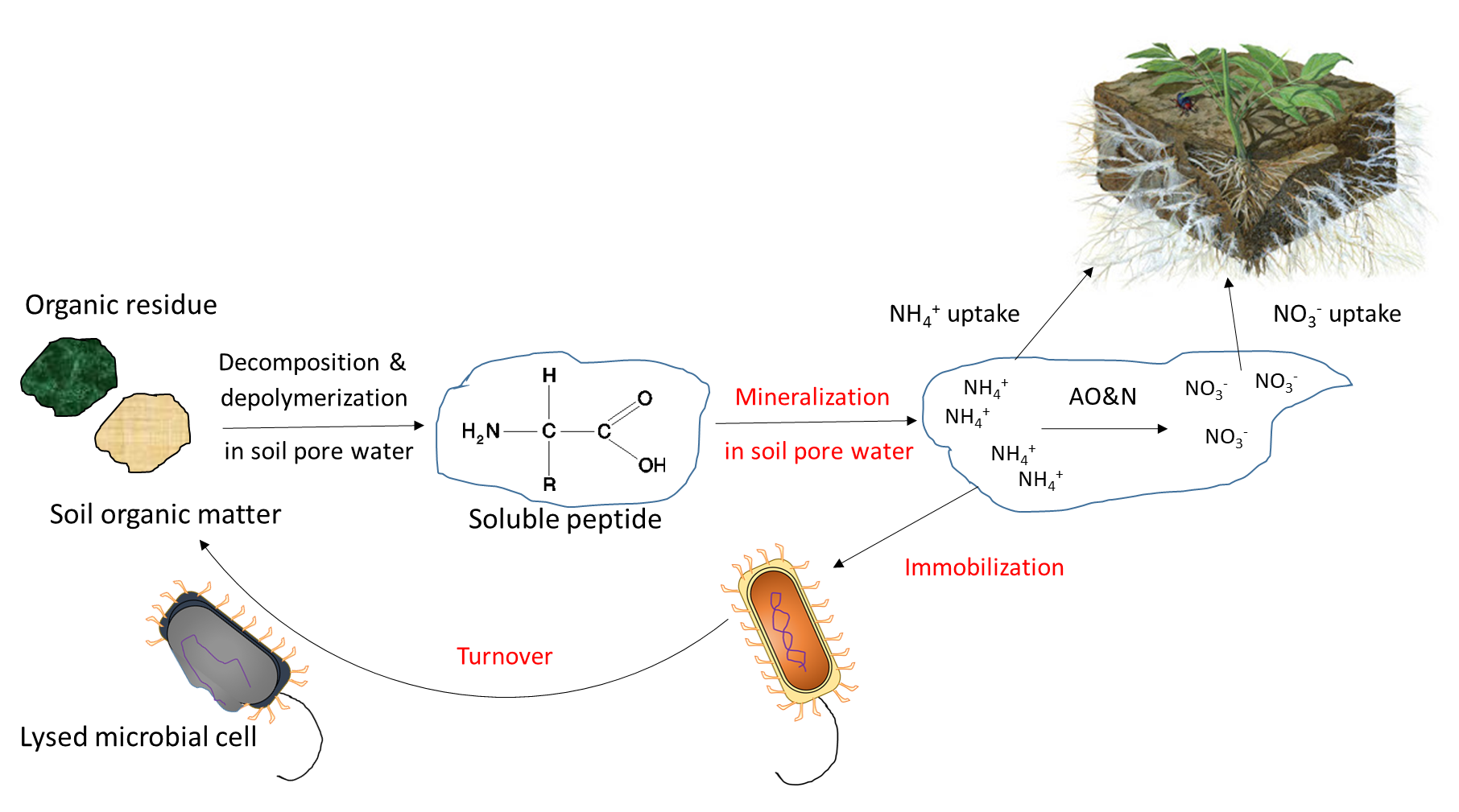
La actividad biológica es responsable de la mineralización de compuestos orgánicos, los cuales liberan iones nutritivos solubles en agua. La mineralización requiere de una enzima hidrolítica específica, producida por raíces de plantas o microorganismos del suelo, para escindir los enlaces covalentes en un compuesto orgánico. Las enzimas del suelo funcionan en presencia de agua, a menudo fuera de las células biológicas. La mineralización de la materia orgánica del suelo y los residuos orgánicos libera amonio (NH 4 +), fosfato (HPO 4 2-, H 2 PO 4 —) y sulfato (SO 4 2-) en el agua de poro del suelo. La inmovilización se refiere a la absorción de iones nutritivos por organismos distintos de las plantas. Los iones se inmovilizan en la biomasa microbiana del suelo por un periodo limitado de tiempo (días a semanas) mientras el microorganismo crece y se reproduce, y se liberan al final de su vida útil. El concepto mineralización-inmovilización-recambio se aplica a cualquier nutriente que esté unido covalentemente en materia orgánica, incluyendo carbono, nitrógeno, fósforo y azufre. Una ilustración del concepto (Figura 7.3) muestra cómo los microorganismos producen enzimas para hidrolizar proteínas, liberando NH 4 + en el agua de poro del suelo, que luego se inmoviliza dentro de las células microbianas en crecimiento, y finalmente se vuelve a liberar en el agua de los poros del suelo tras la lisis de esas células.
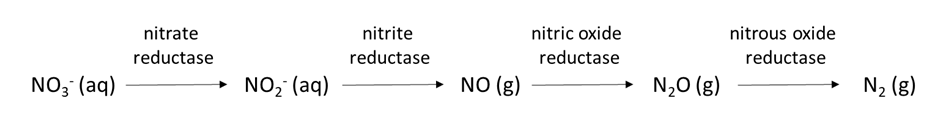
La concentración de oxígeno en el agua de los poros del suelo afecta la transformación de iones nutritivos. El oxígeno se mueve aproximadamente 1000 veces más rápido a través de los poros llenos de aire que a través del agua del suelo, por lo que no es raro que la limitación de oxígeno se presente en el agua La disponibilidad limitada de oxígeno puede estimular la desnitrificación, una reacción biológica en la que los aceptores de electrones de nitrógeno ganan electrones y disminuyen su estado de oxidación, p.
NO 3 — (aq) → NO 2 — (aq) → NO x (g) → N 2 O (g) → N 2 (g)
que también cambia la forma química del nitrógeno de NO 3 soluble en agua — a gas dinitrógeno (N 2). La reducción química de elementos como Mn, Fe y sulfato en suelos anóxicos (bajos en oxígeno) es otro proceso que altera la especiación química y las cantidades de estos iones nutritivos en el agua de poro del suelo.
Las reacciones químicas que agregan iones nutritivos al agua de los poros del suelo incluyen la meteorización, que ocurre cuando las superficies rotas y expuestas de las superficies minerales se exponen a compuestos ácidos, como el ácido carbónico. La disolución se refiere a la solubilización de iones nutritivos de arcillas y materiales coloidales en presencia de agua. En suelos secos, la disolución es menos común porque un bajo volumen de agua de poro del suelo aumentará la proximidad de iones nutritivos con iones reactivos y moléculas que pueden formar precipitados. Las reacciones de complejación superficial en superficies organo-minerales pueden aumentar la concentración de iones nutritivos, a través de reacciones de desorción, o eliminar iones de la solución del suelo a través de reacciones de adsorción.
La concentración de iones nutritivos depende en gran medida del contenido de agua en los poros del suelo. El riego y la lluvia agregan agua a los poros del suelo, diluyendo así los iones nutritivos solubles en agua. En regiones húmedas que tienen más precipitación que evapotranspiración, los poros del suelo pueden alcanzar periódicamente un espacio de poro 100% lleno de agua. Esto limitará la difusión de oxígeno, lo que afecta las reacciones de oxidación-reducción, e impide el crecimiento de la mayoría de las plantas, excepto aquellas con adaptaciones morfológicas que les permitan tolerar la inundación. Las actividades agrícolas generalmente ocurren en terrenos que tienen buen drenaje natural o donde se instalan sistemas de drenaje para fomentar el movimiento del agua por debajo de la capa superior del suelo cultivable. El drenaje elimina el agua, pero también lixivia los iones nutritivos solubles en agua a través del perfil, junto con el agua. La eliminación del exceso de agua de la capa superior del suelo mediante drenaje o evaporación aumentará la concentración relativa de iones solubles en agua que permanecen en el agua de los poros del suelo.
FERTILIDAD DEL SUELO Y NUTRICIÓN VEGETAL
Las plantas adquieren la mayor parte de sus iones de nutrientes esenciales del agua de poro del suelo, un ambiente dinámico. En la agricultura, se hace mucho esfuerzo para entender el suministro de nutrientes del suelo. ¿Un suelo en particular tiene suficientes nutrientes para apoyar las necesidades de la planta, o necesitamos agregar fertilizantes que contengan nutrientes para evitar una deficiencia de nutrientes de las plantas?
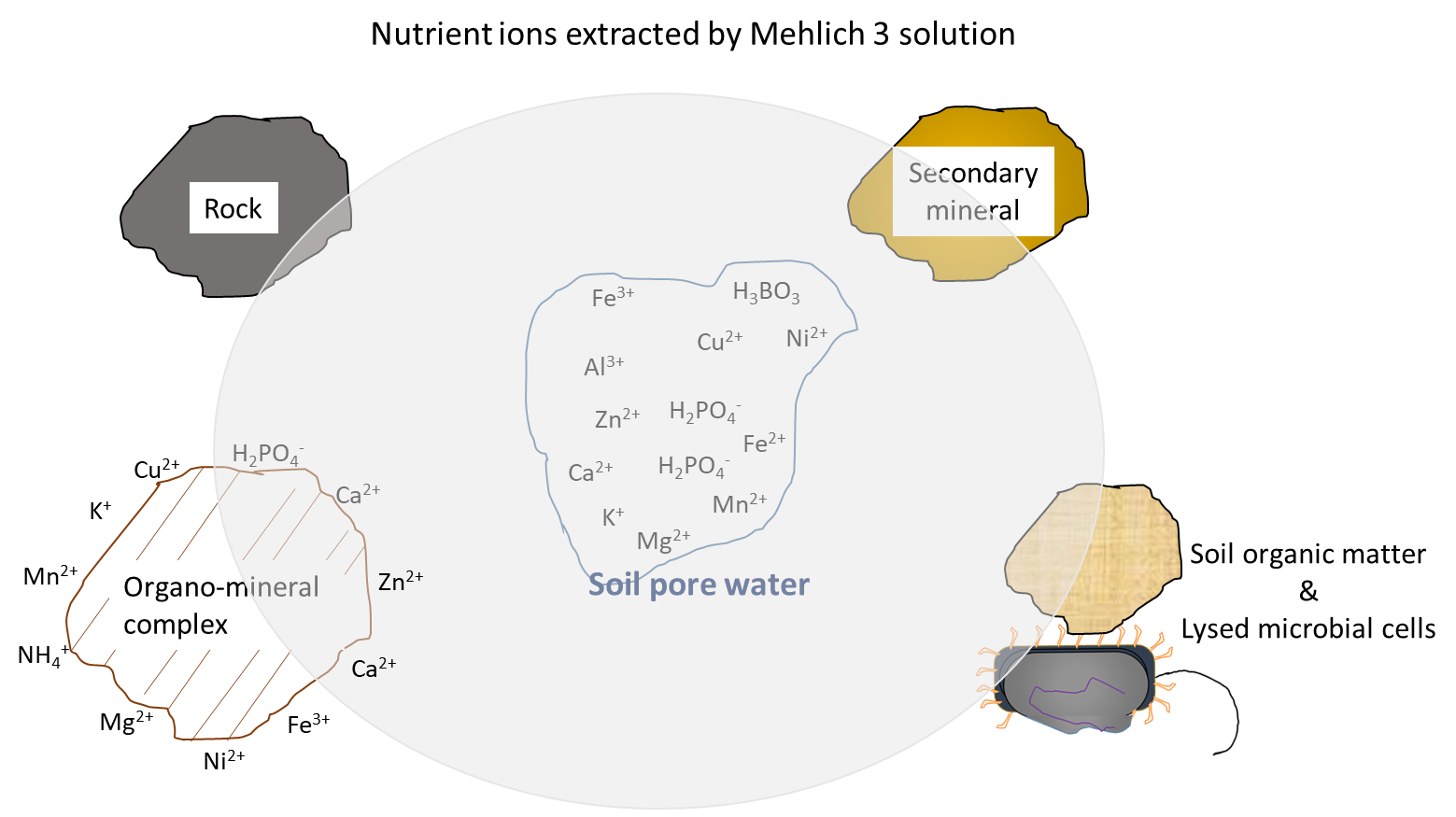
Las pruebas de fertilidad del suelo son una manera precisa de evaluar el suministro de nutrientes en suelos agrícolas. El propósito principal de las pruebas de fertilidad del suelo es determinar si un suelo contiene suficientes nutrientes para satisfacer las necesidades de un cultivo anual durante su vida útil (una temporada de crecimiento). Además, las pruebas de fertilidad del suelo pueden determinar si existe un suministro adecuado de nutrientes para los cultivos perennes durante sus fases de establecimiento y producción, que abarcan múltiples temporadas de crecimiento. Las pruebas de fertilidad del suelo se apoyan en análisis químicos y biológicos realizados por laboratorios certificados. Los resultados de estas pruebas son un buen indicador del suministro de nutrientes disponibles en las plantas. Este concepto se basa en la comprensión de dos hechos. Primero, la planta adquirirá iones nutritivos del agua de poro del suelo a lo largo de la temporada de crecimiento de acuerdo con sus demandas de nutrientes. Segundo, el agua de poro del suelo se repondrá con iones nutritivos solubles en agua a una velocidad que refleje los procesos biológicos, químicos y físicos combinados que contribuyen y eliminan iones del agua de poro del suelo, durante la temporada de crecimiento. Por esta razón, los métodos de prueba del suelo como la extracción Mehlich 3 eliminan los iones nutritivos del agua de poro del suelo y otras fuentes (Figura 7.4), una buena aproximación del suministro de nutrientes que estará disponible para las plantas durante la temporada de crecimiento.
Otro propósito de las pruebas de fertilidad del suelo es evaluar la probabilidad de una respuesta rentable a los fertilizantes y enmiendas del suelo. Esta evaluación forma parte de un plan integrado para mejorar las condiciones de cultivo de los cultivos. Las granjas establecen metas de rendimiento para sus cultivos, de acuerdo con las metas de producción y los rendimientos económicos que esperan lograr. El rendimiento máximo que se puede esperar para un cultivo en particular depende de sus características genéticas y fisiológicas, que rigen la capacidad fotosintética de la planta, su capacidad para adquirir agua y nutrientes del suelo, y su capacidad para convertir estos recursos en granos, oleaginosas, tubérculos almidonados, frutos o otros productos comercializables. Además, el rendimiento máximo está influenciado por la respuesta de la planta a las condiciones ambientales durante la temporada de crecimiento. El clima desfavorable puede proporcionar demasiada o muy poca lluvia para el cultivo. El estrés por calor resultante de temperaturas demasiado calurosas durante los meses de verano, o daños por heladas en los meses de primavera y otoño, son estresantes para los cultivos. Las granjas también siguen buenas prácticas agronómicas para controlar los factores limitantes del crecimiento. Por ejemplo, el número de plantas que ocupan un área determinada está optimizado para interceptar toda la radiación solar disponible, pero un espaciado demasiado cercano podría causar competencia entre las plantas y debe evitarse. Las malas hierbas, plagas y organismos causantes de enfermedades deben ser controlados para evitar pérdidas de rendimiento. Finalmente, los suelos necesitan proporcionar los nutrientes adecuados, en el momento adecuado durante el desarrollo del cultivo, para lograr el rendimiento esperado y los resultados de calidad.
¡Puedes Cavar!
Cuando el arándano se vuelve salvaje con fertilizante nitrogenado
La disponibilidad de nitrógeno (N) en la solución del suelo limita el crecimiento vegetal y los rendimientos de los cultivos en la mayoría de los agroecosistemas. Es por ello que los agricultores suelen fertilizar sus campos con una o varias formas de N. Sin embargo, la eficacia de la fertilización con N depende de varios factores, entre ellos la presencia de malezas, las cuales pueden competir con el cultivo por la adquisición de N. contraproducente ya que puede estimular el crecimiento de malezas en lugar del cultivo objetivo.
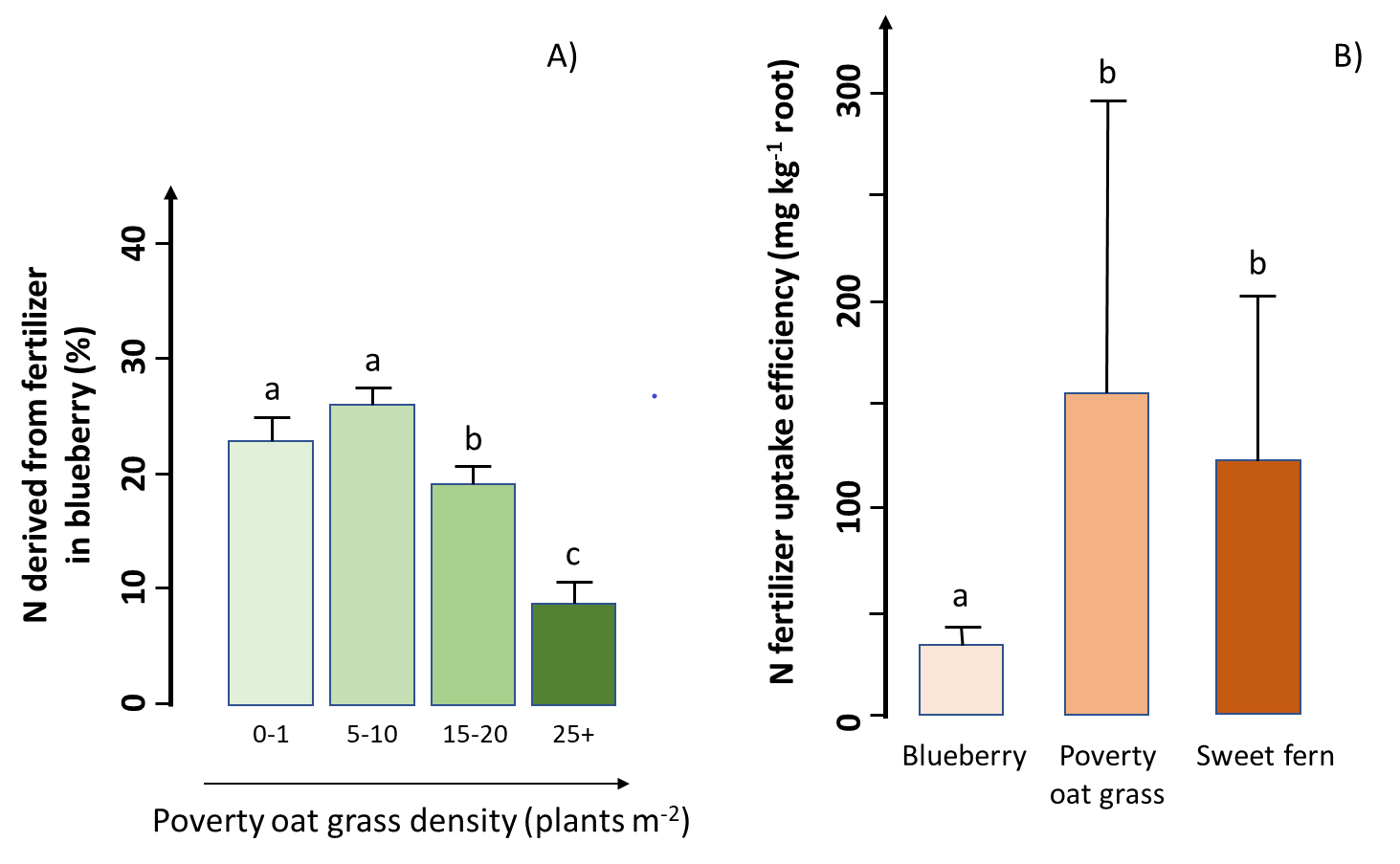
Los investigadores realizaron un estudio en un campo comercial de arándano bajo (Vaccinium angustifolium Aiton) de la región del Lac Saint-Jean, Québec, Canadá, para evaluar la eficacia de la fertilización de N en presencia de dos especies de malezas comunes (pasto de avena pobre y helecho dulce). Los investigadores encontraron una producción de biomasa aérea mucho mayor y una mayor cantidad de N en el arándano que en ambas especies de malezas, lo que indica que el arándano capturó la mayor parte del fertilizante de N agregado. Sin embargo, el crecimiento de arándanos y la absorción de fertilizantes disminuyeron al aumentar la densidad de malezas (Figura A). Cuando la densidad de pasto de avena en la pobreza fue de más de 15 plantas m -2, esta maleza capturó aproximadamente la misma cantidad de fertilizante que el arándano a pesar de una biomasa bajo tierra mucho menor, lo que resultó en un impacto negativo significativo en la producción de arándanos. Además, los investigadores encontraron que la eficiencia de captación de fertilizantes (la absorción de fertilizantes por gramo de raíz) fue aproximadamente cuatro veces menor en el arándano que en ambas especies de malezas (Figura B). Es decir, en comparación con las malas hierbas, el arándano requiere cuatro veces más biomasa debajo del suelo para adquirir la misma cantidad de N del fertilizante.
La historia completa se proporciona en Marty et al. (2019)
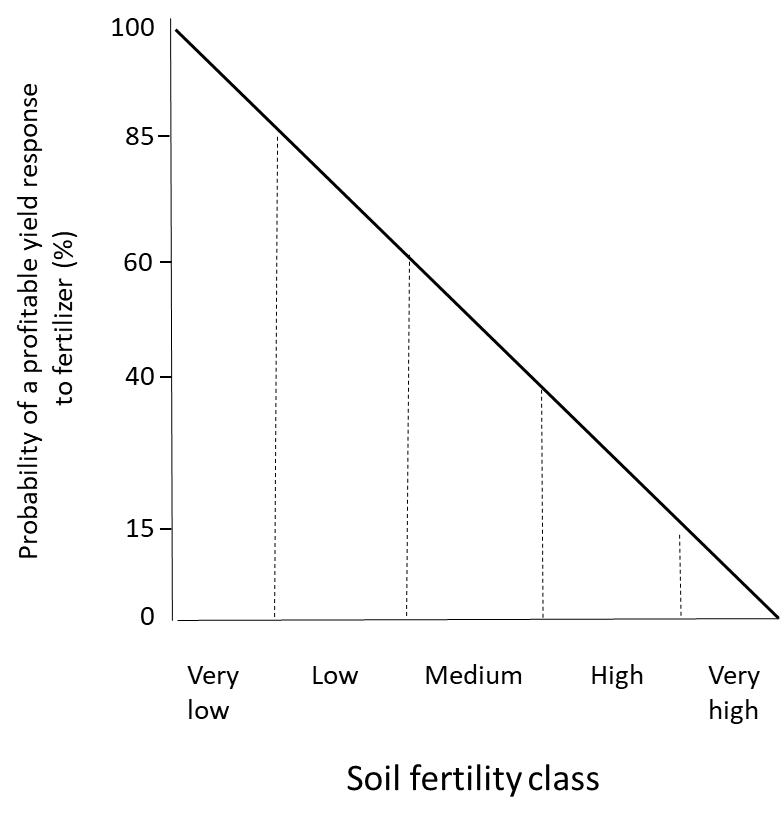
Dado que las pruebas de fertilidad del suelo cuantifican las concentraciones de nutrientes disponibles en las plantas, se puede usar para interpretar la respuesta del cultivo a los insumos de nutrientes. Las pruebas de fertilidad del suelo deben ir acompañadas de mediciones de la respuesta del cultivo a los insumos de nutrientes en ambientes controlados como cámaras de crecimiento e invernaderos, y en campo. En suelos con un suministro de nutrientes bajo a medio, probablemente se mejorará el crecimiento de los cultivos mediante la adición de fertilizantes. Por otro lado, los cultivos plantados en suelos con fertilidad alta a excesivamente alta rara vez se benefician de la aplicación de fertilizantes (Figura 7.5). Dado que los fertilizantes cuestan dinero para comprar, transportar y aplicar a campos, no es rentable aplicar fertilizante cuando no se espera una mejora del rendimiento, ya que esto no dará un retorno económico de la inversión.
La nutrición de las plantas se determina midiendo el contenido de nutrientes de las plantas, ya sea en un tejido específico o en toda la planta. Cuando las plantas reciben abundantes nutrientes del suelo y fertilizantes, si es necesario, su concentración de nutrientes estará en el rango suficiente. Cuando el suministro de nutrientes del suelo es insuficiente y no se aplica fertilizante, la planta será deficiente en ese nutriente. Las plantas que acumulan más nutrientes de los que necesitan para sus procesos metabólicos podrían tener un nivel excesivamente alto o tóxico de nutrientes (Figura 6). La toxicidad nutrimental es poco común para macronutrientes como N, P, K, Ca, Mg y S porque los procesos de transporte activo que transfieren iones nutritivos solubles en agua a través de la endodermis y hacia el xilema están estrechamente regulados a nivel genético. La toxicidad se observa a veces cuando micronutrientes como B, Fe, Mn, Zn y Cu se aplican a tasas demasiado altas al follaje debido a que estos elementos pueden dañar las células fotosintéticas sensibles en las hojas. Sin embargo, estos micronutrientes pueden ser absorbidos de manera segura a través del sistema radicular debido a que las plantas cuentan con mecanismos de defensa que controlan la captación, acumulación y translocación de micronutrientes y otros metales. Esto implica retener el ion en las células radiculares, donde se desintoxican a través de la complejación con aminoácidos, ácidos orgánicos o péptidos de unión a metales y/o secuestrados en vacuolas. Estos mecanismos evitarán la translocación de micronutrientes a los tejidos foliares sensibles.
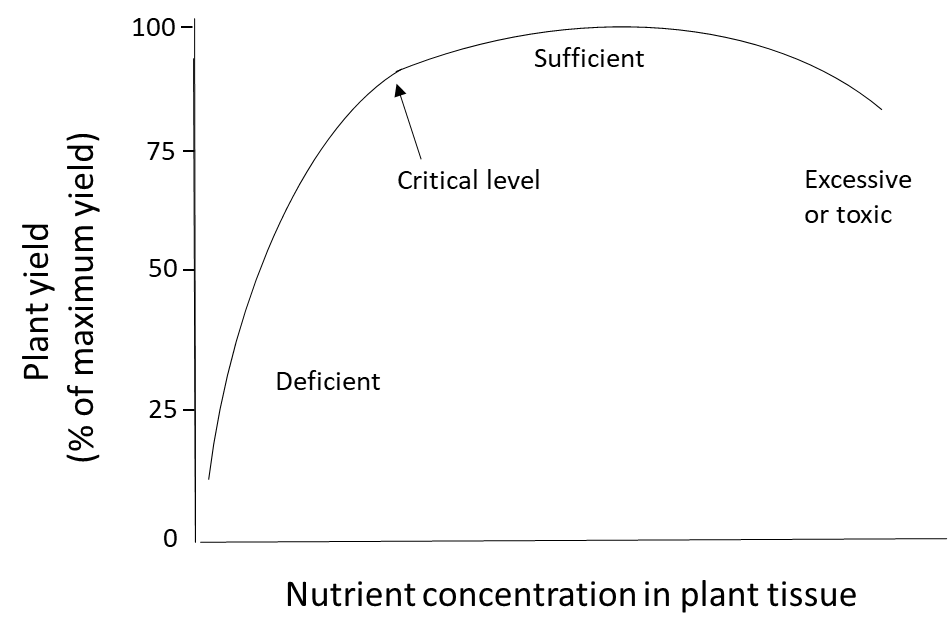
Los requerimientos de nutrientes son conocidos para todos los cultivos agrícolas. Los cultivos que tienen menos que el nivel crítico de nutrientes para el desarrollo no crecerán normalmente, se atrofiarán y pueden mostrar síntomas de deficiencia como clorosis (coloración amarillenta de las hojas). Esto puede ser una señal de que la planta carecía de los nutrientes necesarios para producir clorofila, ya que una planta bien nutrida producirá hojas de color verde oscuro para la fotosíntesis. Incluso si no hay síntomas visibles de una deficiencia de nutrientes, la nutrición inadecuada de las plantas puede producir otros resultados indeseables:
- tallos débiles que son susceptibles de hospedarse durante tormentas de viento, granizadas y tormentas intensas;
- pocas flores o inflorescencias;
- aborto de semillas;
- semillas de mala calidad (bajo contenido de proteínas, carentes de aminoácidos esenciales, bajo contenido de lípidos); y
- pérdida de rendimiento comercializable debido a la poca producción de semillas/granos, pequeños frutos y tubérculos.
La mejor manera de determinar si el crecimiento de los cultivos está limitado por la falta de nutrientes es muestrear y analizar el tejido vegetal. Esto implica tomar una muestra de la planta en una etapa de crecimiento apropiada, generalmente durante el crecimiento vegetativo o en la etapa temprana de crecimiento reproductivo. La muestra de planta se envía luego a un laboratorio certificado para su análisis, y los resultados pueden interpretarse verificando tablas de referencia que presentan el nivel suficiente de macro y micronutrientes en un cultivo en particular (Cuadro 7.3). Dado que cada cultivo tiene requerimientos de nutrientes únicos en cada una de sus etapas de crecimiento, la tabla de referencia tiene que ser específica para las especies de cultivo de interés. Además, el análisis de tejido vegetal se realiza temprano en la temporada de crecimiento porque los resultados pueden indicar que se deben aplicar fertilizantes para corregir o prevenir una deficiencia de nutrientes. El análisis oportuno del tejido vegetal puede guiar al agricultor a realizar una aplicación de nutrientes en temporada que evitará pérdidas de rendimiento. Sin embargo, el diagnóstico de una prueba de tejido vegetal puede llegar demasiado tarde para tomar medidas correctivas. Por ejemplo, el cultivo puede ser demasiado grande para que los aplicadores de fertilizantes ingresen al campo. Otra posibilidad es que el nutriente deficiente no sea móvil en la planta, lo que significa que es demasiado tarde en el desarrollo de la planta para superar la limitación de crecimiento asociada a esta deficiencia nutrimental. Por lo tanto, las pruebas de fertilidad del suelo son la herramienta de diagnóstico más importante para evitar un resultado económico negativo que ocurre cuando los cultivos tienen una nutrición inadecuada durante la temporada de crecimiento.
Cuadro 7.3. Rangos de suficiencia para macronutrientes y micronutrientes en plantas de maíz, en relación con las etapas de crecimiento del maíz (basado en Jones, 2003)
| Elemento | Escenario V4-V6 (30 cm de alto) |
Etapa V10 (antes de tasselling) |
Etapa R1 (seda inicial) |
|---|---|---|---|
| Nitrógeno (%) | 3.50-5.00 | 3.00-5.00 | 2.70-4.00 |
| Fósforo (%) | 0.30-0.50 | 0.25-0.45 | 0.25-0.50 |
| Potasio (%) | 2.50-4.00 | 2.00-2.50 | 1.70-3.00 |
| Calcio (%) | 0.30-0.70 | 0.25-0.50 | 0.21-1.00 |
| Magnesio (%) | 0.15-0.45 | 0.13-0.30 | 0.20-1.00 |
| Azufre (%) | 0.15-0.50 | 0.15-0.50 | 0.21-0.50 |
| Boro (mg kg -1) | 5-25 | 4-25 | 5-25 |
| Cobre (mg kg -1) | 5-20 | 3-15 | 6-20 |
| Hierro (mg kg -1) | 50-250 | 10-100 | 20-250 |
| Manganeso (mg kg -1) | 20-300 | 15-300 | 20-200 |
| Molibdeno (mg kg -1) | 0.10-0.30 | 0.10-0.30 | 0.10-0.20 |
| Zinc (mg kg -1) | 20-60 | 15-60 | 25-100 |
FERTILIZANTES Y ENMIENDAS DE SUELOS
El fertilizante es cualquier material que suministra iones nutritivos solubles en agua para la producción de cultivos. Las plantas absorben iones nutritivos del agua de poro del suelo, sin preferencia ni discriminación entre fuentes de fertilizantes. Por lo tanto, cualquier fertilizante que libere iones nutritivos solubles en agua podría ser beneficioso para las plantas. Las características de algunos fertilizantes que pueden incrementar el suministro de NH 4 + y NO 3 — en el suelo se enumeran en el Cuadro 7.4.
Cuadro 7.4. Características de algunos fertilizantes nitrogenados que pueden suministrar NH 4 + y NO 3 - para cultivos, basados en IPNI (2012) y Munroe (2016)
| Fertilizante | Análisis garantizado 1 | Comentarios |
|---|---|---|
| Amoníaco anhidro | 82-0-0 | Aplicado como gas comprimido; requiere equipo especial y entrenamiento |
| Nitrato de calcio y amonio | 27.5-0-0 | Granular; soluble en agua |
| Sulfato de amonio | 21-0-0 + 24% de azufre |
Granular; soluble en agua |
| Urea | 46-0-0 | Granular; soluble en agua Hidrolizado por enzimas ureasa para liberar NH 4 + |
| Nitrato de urea y amonio | 28-0-0 | Solución que contiene 50% de urea y 50% de nitrato de amonio |
| Análisis típico 2 | ||
| Lechada líquida de cerdo | 2.2-2.7-1.9 | Solución (> 90% de agua) con relación C:N <5 |
| Lechada láctea | 1.2-1.8-2.9 | Solución (> 90% de agua) con relación C:N <10 |
| Estiércol de pollo | 2.4-1.1-1.0 | Sólido descompuesto, relación C:N <20 |
| Estiércol de vacuno | 0.8-1.8-2.6 | Sólido parcialmente descompuesto, relación C:N <25 |
| 1 El análisis garantizado se basa en el %N-%P 2 O 5 -%K 2 O en el fertilizante, sobre una base de peso seco. 2 El análisis típico del estiércol se basa en el %N-%P 2 O 5 -%K 2 O, sobre una base de peso húmedo |
||
Las fuentes de fertilizantes se pueden clasificar en función de cómo se fabrican, pero desde la perspectiva de la nutrición de las plantas, es más interesante considerar la rapidez con la que los iones nutritivos solubles en agua se liberan en el agua de los poros del suelo. Por ejemplo, el fosfato monoamónico granular comprado a una compañía de fertilizantes se disuelve en agua del suelo para liberar iones NH 4 + y H 2 PO 4 — solubles en agua. Otro fertilizante sólido es el estiércol de pollo, que contiene aproximadamente 4% de nitrógeno total y 0.5% de fósforo total (equivalente a 1.1% de P 2 O 5). El nitrógeno total está compuesto por ácido úrico, proteína y NH 4 +, y el fósforo total contiene compuestos ortofosfato (50-75% del P total) y compuestos orgánicos de fósforo como mio-inositol (25-50% del P total). Debido a que los pollos no producen enzimas fosfatasa en su tracto digestivo, sólo del 10 al 30 por ciento del fósforo orgánico en sus alimentos es absorbido por el animal y el fósforo no digerido es excretado. Cuando se aplica estiércol de pollo al suelo, los compuestos orgánicos de fósforo se disuelven en el agua del suelo y son degradados por enzimas fosfatasas que fueron producidas por raíces de plantas y microorganismos del suelo. La enzima fosfatasa hidroliza fósforo orgánico para liberar iones fosfato (HPO 4 2-) en el agua de poro del suelo (Figura 7.7). La disolución del fosfato monoamónico granular generalmente ocurre más rápido que la hidrólisis de compuestos orgánicos de fósforo en el estiércol de pollo, razón por la cual los fertilizantes a base de sal son un fertilizante de “liberación rápida” y el estiércol se considera un fertilizante de “liberación lenta”.
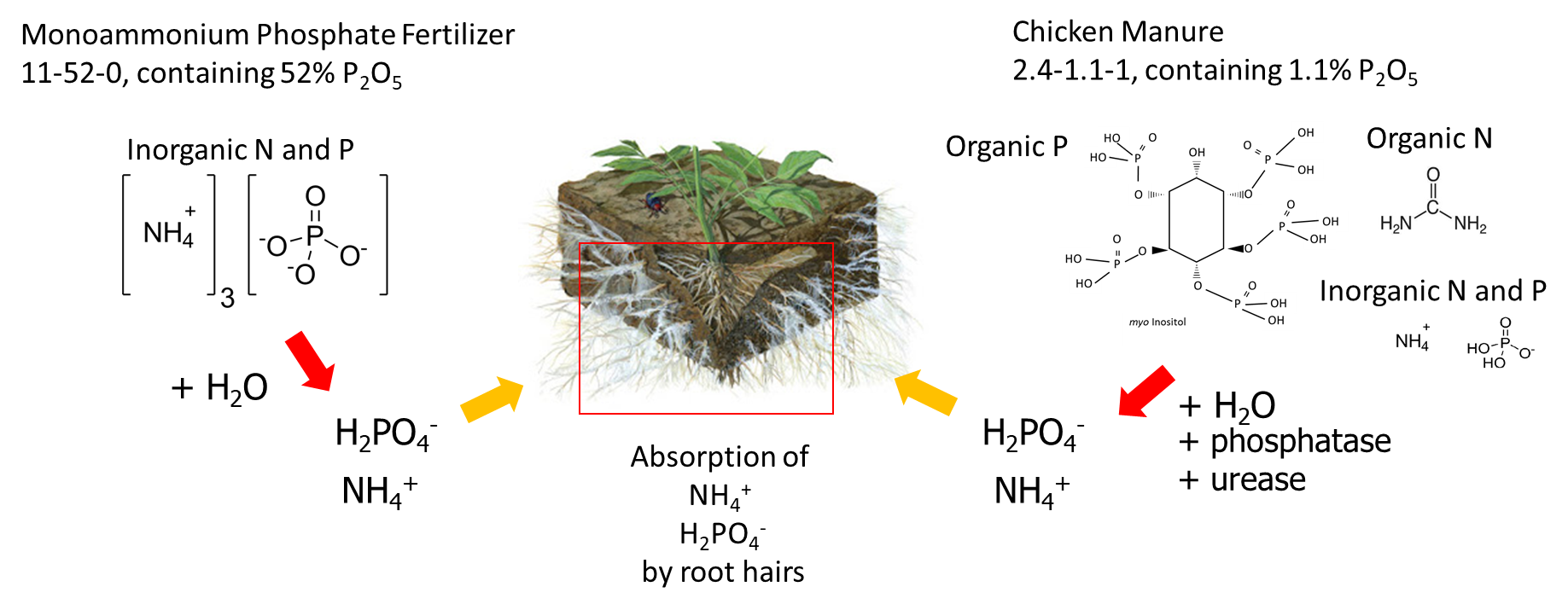
Una enmienda de suelo es un material que se agrega para mejorar la condición del suelo, pero no necesariamente proporciona nutrientes para el crecimiento de las plantas. La cal molida a menudo se aplica a suelos ácidos para aumentar el pH del suelo y reducir la concentración de Al 3+ y Mn 2+ en el agua de poro del suelo, ya que estos elementos pueden ser perjudiciales para las raíces de los cultivos. Neutralizar el pH del suelo a alrededor de 6.0—7.0 proporciona más solubles en agua NH 4 +, H 2 PO 4 — y K +, y aumenta la actividad de las bacterias del suelo, que son beneficiosas para el crecimiento de las plantas y mantienen la estructura del suelo. Otras modificaciones del suelo incluyen mantillo y biocarbón. No se espera que estos materiales ricos en carbono sean una fuente sustancial de nutrientes disponibles para las plantas, pero contienen materia orgánica que puede retener la humedad del suelo e iones intercambiables, construir la estructura del suelo y proporcionar sustrato para diversos microorganismos heterotrópicos. Dado que las enmiendas ricas en carbono estimulan el crecimiento microbiano, deben usarse con moderación para evitar la posibilidad de que microorganismos de rápido crecimiento inmovilizen los iones nutritivos del agua de los poros del suelo, privando así a las plantas de nutrientes disponibles para las plantas.
CICLOS NUTRITIVOS DEL SUELO
Los cultivos agrícolas absorben iones nutritivos del agua de poro del suelo para producir biomasa comestible (por ejemplo, grano, oleaginosa, forraje, frutos y tubérculos) y biomasa no comestible, parte de la cual se cosecha para camas de animales y para otros fines (es decir, los biocombustibles de segunda generación están hechos de tallos y hojas no comestibles). La adición de fertilizantes repondrá los nutrientes disponibles en las plantas, pero los iones nutritivos del fertilizante no necesariamente permanecerán en el agua de los poros del suelo debido a que están sujetos a las reacciones biológicas, químicas y físicas de los ciclos de nutrientes del suelo, que se describen a continuación.
Ciclismo de Nitrógeno
Reacciones que aportan nitrógeno disponible en las plantas
El ciclo del nitrógeno del suelo (Figura 7.8) está bien estudiado, debido a la importancia central del nitrógeno para la producción de clorofila, las reacciones del ciclo de Calvin que tienen lugar en cloroplastos durante la fotosíntesis y la síntesis de proteínas en las plantas. Una forma en que los cultivos agrícolas pueden obtener nitrógeno es a través de relaciones simbióticas o asociativas con procariotas fijadores de N 2. Las más conocidas son las bacterias del suelo en los géneros Rhizobium, pero hay muchas otras (Cuadro 7.5). Los procariotas fijadores de N 2 poseen la enzima nitrogenasa, que puede transformar el N 2 atmosférico en amoníaco (NH 3), el precursor de la síntesis de proteínas, a través de la reacción:
El complejo nitrogenasa reduce N 2 a NH 3, y también reduce H + a H 2. La energía (ATP) para esta reacción proviene de la descomposición, vía glucólisis, de los fotosintatos que se transfieren de la planta huésped al simbionte. El producto NH 3 (g) se difunde fuera del protoplasma de la bacteria hacia la corteza radicular, donde se protonó con 2 iones H +, sin energía adicional, para producir:
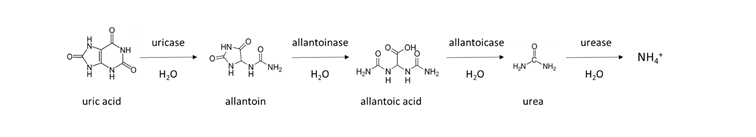
El NH 4 + luego se une al glutamato para producir glutamina, o se transforma en ureidos como la alantoína, el ácido alantoico o la citrulina, antes de que se transloque de la raíz a otras partes de la planta.
Las leguminosas de la familia Fabaceae forman una simbiosis con bacterias fijadoras N 2, las cuales habitan nódulos en sus raíces. La simbiosis se inicia cuando las raíces secretan flavonoides, que son quimio-atrayentes para que las bacterias nodulantes (rizobios) se unan a los pelos radiculares. La señal flavonoide activa los genes de nodulación (nod) en los rizobios, los cuales sintetizan factores Nod que se unen a receptores de proteínas superficiales en la punta de la raíz subapical. Esto hace que el pelo de la raíz se rice y atrape a los rizobios, y la membrana plasmática invagina para formar el hilo de infección, una estructura tubular que se extiende desde la punta del cabello de la raíz hasta las células inferiores de la corteza radicular. Los rizobios se mueven a través del hilo de infección y se multiplican, y las células de la corteza radicular proliferan en los primordios del nódulo, que eventualmente se convertirán en un nódulo completamente formado envuelto en una membrana que impide la difusión de oxígeno. Esta membrana protectora evita que la nitrogenasa sea inactivada por el oxígeno. En esta etapa, las bacterias rizobiales se convierten en bacteroides capaces de fijación biológica de N 2.
Aunque el N 2 es abundante (78% de la atmósfera terrestre), la reacción de fijación biológica del N 2 es energéticamente exigente. En teoría, se requieren 16 ATP para reducir una molécula de N 2 a NH 3 (g), pero el requerimiento energético real es generalmente mayor debido a ineficiencias en el proceso. Por lo tanto, la fijación biológica de N 2 es un proceso estrictamente controlado. Todas las demás formas disponibles de nitrógeno, como NH 4 +, NO 3 — y aminoácidos, inactivarán el complejo de nitrogenasa e inhibirán la expresión de los genes nif que codifican para los componentes de la nitrogenasa. Además, los productos de reacción NH 3 (g) y H 2 también inhiben la actividad nitrogenasa. En consecuencia, la mayoría de las leguminosas adquieren 40-75% de su requerimiento de nitrógeno a partir de la fijación biológica de N 2, y el resto se absorbe como NH 4 + y NO 3 solubles en agua, del agua de poro del suelo.
Las bacterias asociativas fijadoras de N 2 viven en la rizosfera (en los poros del suelo y en las partículas del suelo cercanas a las raíces de las plantas) o como endófitos (dentro de los tejidos vegetales) de pastos como caña de azúcar, arroz, trigo, sorgo, maíz y otros. Algunos géneros comunes son Azospirillum y Herbaspirillum, y hay muchos otros (Cuadro 7.5). Estas bacterias no forman nódulos. En cambio, viven en la superficie de la raíz o dentro del espacio intercelular y vasos de xilema de tallos y hojas. Obtienen energía de los fotosintatos de la planta y transfieren una porción del NH 4 + generado a partir de la fijación de N 2 a la planta. Existe una variabilidad considerable en su contribución a los requerimientos de nitrógeno de los cultivos. En la caña de azúcar, Gluconacetobacter diazotrophicus puede suministrar 0-60% del requerimiento de nitrógeno en condiciones de campo. Los cereales y oleaginosas pueden obtener 1-25 kg N ha -1 y -1 de sus bacterias asociativas fijadoras N 2. El resto del nitrógeno que necesitan estos cultivos debe ser absorbido del agua de poro del suelo como iones NH 4 + y NO 3 —.
Cuadro 7.5. Procatyotos fijadores de nitrógeno que pueden suministrar nitrógeno a las plantas. Adaptado de Rascio y La Rocca (2013)
| Clase | Procariota fijador N 2 | Planta hospedadora |
|---|---|---|
| Simbiótico | Allorhizobium spp. (crecimiento rápido) Azorhizobium spp. (crecimiento rápido) Bradyrhizobium spp. (crecimiento lento) Mesorhizobium spp. (crecimiento intermedio) Rhizobium spp. (crecimiento rápido) Sinorhizobium spp. (crecimiento rápido) |
Legumbres (familia Fabaceae) |
| Anabaena azollas (cianobacterias) | Helecho acuático (Azolla) | |
| Frankia spp. (actinobacterias) | Arbustos leñosos, por ejemplo, en las familias Betulaceae, Casuarinaceae y Myricaceae | |
| Asociativo | Azospirillum spp. Bacillus spp. Beijerinckia fluminense Derxia spp. Enterobacter spp. Erwinia spp. Gluconacetobacter diazotrophicus Herbaspirillum spp. |
Cereales (familia Poaceae) Semillas oleaginosas (familia Brassicaceae) |
¡Puedes Cavar!
La importancia de medir el suministro de N en el suelo: Un ejemplo de la Isla del Príncipe
El nitrógeno es un nutriente muy dinámico, tanto crítico para la producción de cultivos como con potencial de impacto ambiental significativo. Por lo tanto, es esencial que utilicemos el nitrógeno de la manera más efectiva y eficiente posible. Al determinar la necesidad de adiciones de nitrógeno, no podemos olvidar dar cuenta del nitrógeno que será suministrado por el suelo. En los agroecosistemas semiáridos y subhúmedos, como los de las praderas canadienses, el nitrato-nitrógeno residual (NO 3-N) es una fuente importante de N de la planta para el cultivo posterior y debe medirse en pruebas de fertilidad del suelo y contabilizarse en recomendaciones de fertilizantes. En agroecosistemas frescos y húmedos como los del este de Canadá, la pérdida de nitrógeno durante el invierno es tal que a menudo hay un arrastre limitado de nitrato (Zebarth et al., 2003). Como resultado, la mineralización de nitrógeno en temporada es un importante insumo de cultivo en ambos tipos de agroecosistemas.
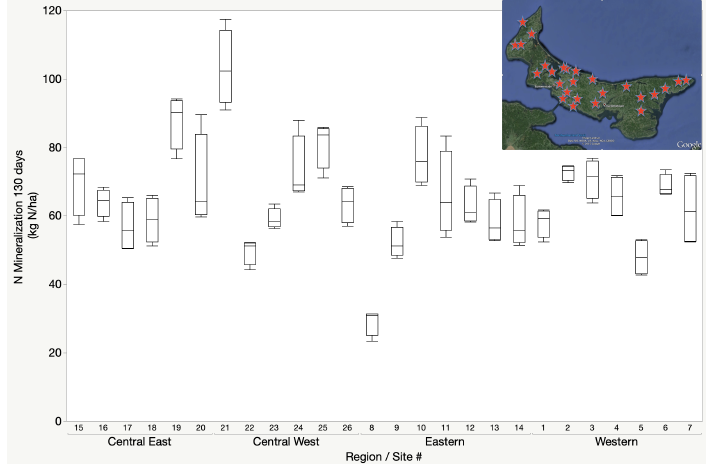
Existen diversos enfoques para estimar el potencial de mineralización de nitrógeno que van desde medidas de la calidad de la materia orgánica hasta la actividad de la comunidad microbiana (Dessureault -Rompré et al., 2011). La variación en el potencial de mineralización de nitrógeno puede variar sustancialmente como resultado de la humedad del suelo, la temperatura, el tipo de suelo, el sistema de cultivo o el manejo del suelo. Un estudio del potencial de mineralización de nitrógeno de campos en rotaciones de papa de tres años en la Isla del Príncipe Eduardo demostró que la mineralización potencial de N durante un período de crecimiento de 130 días podría variar de 30 a 110 kg N ha -1. Si bien hubo en promedio mayor potencial de mineralización de N asociado a regiones centrales de la provincia, la mayor variación fue de campo a campo, enfatizando el valor de las pruebas de suelo específicas del sitio para cuantificar el potencial de mineralización de N.
La mineralización biológica de proteínas, también conocida como mineralización de nitrógeno, es la principal fuente de NH 4 + en suelos no fertilizados. Este proceso natural libera NH 4 + soluble en agua de residuos vegetales, animales y microbianos en descomposición, que recientemente se agregaron al suelo o forman parte de la materia orgánica del suelo. Las bacterias y hongos del suelo producen enzimas proteasa y peptidasa, así como enzimas hidrolasa de aminoácidos que escinden los grupos amina de los aminoácidos y la ureasa, lo que degrada la molécula de urea. La reacción de mineralización general es:
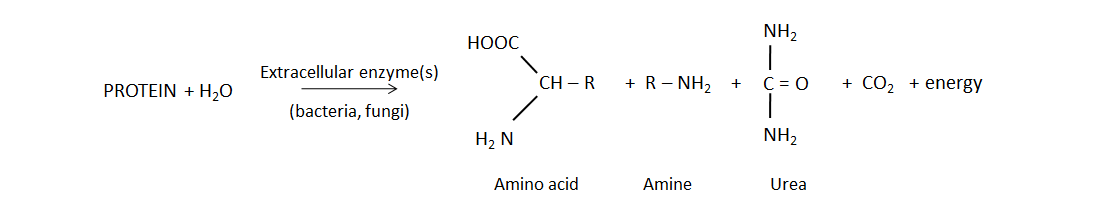 La mineralización de nitrógeno ocurre más rápidamente al aumentar la temperatura del suelo y es óptima cuando la humedad del suelo alcanza el 60% del espacio de poro lleno de agua Las condiciones del suelo que favorecen la actividad bacteriana (pH de 6 a 7.5, baja salinidad) estimularán la mineralización, ya que las bacterias tienen un tiempo de generación más rápido y mayor capacidad de producir enzimas degradantes de proteínas que los hongos.
La mineralización de nitrógeno ocurre más rápidamente al aumentar la temperatura del suelo y es óptima cuando la humedad del suelo alcanza el 60% del espacio de poro lleno de agua Las condiciones del suelo que favorecen la actividad bacteriana (pH de 6 a 7.5, baja salinidad) estimularán la mineralización, ya que las bacterias tienen un tiempo de generación más rápido y mayor capacidad de producir enzimas degradantes de proteínas que los hongos.
La mineralización de nitrógeno también se ve afectada por la relación C:N en los residuos orgánicos. La relación C:N es la masa del carbono orgánico total dividida por la masa de nitrógeno total en una sustancia orgánica. Los residuos orgánicos con una mayor proporción de carbono orgánico proporcionan sustratos para microorganismos heterótrofos, que utilizan carbono para procesos metabólicos y producción de biomasa, y respira CO 2. Si su crecimiento se ve limitado por la falta de nitrógeno en el residuo orgánico, los microorganismos heterótrofos inmovilizarán NH 4 + y NO 3 —del agua de poro del suelo. Los residuos orgánicos con una relación C:N > 20 como astillas de madera, paja y residuos a base de hierba tienden a ser ricos en carbono orgánico y relativamente empobrecidos en nitrógeno total, lo que provoca la inmovilización. Los residuos orgánicos con una relación C:N < 20, como el compost a base de alimentos y el estiércol animal descompuesto, están relativamente enriquecidos en nitrógeno total, por lo que mineralizarán e incrementarán la concentración de NH 4 + en el agua de los poros del suelo.
Muchos fertilizantes son fuente de NH 4 + en el suelo. El fertilizante granular como el sulfato amónico, (NH 4) 2 SO 4, es soluble en agua y se disuelve para liberar NH 4 + (Cuadro 7.4). El fertilizante de urea es hidrolizado por la enzima ureasa, que es producida por microorganismos y plantas naturales del suelo, para liberar NH 4 +:
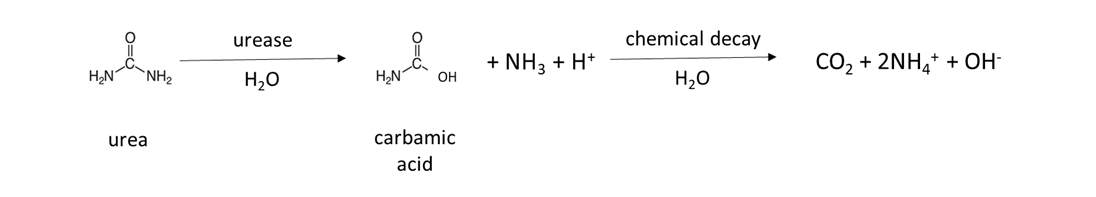
Una reacción similar ocurre en el estiércol animal, que contiene urea de la orina animal. El estiércol de pollo recolectado en instalaciones de colocación sin ropa de cama se enriquece con moléculas similares a la urea, debido a que 80% del nitrógeno excretado está en forma de ácido úrico. Se necesitan varios días a una semana para transformar el ácido úrico a NH 4 + en un suelo cálido y húmedo de acuerdo con la reacción general:
El estiércol de cerdo que se recolecta lavando por aspersión los graneros y almacenado en forma líquida también tiene una alta proporción de NH 4 +, debido a la hidrólisis de urea y degradación de proteínas que se produce en el almacenamiento del estiércol. Por ejemplo, la suspensión líquida de cerdo contiene > 90% de agua, tiene una relación C:N de 3, y la forma NH 4 + representa 75% del contenido total de N. La alta proporción de ácido úrico fácilmente degradable en el estiércol de pollo, y la gran cantidad de NH 4 + soluble en agua en la suspensión líquida de cerdo, hace que estos abonos sean fertilizantes nitrogenados de “liberación rápida”, en comparación con el estiércol animal mezclado con lecho, el cual tiene un menor contenido de agua.
Los oxidantes y nitrificadores de amoníaco son los encargados de transformar el NH 4 + a NO 3 —. Los oxidantes de amoníaco son un grupo diverso de procariotas, incluyendo bacterias y arqueas, que poseen los genes amo y hao que codifican para las enzimas que catalizan la siguiente reacción de 2 etapas:
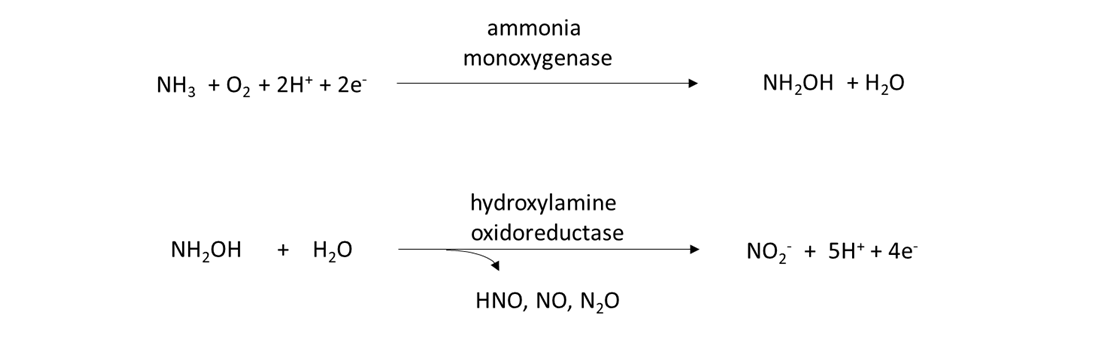
Los nitrificadores son procariotas y eucariotas que poseen el gen nxr y son capaces de convertir el nitrito (NO 2 —) en NO 3 —, como:
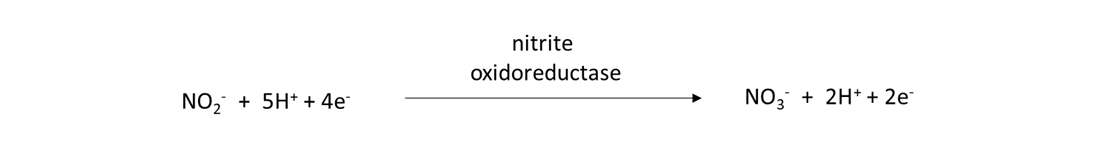
Las reacciones de oxidación y nitrificación del amoníaco ocurren rápidamente en suelos de campo durante la temporada de crecimiento. En consecuencia, el NH 4 + liberado de la mineralización de nitrógeno o agregado en fertilizante soluble en agua o estiércol animal se transformará en NO 3, dentro de días a semanas. Esta comprensión se vuelve importante a la hora de decidir cuándo aplicar el fertilizante, porque nos gustaría que los cultivos absorbieran la mayor parte del NH 4 soluble en agua —y NO 3 — del fertilizante lo más rápido posible después de la aplicación del fertilizante. De lo contrario, las reacciones en el ciclo del nitrógeno eliminarán estos iones nutritivos del agua de poro del suelo, reduciendo así la cantidad de nitrógeno disponible en las plantas para los cultivos y aumentando el riesgo de contaminación ambiental.
¡Puedes Cavar!
Nitrógeno mineral del suelo según lo previsto por membranas de intercambio iónico
Se desarrollaron membranas de intercambio iónico (IEM) y simuladores de raíces de plantas para determinar la disponibilidad de N para estudios agrícolas y ambientales. De hecho, los IEM contienen grupos funcionales superficiales cargados positiva o negativamente que adsorben iones, como NH 4 + y NO 3 —, por atracción electrostática. Para mantener el equilibrio entre la fase sólida del suelo y el agua de los poros del suelo, los IEM eliminan continuamente NH 4 + y NO 3, que se mineraliza del N orgánico o se desorbe de las superficies organo-minerales.
Una forma de evaluar la concentración de NH 4 + y NO 3 — es enterrar los IEM en campo por un periodo de tiempo que depende de los objetivos. Alternativamente, la concentración de NH 4 + y NO 3 — se puede evaluar en un ambiente de laboratorio estandarizado. Una vez retirados del suelo, se recolectan los IEM, se lavan con agua destilada en el campo para eliminar las partículas de tierra adheridas y se colocan en tubos individuales que contienen NaCl (membranas de intercambio aniónico) o HCl (membranas de intercambio catiónico), y se analizan en laboratorio para detectar NO 3, y NH 4 +, respectivamente. Los flujos de nitrato de suelo y amonio (tasas de suministro) medidos por IEM se reportan en µg cm -2 d -1 (Ziadi et al., 1999).
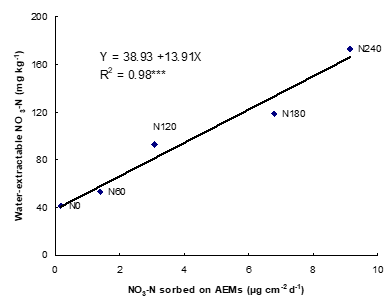
En general, existen correlaciones significativas entre los IEM y las extracciones químicas (Ziadi et al., 1999), y entre la captación de N de cultivos y los nitratos adsorbidos en los IEM. La absorción de N en las plantas estuvo más estrechamente relacionada con el N del suelo evaluada por IEM que la estimada por extracciones químicas, lo que sugiere que los IEM proporcionan un mejor índice de disponibilidad de N en el suelo que las extracciones químicas. En todos los sitios y tratamientos (N mineral y orgánico), el NO 3 — y NH 4 + adsorbidos en los IEM aumentaron con el aumento de las tasas de fertilizantes de N. SoilNo 3 — y NH 4 + adsorbidos en IEM variaron en gran medida con las estaciones de crecimiento y la etapa de desarrollo del cultivo, lo que indica la variación de la disponibilidad de N del suelo para las plantas El uso in situ de membranas de intercambio iónico como procedimiento de prueba de suelo proporciona una evaluación más precisa de la disponibilidad de N para diferentes cultivos (forrajes, maíz y papa) que los métodos estándar. Con base en su simplicidad, rapidez y bajo costo, los IEM tienen muchas ventajas prácticas sobre las extracciones químicas para evaluar la disponibilidad de N del suelo en el este de Canadá.
Procesos que agotan el nitrógeno disponible en la planta
Los iones NH 4 + y NO 3 — en el agua de poro del suelo se eliminan a través de procesos biológicos, químicos y físicos. La absorción de nitrógeno por las plantas y la inmovilización por microorganismos es impulsada por los requerimientos de nitrógeno para la síntesis de proteínas y la formación de material genético. En las plantas, el nitrógeno es un componente principal de las proteínas del ciclo Calvino (por ejemplo, alrededor del 20-30% del nitrógeno foliar se encuentra en la enzima RubisCO que inicia la producción de carbohidratos), los tilacoides y la molécula de clorofila y por lo tanto esencial para la fijación de CO 2 asociada a la fotosíntesis.
Las reacciones biológicas del suelo que utilizan NO 2 —y NO 3 — como aceptores de electrones son comunes. Estas reacciones permiten que las bacterias y hongos del suelo adquieran oxígeno cuando el ambiente del suelo es anóxico. El alto contenido de humedad del suelo puede crear condiciones anóxicas, al igual que una intensa actividad biológica que consume oxígeno y produce dióxido de carbono, como en la rizosfera o en la detrífera (es decir, alrededor de la materia orgánica en descomposición). La desnitrificación con nitrificación es una de esas reacciones, y se espera cuando el contenido de humedad del suelo es de 50 a 80% del espacio de poro lleno de agua.
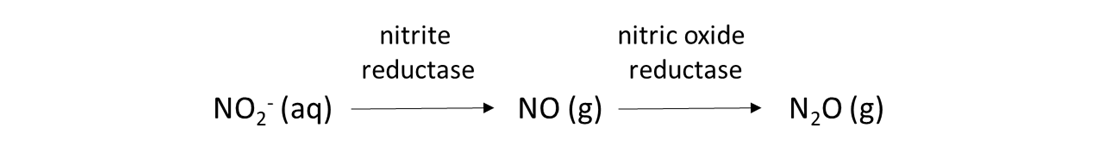
La desnitrificación es otra reacción de reducción biológica que consume NO 3 —, y se espera cuando el contenido de humedad del suelo supere el 80% del espacio de poro lleno de agua.
Una reacción química que agota la concentración de NH 4 + es la volatilización NH 3 (g), la cual ocurre cuando el NH 4 + es desprotonado. Durante la hidrólisis de urea, esto puede ser el resultado de la formación de ácido carbónico:
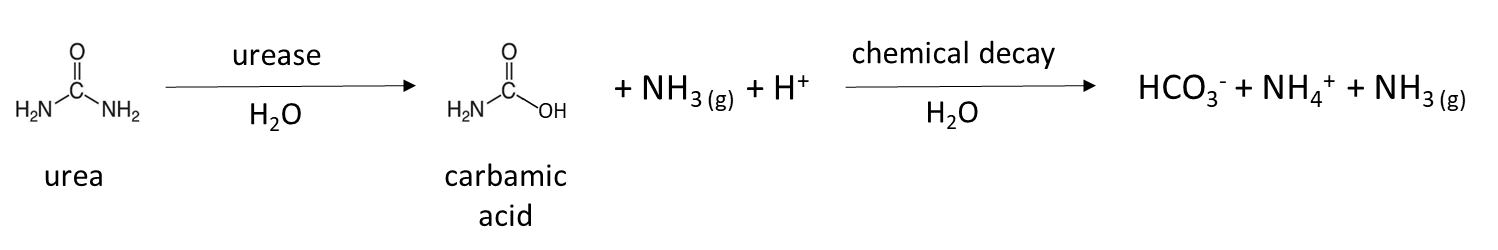
El estiércol animal puede perder hasta 50% del nitrógeno total excretado por el animal como NH 3 (g) durante el almacenamiento de estiércol y la aplicación en tierra. El fertilizante de urea también es susceptible a la pérdida de NH 3 (g), especialmente en suelos alcalinos que tienen un exceso de OH —y HCO 3 — en el agua de poro del suelo, ya que H + se asocia con estos contraaniones más que con NH 3. La volatilización de NH 3 (g) es indeseable porque la transferencia de nitrógeno gaseoso de los campos agrícolas a la atmósfera reduce el nitrógeno disponible en las plantas para el cultivo. Finalmente, el NH 3 (g) regresará al suelo mediante deposición húmeda y seca, lo que resulta en la fertilización no intencional de sistemas terrestres y acuáticos no agrícolas.
La fijación de amonio es una reacción química que elimina NH 4 + del agua de poro del suelo. Esto ocurre cuando NH 4 + se adsorbe a sitios de intercambio en superficies organo-minerales. La fijación de amonio es mayor en suelos arcillosos, que tienen mayor área de superficie reactiva y más sitios de adsorción en las interredes (2:1 solo arcillas), que los suelos arenosos. Debido a su carga 1+ y pequeño radio iónico, NH 4 + es probable que se una a la interred, lo que reduce la cantidad de NH 4 + en el agua de poro del suelo. Esto podría representar una reserva de hasta 90—460 mg NH 4 + kg -1 de suelo en arcillas de textura fina. En contraste, la molécula de NO 3 — se retiene flojamente en la matriz del suelo debido a su tamaño y carga negativa, y es más probable que se lixivie a través del perfil del suelo y por debajo de la zona radicular de la planta. La lixiviación de nitratos se ve afectada por la porosidad del suelo y la tasa de infiltración de agua después de los eventos de deshielo, Finalmente, tanto NH 4 + como NO 3 — son susceptibles a la pérdida del suelo a través de procesos de erosión y escorrentía superficial. El viento y el agua erosionan las partículas del suelo que contienen NH 4 + adsorbido, mientras que el agua de escorrentía transporta NO 3, desde suelos saturados a través del flujo terrestre.
¡Puedes Cavar!
Optimizar la tasa de aplicación de nitrógeno del estiércol animal

Equilibrar la tasa de adición de nitrógeno con la remoción en el cultivo cosechado a lo largo del tiempo evita la acumulación excesiva de nitrato en el suelo. El nitrato no utilizado puede migrar lentamente por debajo de la zona de enraizamiento con el tiempo con agua de percolación profunda. En un ensayo en el centro-este de Saskatchewan, se añadió estiércol porcino líquido cada año durante ocho años a una tasa agronómica recomendada de 37,000 L ha -1 año -1, agregando aproximadamente 80 kg N ha -1 año -1 que fue aproximadamente igual a la cantidad de N eliminado en la cosecha de grano cada uno año. Esta tasa resultó en poca o ninguna acumulación de nitrato en el perfil del suelo, ni hubo evidencia de ninguna lixiviación profunda en comparación con un testigo no fertilizado (inferior derecha).
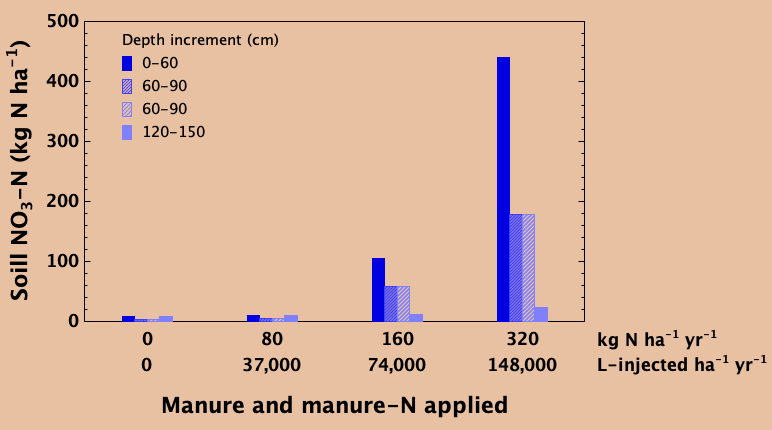
En el testigo no fertilizado, la producción de cultivos a lo largo de los años se redujo considerablemente debido a la falta de nitrógeno disponible, mientras que la tasa agronómica produjo buenos rendimientos. A tasas de aplicación anuales que fueron dobles (74,000 L ha -1 año -1) y especialmente cuádruples (148,000 L ha -1 año -1) la tasa recomendada, los contenidos de nitrato en el suelo en los 60 cm superiores así como las profundidades inferiores fueron elevados en comparación con la tasa agronómica y la control no fertilizado. Grandes cantidades de nitrato no utilizado que se acumulan en el perfil del suelo a lo largo del tiempo pueden migrar lentamente a mayores profundidades. Si se lixivia lo suficientemente profundo, puede volverse inalcanzable por las raíces de las plantas y ser una fuente potencial de contaminación del agua subterránea. Con una tasa de aplicación adecuada que coincida con la necesidad y remoción del cultivo, esto se puede prevenir.
Ciclismo de fósforo
Reacciones que aportan fósforo disponible en las plantas
El fósforo disponible en plantas se deriva de procesos biológicos y geoquímicos (Figura 7.9). La fuente biológica es el fósforo orgánico, el cual es hidrolizado por enzimas fosfatasas de raíces de plantas y microorganismos del suelo. Los compuestos orgánicos de fósforo son abundantes en residuos vegetales y en materiales vegetales no digeridos. Los inositoles son los principales compuestos de almacenamiento de fosfato que contribuyen a la biosíntesis de la pared celular, la comunicación célula a célula, el almacenamiento y transporte de hormonas vegetales y otras moléculas relacionadas con el estrés, y la osmorregulación. La degradación del mioinositol libera H 2 PO 4 soluble en agua —, de la siguiente manera:
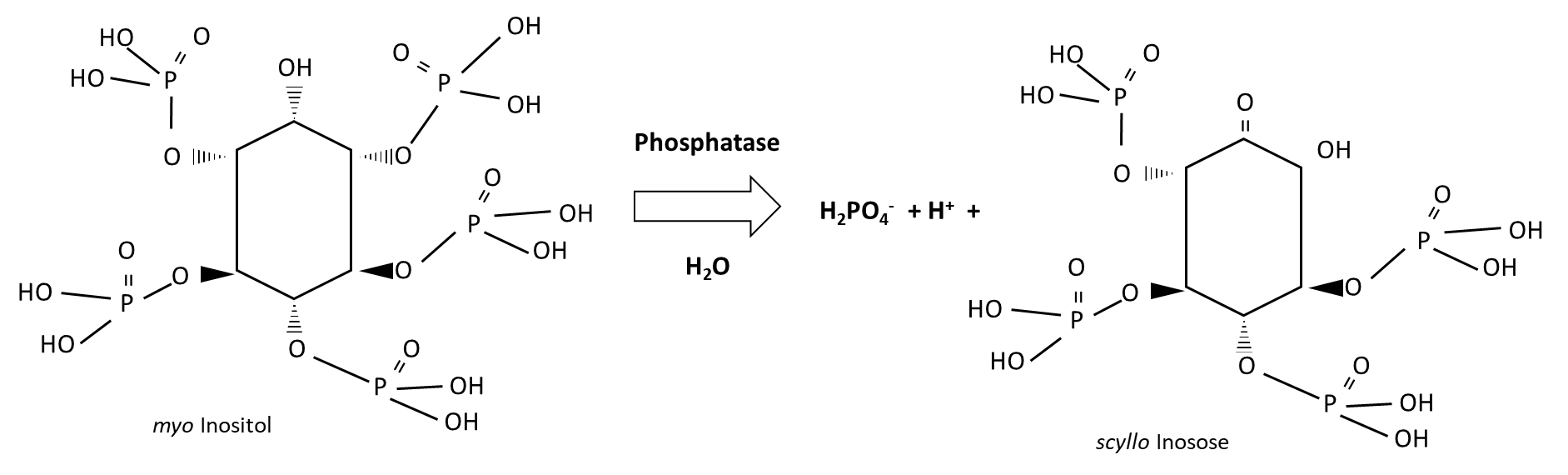
Los minerales primarios como la apatita experimentan meteorización para liberar H 2 PO 4 — en el agua de los poros del suelo. Otras fuentes geoquímicas incluyen H 2 PO 4 —que se desorbe de las superficies arcillosas o se disuelve de minerales secundarios, los fosfatos de hierro, aluminio, calcio y magnesio. Los procesos de meteorización y disolución requieren agua. La disolución de fosfatos de calcio y fosfatos de magnesio se acelera por la presencia de ácido carbónico (H 2 CO 3 ↔ HCO 3 — + H +) y otras sustancias ácidas, sin embargo, los fosfatos de hierro y los fosfatos de aluminio se vuelven menos solubles en ácidos suelos. Los ácidos inorgánicos que contribuyen a la solubilización de H 2 PO 4 — a partir de fosfatos de calcio y fosfatos de magnesio incluyen H 2 SO 4 y HCl. Los ácidos orgánicos producidos por las raíces de las plantas y los microorganismos del suelo bajan el pH en su entorno, resultando en H 2 PO 4 localizado — solubilización; además, los ácidos orgánicos pueden desplazar H 2 PO 4 — que es adsorbido sobre arcilla y Superficies organo-minerales. Los ácidos orgánicos que son efectivos en este sentido incluyen los ácidos acético, láctico, malónico, málico, tartárico, oxálico, cítrico, ρ-hidrobenzoico y salicílico. Las bacterias del suelo que producen ácidos orgánicos, como las de los géneros Pseudomonas, Bacillus, Rhizobium y Burkholderia, pueden aislarse, cultivarse y reinocularse en el suelo para aumentar H 2 PO 4, liberada vía disolución, pero no han demostrado ser confiables en solubilizar H 2 PO 4 — en condiciones de campo. Los hongos micorrícicos arbusculares también producen ácidos orgánicos que aumentan el H 2 PO 4 soluble en agua, que luego absorben a través de sus hifas extra-radiales. Dado que los hongos micorrícicos arbusculares son simbiontes vegetales, algunos de los H 2 PO 4 — adquiridos por el hongo pueden ser transferidos al huésped vegetal a través de transportadores de fósforo de baja y alta afinidad.
Impacto a largo plazo de las prácticas de labranza y la fertilización con fósforo en las formas de fósforo del suelo determinadas por espectroscopía de resonancia magnética nuclear 31 P
Las prácticas de labranza de conservación (labranza mínima o nula [NT]) se caracterizan por una mínima alteración y mezcla del suelo y se han utilizado con mayor frecuencia en los últimos años para reducir las pérdidas de nutrientes fuera del sitio asociadas con partículas erosionadas, incluido el fósforo (P). Sin embargo, al mantener los residuos de cultivos y fertilizantes en la superficie del suelo, los nutrientes relativamente inmóviles que no se mueven fácilmente hacia abajo del perfil del suelo permanecen en o cerca de la superficie del suelo. Por lo tanto, los sistemas de manejo de NT a menudo dan como resultado altas concentraciones de nutrientes en la superficie del suelo (0-5 cm) pero que disminuyen drásticamente las concentraciones por debajo de esta profundidad. El impacto de las prácticas de labranza y la fertilización P sobre las formas P del suelo, determinadas mediante espectroscopia de resonancia magnética nuclear (RMN) de 31 P, se investigó bajo un experimento de rotación de maíz-soja a largo plazo establecido en 1992 en Québec que comparó NT con convencional arado; MP) labranza. Los resultados mostraron que:
- el fósforo total varió con la profundidad del suelo bajo el tratamiento NT, acumulándose en la capa superior del suelo no fertilizado (0—5 cm) y en la capa de 0—10 cm donde se aplicó fertilizante P;
- El pH, el P disponible y el carbono total fueron significativamente mayores en la capa superior del suelo (0—5 cm) del tratamiento NT que en las capas más profundas (5—20 cm); el N total también se acumuló en la superficie 10 cm;
- a la inversa, las distribuciones de nutrientes fueron homogéneas en todo el perfil del suelo bajo manejo de MP, lo que sugiere que la estratificación en NT resulta de la retención de residuos de cultivos en la superficie del suelo;
- 31 Los espectros de RMN P mostraron estratificación concomitante de ortofosfato en parcelas NT que recibieron 35 kg P ha-1;
- la acumulación de escilo-iP6 y nucleótidos en las capas más profundas se debió posiblemente a su movimiento preferencial a través de la columna del suelo, mientras que las concentraciones de pirofosfato y ADN fueron mayores en la capa superficial (0—5 cm) del suelo que en las capas más profundas; y
- C y N totales se vieron afectados de manera similar, sugiriendo que el ADN se sintetizó en mayores cantidades bajo NT debido a la mayor cantidad de materia orgánica acumulada en la superficie del suelo en comparación con la labranza convencional.
En general, parece que la acumulación de P inorgánico lábil en la superficie del suelo NT puede aumentar el potencial de pérdida de P inorgánico soluble en la escorrentía superficial y conducir a la pérdida de monoésteres orgánicos que drenan a través de diferentes vías hidrológicas. Más información disponible en Abdi et al. (2014).
Reacciones que agotan el fósforo disponible en la planta
Los iones H 2 PO 4 — en el agua de poro del suelo se eliminan a través de procesos biológicos, químicos y físicos. La captación de fósforo por las plantas y la inmovilización en biomasa microbiana son necesarias para las reacciones de almacenamiento y transferencia de energía, así como la formación de ácidos nucleicos y fosfolípidos.
Las reacciones de retención de fósforo reducen la concentración de H 2 PO 4 — en el agua de poro del suelo porque H 2 PO 4 — se adsorbe a las superficies organo-minerales y a la superficie de sesquióxidos de hierro y aluminio, a saber, óxido de hierro (Fe 2 O3), hidróxido de hierro (Fe (OH) 3) e hidróxido de aluminio (Al (OH) 3). Estas reacciones son comunes en suelos ácidos, pero ocurren en todos los suelos hasta cierto punto. En general, los suelos con un mayor contenido de arcilla adsorberán más H 2 PO 4 —, particularmente cuando contienen arcillas de celosía en expansión 2:1 como la esmectita. Los sesquióxidos hidratados de hierro y aluminio se unen fuertemente al H 2 PO 4 y lo hacen indisponible para la absorción de la planta. Además, H 2 PO 4 — precipita con Fe, Al y Ca presentes en el agua de poro del suelo. Esto produce precipitados como Fe (OH) 2 H 2 PO 4 y el compuesto tipo variscita, Al (OH) 2 H 2 PO 4 en suelos ácidos. En suelos neutros a alcalinos, el H 2 PO 4 — precipita con Ca para formar fosfato dicálcico dihidratado ligeramente soluble, CaHPO 4. La reacción adicional con Ca (OH) 2 y CaCO 3 en suelos alcalinos conduce a la formación de hidroxilapatita insoluble (por ejemplo, [Ca 3 (PO 4) 2] 3 •CaOH 2) o apatita de calcio carbonatada insoluble (por ejemplo, carbonato-apatita; [Ca 3 (PO 4) 2] 3 •CaCO 3).
El concepto de saturación de fósforo es otra forma de describir la capacidad del suelo para retener químicamente H 2 PO 4 —. El suelo se agita con una solución de extracción como la solución de Mehlich 3, se mide la cantidad de P y Al extraíbles, y la relación se calcula como:
(1)
El suelo con alto grado de saturación de fósforo tiene H 2 PO 4 — elevado, relativo a la cantidad de Al extraíble que podría unirse con H 2 PO 4 —. Por lo tanto, el H 2 PO 4 más soluble en agua permanece en el agua de los poros del suelo y podría lixiviarse después de eventos de deshielo, lluvia y riego. Además, la erosión de las partículas del suelo que contienen H 2 PO 4 adsorbido — transportará partículas P, mientras que la escorrentía superficial transportará los compuestos de fósforo disueltos en la superficie del suelo a través del flujo terrestre. La magnitud de la pérdida de fósforo a través de estas vías depende de la concentración de H 2 PO 4 soluble en agua y P particulado en el suelo superficial, así como de la cantidad de lixiviación y severidad de los procesos de erosión superficial.
Ciclismo de azufre
Reacciones que aportan azufre disponible en las plantas
El azufre disponible en plantas puede originarse de la meteorización del material parental, la deposición atmosférica, la disolución del yeso (CaSO 4) y la mineralización de la materia orgánica (Figura 7.10). Las rocas plutónicas como la pirita contienen azufre elemental (So) que se oxida a SO 4 2- durante el proceso de meteorización. La mayoría de las reacciones de oxidación están mediadas por hongos y bacterias autótrofas, como el Thiobacillus, que es abundante en la rizosfera.
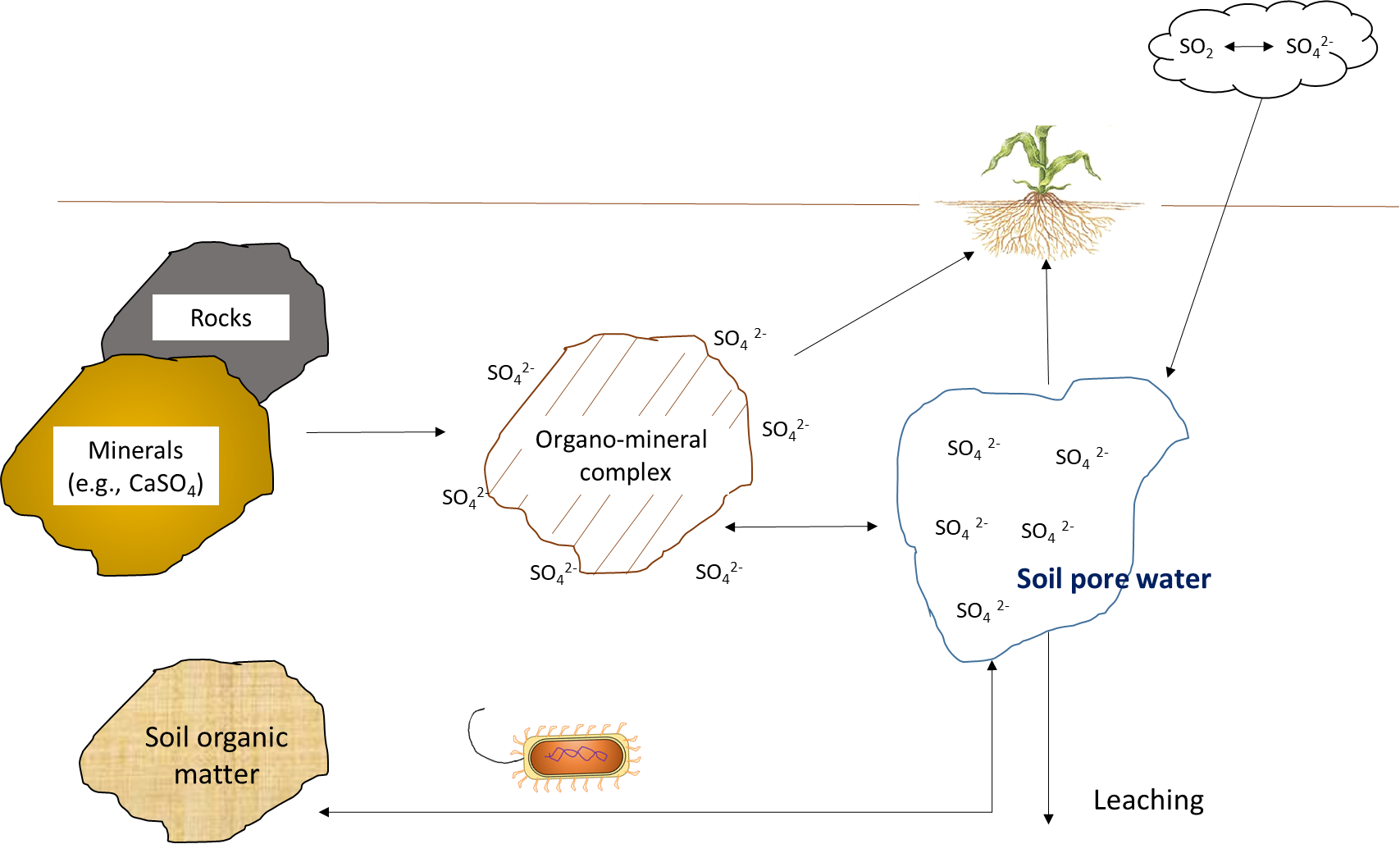
La conversión de So a SO 4 2- es extremadamente variable en los suelos, debido a la variación natural en la distribución de microorganismos oxidantes de azufre. En general, las reacciones de oxidación de azufre ocurren rápidamente en suelos más cálidos con contenido de humedad con alrededor de 60% de espacio de poros llenos de agua y pH del suelo de 6-7.5. Además, el SO 4 2- se libera de la disolución de sales hidratadas en el suelo, como CaSO 4 • 2H 2 O y MgSO 4 • 7 H 2 O.
El azufre ingresa al suelo desde fuentes atmosféricas a través de deposición seca y húmeda. Varios fenómenos naturales emiten azufre a la atmósfera, incluyendo compuestos de azufre particulados que provienen de la meteorización de las costras continentales (polvo) y la pulverización marina. Pequeñas partículas de azufre son transportadas por el viento y depositadas sobre la superficie del suelo o vegetación. Las emisiones gaseosas de dióxido de azufre, sulfuro de hidrógeno, sulfuro de dimetilo y otros gases procedentes de erupciones volcánicas, pantanos y humedales costeros son otra fuente. En la atmósfera, estos gases tienden a oxidarse a ácido sulfúrico y sulfato de aerosol, para luego regresar al suelo en lluvia y nieve. Estas fuentes biogénicas de azufre representan <10 kg S ha -1 y -1 en ecosistemas terrestres. Desde la Revolución Industrial, las fuentes antropogénicas de azufre hacen un aporte significativo al ciclo del azufre del suelo, y podrían superar >50 kg S ha -1 y -1 en tierras agrícolas y boscosas cercanas a actividades industriales. La combustión de combustibles fósiles, la quema de biomasa, la incineración de desechos y el uso de explosivos emiten dióxido de azufre y por lo tanto contribuyen a través de la deposición húmeda al contenido de azufre en el suelo. Sin embargo, una reducción en la contaminación del aire ha disminuido la cantidad de azufre liberado de estas fuentes.
El azufre orgánico es mineralizado por enzimas del suelo —sulfatasas— de origen vegetal y microbiano para liberar SO 4 2-, como se ilustra a continuación:
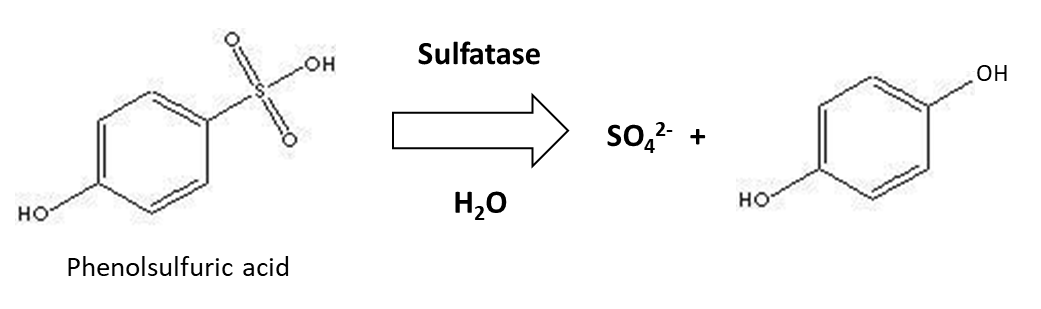
Al igual que otras reacciones de mineralización, la mineralización de azufre aumenta con temperaturas más altas del suelo y es óptima cuando el contenido de humedad del suelo es de alrededor de 60% de espacio de poro lleno de agua y el pH del suelo La mineralización de azufre es mayor alrededor de las raíces de las plantas, las cuales producen sulfatasa. Además, las plantas absorben parte del SO 4 2- en la solución del suelo, lo que podría limitar la cantidad de SO 4 2- disponible para los microorganismos y por lo tanto inducirlos a sintetizar sulfatasa. Cuando se agregan residuos frescos de plantas o animales al suelo, la relación carbono orgánico a azufre orgánico (C:S) del material determinará su susceptibilidad a la mineralización. Los residuos orgánicos con una relación C:S <200 se mineralizan fácilmente y liberan SO 4 2- en la solución del suelo. Sin embargo, los residuos orgánicos con una relación C:S >400 que tienen un bajo contenido de azufre podrían llevar a la inmovilización de SO 4 2- por microorganismos, para cumplir con sus requerimientos metabólicos.
Reacciones que agotan el azufre disponible en la planta
Los iones SO 4 2- en el agua de poro del suelo se eliminan a través de procesos biológicos, químicos y físicos. La captación biológica de SO 4 2- por plantas y microorganismos es necesaria para la síntesis de aminoácidos esenciales (metionina, cisteína, homocisteína y taurina), para la producción de glucosinolatos, vitaminas, como cofactor enzimático y para la producción de clorofila. En suelos anóxicos, los aceptores de electrones de azufre ganan electrones y disminuyen su estado de oxidación, por lo que SO 4 2- se reducirá a azufre elemental So y luego a S 2- por bacterias reductoras de azufre en el filo Firmicutes, incluyendo los géneros Desulfotomaculum, Desulfosporomusa y Desulfosporosinus.
Varias reacciones químicas reducen la concentración de SO 4 2- en el agua de poro del suelo. En suelos calcáreos, el SO 4 2- puede coprecipitarse con CaCo 3 para formar un complejo CaCo 3 • CaSO 4. Esto representa alrededor del 10% del azufre total en suelos calcáreos. Segundo, SO 4 2- se une a sitios de intercambio aniónico en superficies organo-minerales. Sin embargo, SO 4 2- no está tan estrechamente unido a sitios de intercambio aniónico como HPO 4 2- y H 2 PO 4 —. En consecuencia, el SO 4 2- es susceptible a la lixiviación y puede perderse a través de procesos de erosión y escorrentía.
Potasio, Calcio y Magnesio
Los elementos minerales —potasio, calcio y magnesio— circulan a través de procesos geoquímicos (Figura 7.11). Aunque las plantas y otros organismos requieren cantidades sustanciales de potasio, calcio y magnesio, estos elementos funcionan en sus formas iónicas dentro de los tejidos biológicos. Por ejemplo, el potasio existe predominantemente como K + en la solución vascular de los tejidos vegetales y en el citoplasma de las células vegetales. Se traslada junto con el agua en plantas vivas. Puede existir entre capas de compuestos orgánicos como polisacáridos, proteínas y lípidos, pero no se une covalentemente a esas sustancias. La lixiviación de K + y otros elementos minerales como Ca 2+ y Mg 2+ ocurre cuando la lluvia entra en contacto con residuos vegetales y animales, antes de que comience la descomposición biológica.
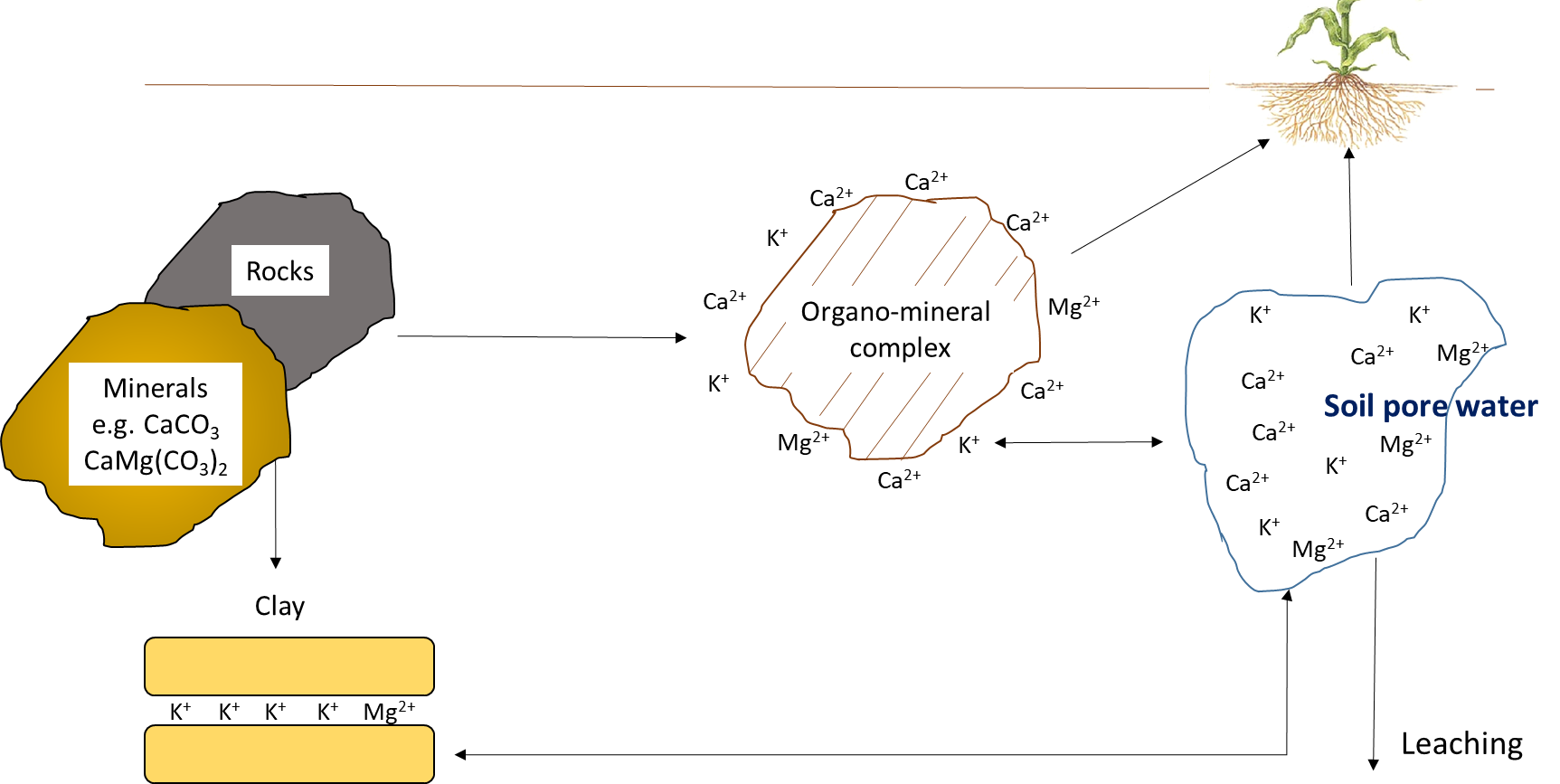
Reacciones que aportan potasio, calcio y magnesio disponibles en plantas
La cantidad de K +, Ca 2+ y Mg 2+ en el agua de los poros del suelo y en los sitios de intercambio catiónico depende de la naturaleza y la meteorización del material parental. Los residuos orgánicos aportan cantidades menores de K +, Ca 2+ y Mg 2+ solubles en agua, en comparación con el material parental. El potasio se origina a partir de minerales primarios, como feldespato, microclina, mica y biotita, y también se puede agregar como fertilizante.
Respuesta de la fertilidad del suelo a la nutrición intensiva

De 2002 a 2006, se monitoreó una rotación de maíz-soja en un campo de cultivo en el centro-sur de Ontario para evaluar los cambios en respuesta al manejo intensivo. El ensayo consistió en siete combinaciones de manejo; tres tasas variables de K a nivel de insumos del productor y cuatro a un nivel de entrada más intensivo, variando tanto la tasa K como la ubicación de la zona.
El suelo es un franco londinense con buen drenaje. Los niveles iniciales de fertilidad del suelo fueron 8 ppm Olsen P (bajo) y 107 ppm de amonio-acetato K extraíble (medio). Cinco tratamientos utilizaron la práctica de labranza de conservación del cultivador: arado cincel de otoño con labranza secundaria de primavera. Los otros dos tratamientos utilizaron labranza de zona de caída seguida de labranza de zona de primavera. Cada parcela de tratamiento consistió en una franja de ocho hileras de ancho que recorría toda la longitud (300 a 450 m) del campo (ver fotografía a la derecha).
Los rendimientos promediados a lo largo de los cinco años aumentaron modestamente en respuesta al aumento de las tasas de K y a la intensidad de manejo. Ninguna combinación de intensidad de entrada y tasa de K fue económicamente más viable que el nivel actual de manejo del productor. No hubo evidencia de un mayor requerimiento de K con mayor intensidad de entrada.
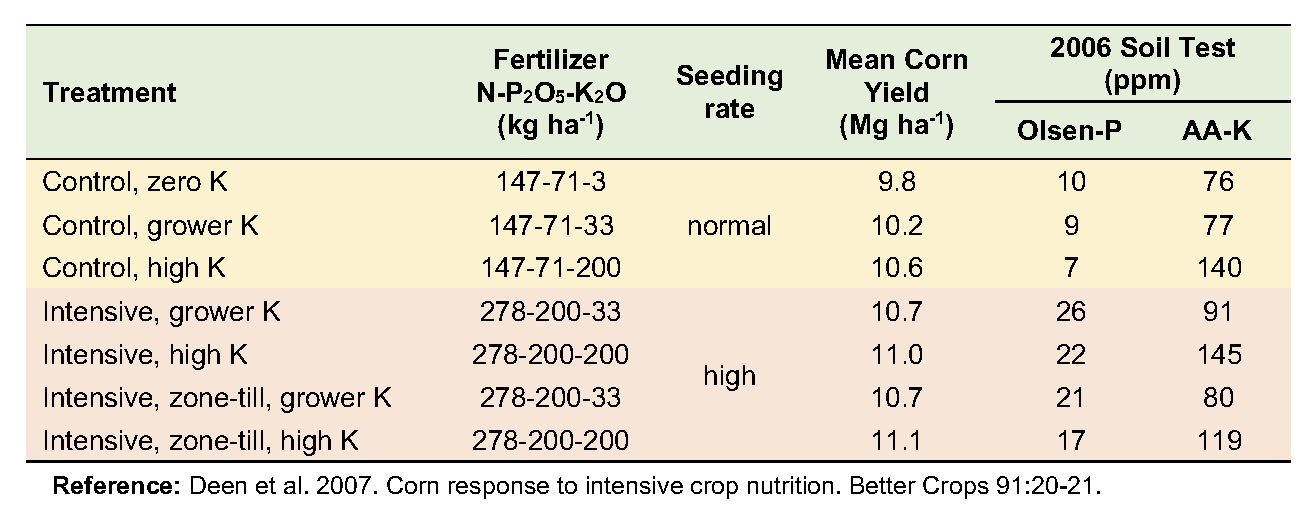 Los niveles de prueba de suelo cambiaron poco donde los insumos de P y K estaban a las tasas del productor, pero aumentaron significativamente donde se aplicaron tasas más altas. Las tasas de cultivo resultaron en excedentes netos de P y déficits netos de K, aunque los cambios no fueron lo suficientemente grandes como para influir en los niveles de prueba del suelo. Sin embargo, a la alta tasa de cada nutriente, los excedentes de P y K fueron lo suficientemente grandes como para aumentar sustancialmente los niveles de prueba del suelo para ambos nutrientes. Este trabajo demuestra que los rendimientos de los cultivos económicamente óptimos requieren insumos suficientes de nutrientes para mantener la fertilidad del suelo.
Los niveles de prueba de suelo cambiaron poco donde los insumos de P y K estaban a las tasas del productor, pero aumentaron significativamente donde se aplicaron tasas más altas. Las tasas de cultivo resultaron en excedentes netos de P y déficits netos de K, aunque los cambios no fueron lo suficientemente grandes como para influir en los niveles de prueba del suelo. Sin embargo, a la alta tasa de cada nutriente, los excedentes de P y K fueron lo suficientemente grandes como para aumentar sustancialmente los niveles de prueba del suelo para ambos nutrientes. Este trabajo demuestra que los rendimientos de los cultivos económicamente óptimos requieren insumos suficientes de nutrientes para mantener la fertilidad del suelo.
El calcio se libera de la meteorización de minerales primarios como la anortita (CaAl 2 Si 2 O 3), seguido de piroxenos y anfíboles, con menores cantidades de Ca provenientes de la meteorización de biotita y apatita. Cantidades sustanciales de Ca 2+ se liberan de la disolución de minerales secundarios como la piedra caliza (CaCo 3), la piedra caliza dolomítica (CaMg (CO 3) 2) y el yeso (CaSO 4 2H 2 O), todas las cuales son fuentes principales de Ca 2+ en Suelos canadienses.
El magnesio en los suelos se origina de rocas como biotita, dolomita, hornblende, oliveno y serpentina. El magnesio es a menudo un catión sustituido en minerales arcillosos, como clorito, illita, montomorillonita y vermiculita. La meteorización de rocas y arcillas libera Mg 2+ en el agua de los poros del suelo, al igual que la disolución de minerales secundarios de Mg como piedra caliza dolomítica (CaMg (CO 3) 2), epsomita (MgSO 4 7H 2 O) y bloedita (Na 2 Mg (SO 4) 3 4 H 2 O).
Existe un equilibrio químico entre la cantidad de K +, Ca 2+ y Mg 2+ en el agua de poro del suelo y la de los sitios de intercambio catiónico. Los iones más pequeños, particularmente H +, pueden reemplazar estos elementos minerales en los sitios de intercambio, lo que lleva a la desorción de K +, Ca 2+ y Mg 2+ en el agua de los poros del suelo. El equilibrio entre iones minerales intercambiables y solubles es el determinante clave de las concentraciones de K +, Ca 2+ y Mg 2+ disponibles en las plantas. Dado que el pH afecta la carga en superficies organo-minerales (es decir, los suelos neutros a alcalinos tienen más superficies cargadas negativamente que los suelos ácidos), la capacidad de intercambio está relacionada con el pH del suelo, el contenido de arcilla y materia orgánica.
Reacciones que agotan potasio, calcio y magnesio disponibles en las plantas
Los iones K +, Ca 2+ y Mg 2+ en el agua de los poros del suelo se eliminan a través de procesos biológicos, químicos y físicos. La captación biológica de K + es esencial para la activación enzimática (más de 80 enzimas requieren K + como cofactor), los procesos de transporte y la regulación osmótica. Las principales funciones del Ca 2+ en las plantas son el mantenimiento de las membranas celulares, así como la división y elongación celular. Un componente esencial en la clorofila, el Mg 2+ es también un componente estructural en los ribosomas y responsable de las reacciones de transferencia que involucran grupos reactivos con fosfato.
Las reacciones de adsorción son el proceso químico dominante que elimina K +, Ca 2+ y Mg 2+ del agua de poro del suelo. La adsorción puede ocurrir en las superficies externas (posición “o”), superficies internas (posición “i”) y borde (posiciones “e”) de minerales arcillosos. Además, estos iones pueden ser adsorbidos en la interred de arcillas 2:1 en mica, ilita y vermiculita. Debido a su carga 1+ y pequeño radio iónico, K + tiende a unirse en la interred mientras que Ca 2+ y Mg 2+ permanecen en las superficies externas de minerales arcillosos. Esto reduce la cantidad de K + en el agua de poro del suelo debido a la fijación de potasio, que puede representar hasta 20% del K total contenido en suelos con minerales arcillosos 2:1. Los iones K +, Ca 2+ y Mg 2+ en el agua de los poros del suelo se mueven fuera de la capa superior del suelo por lixiviación. Esto se asocia con la lixiviación de aniones, ya que los aniones que se mueven a través del agua del poro del suelo van acompañados de cationes para mantener la neutralidad eléctrica La erosión de partículas ricas en arcilla es otra forma en que los iones K +, Ca 2+ y Mg 2+ intercambiables se agotan de la capa superior del suelo.
Elementos de micronutrientes
La meteorización es la principal fuente de la mayoría de los micronutrientes, incluyendo hierro, cobre, manganeso, zinc, níquel, boro y molibdeno. El cloro disponible en las plantas puede disolverse a partir de sales como NaCl y KCl, o puede ingresar al suelo en lluvia y agua de riego. Los micronutrientes generalmente se concentran en la solución vascular y el citoplasma de las plantas, por lo que están presentes en los residuos orgánicos y se liberan durante la fragmentación física inicial de los residuos orgánicos en descomposición. En consecuencia, los residuos vegetales y animales son una fuente natural de micronutrientes esenciales. Cada micronutriente tiene funciones específicas en las plantas, enumeradas en el Cuadro 7.6.
Cuadro 7.6. Funciones de micronutrientes en plantas, según Jones (2003)
| Elemento | Funciones |
|---|---|
| Hierro | Las proteínas que contienen Fe, incluidas las proteínas hemo y las proteínas Fe-S, son importantes para la fotosíntesis, la producción de clorofila y la síntesis de ácido ribonucleico. Los citocromos son proteínas hemo que contienen Fe, y la ferredoxina es la proteína Fe-S más conocida. |
| Manganeso | Importante en los procesos redox, incluyendo el transporte de electrones en la fotosíntesis y la desintoxicación de radicales libres de oxígeno. Un cofactor enzimático para la biosíntesis de metabolitos secundarios como fenólicos, ligninas y flavonoides. |
| Cobre | Las enzimas que contienen Cu reaccionan con O 2 molecular y son importantes en la fotosíntesis, respiración, desintoxicación de radicales superóxido y reacciones de lignificación. |
| Zinc | Un activador enzimático que mejora la unión de enzimas y sustratos involucrados en el metabolismo de carbohidratos, síntesis de proteínas y desintoxicación de radicales superóxido (O 2 -) para proteger los lípidos de membrana y proteínas contra la oxidación. |
| Níquel | Requerido para el correcto funcionamiento de la enzima ureasa que cataliza la reacción CO (NH 2) 2 + H 2 O → 2 NH 3 + CO 2. Cualquier cultivo que produzca ureides requiere Ni. |
| Boro | Forma complejos estables con compuestos orgánicos que contribuyen a la formación y estabilización de la pared celular, lignificación y diferenciación de xilema. |
| Molibdato | Participa en reacciones de transferencia de electrones. Las enzimas que contienen MO catalizan la fijación biológica de N 2 y son responsables de la formación de polen en las plantas. |
| Cloruro | Anión móvil esencial para la osmorregulación (p. ej., elongación celular, apertura estomática) y compensación de carga (p. ej., equilibrio de cargas entre cationes y aniones en el citoplasma). Cofactor esencial para la fotosíntesis. |
La absorción vegetal de micronutrientes se mejora a temperaturas más altas y en plantas con prolíficos sistemas radiculares, ya que una mayor evapotranspiración moverá las formas solubles en agua de los micronutrientes a la superficie de la raíz, donde pueden ser absorbidos. La humedad del suelo tiene que ser suficiente para mantener los iones de micronutrientes en el agua de los poros del suelo, pero no tan alta como para crear condiciones anóxicas que afecten la absorción de iones por las raíces. Por ejemplo, las condiciones anóxicas previenen la absorción de Fe 2+ por las raíces, pero pueden aumentar la absorción de iones tóxicos Mn 2+. El pH del suelo suele ser crítico. La cantidad de hierro, cobre, manganeso, zinc y níquel disponibles en las plantas disminuye a medida que el pH aumenta al rango neutro y alcalino. Por ejemplo, la deficiencia de hierro puede ocurrir en plantas que crecen en suelos calcáreos con pH >7.5. Las plantas que se adapten a este ambiente responderán alterando la morfología de la raíz para aumentar el crecimiento del pelo radicular, liberar protones para acidificar la rizosfera y hacer Fe 3+ más soluble, reducir el Fe 3+ a Fe 2+ con un Fe 3+ asociado a la membrana plasmática quelato reductasa y transporta Fe 2+ a través de la membrana plasmática con un transportador regulado por hierro. Las plantas adaptadas de la familia Poaceae tienen una estrategia diferente, la cual implica la quelación de Fe 3+ por los fitosideróforos antes de que el complejo soluble Fe 3+ sea absorbido por la raíz.
Las plantas necesitan mucho menos de los micronutrientes que los macronutrientes (Cuadro 7.1). Las reservas de suelo suelen ser suficientes para satisfacer los requerimientos de las plantas, especialmente cuando se encuentran en suelos con pH 6—7 y cuando se plantan cultivares adaptados. Podemos mejorar la nutrición de los micronutrientes agregando fertilizante que contiene el (los) micronutriente (s) deficiente (s) al suelo o directamente al follaje de la planta. Con aplicación foliar, se rocía una pequeña cantidad de fertilizante micronutriente sobre el follaje en una solución con un adyuvante (para mejorar la adhesión de la solución fertilizante a la superficie foliar) durante el crecimiento vegetativo de la planta o las etapas tempranas de crecimiento reproductivo. Los micronutrientes solubles en agua como H 3 BO 3, Cu 2+, Mn 2+, MoO 4 — y Zn 2+ y los quelatos solubles se absorben a través de los poros en la hoja y se mueven a través del sistema vascular de la planta a los órganos y tejidos donde se encuentran requerido. La fertilización foliar es ventajosa porque entrega una pequeña cantidad de micronutrientes y evita las reacciones de adsorción y precipitación que ocurren en el suelo. Debido a la sensibilidad de las células fotosintéticas en las hojas, la tasa de aplicación y el momento de los micronutrientes al follaje deben seleccionarse con cuidado.
Elementos no esenciales
Los elementos no esenciales se agrupan en dos clases: (1) elementos que son beneficiosos para algunas, pero no para todas las plantas, y (2) elementos que no son necesarios para el crecimiento de las plantas. Entre los elementos que estimulan el crecimiento de algunas plantas se encuentran el silicio, el sodio y el selenio. El silicio es beneficioso para el arroz, la caña de azúcar y otras especies de pasto. Se acumula preferentemente en los tejidos del tallo y parece tener un papel en el mantenimiento de la integridad estructural del sistema vascular, que se requiere para transportar agua, nutrientes, carbohidratos y otras sustancias por toda la planta. Las mayores concentraciones de silicio se asocian con una mayor tolerancia a la sequía. La fertilización sódica puede mejorar el crecimiento de algunas plantas C4, apio, espinaca, remolacha azucarera y nabos. El selenio parece tener beneficios generales relacionados con la tolerancia al estrés oxidativo y mayor resistencia al daño tisular causado por patógenos y herbívoros.
Algunos elementos pueden absorberse en cantidades que son tóxicas para las plantas. En suelos ácidos con niveles de Al 3+ solubles en agua de 10 a 20 mg kg -1 o más, las plantas pueden experimentar toxicidad por aluminio. La disminución de las funciones radiculares de las plantas se relaciona con el daño oxidativo de las membranas celulares, y menor división celular y elongación en las puntas de crecimiento debido al reemplazo de Al 3+ de Ca 2+. En plantas sensibles, la presencia de Al 3+ en los tejidos foliares puede reducir la conductancia estomática y el contenido de clorofila, lo que reduce la tasa de fotosíntesis. Las plantas cultivadas en suelos ácidos también son propensas a la toxicidad del manganeso cuando absorben más Mn 2+ del requerido para las funciones metabólicas, lo que resulta en estrés oxidativo y destrucción del ácido indol-3-acético (auxina), una importante hormona del crecimiento vegetal. Se espera que los síntomas de toxicidad por manganeso sean más severos en suelos anóxicos debido a que la limitación de oxígeno reducirá varios compuestos de baja solubilidad, como MnO 2, Mn 2 O 3 y Mn 3 O 4, a Mn 2+. Encalar suelos ácidos con CaCo 3 u otra sustancia neutralizante que eleve el pH del suelo aumentará la cantidad de óxidos e hidróxidos, los cuales forman precipitados con Al 3+ y Mn 2+. Dado que los óxidos/hidróxidos de aluminio precipitados y los óxidos de manganeso no son solubles en agua, el riesgo de toxicidad de las plantas disminuye con el aumento del pH del suelo. La instalación de sistemas de drenaje que aumenten el nivel de oxígeno del suelo debería reducir la toxicidad del Mn 2+ en las
En suelos afectados por la sal, la abundancia de sodio (Na +), SO 4 2- o Cl — crea estrés salino para las plantas. Debido a la ósmosis, las células radiculares tienden a perder agua cuando los niveles de Na +, SO 4 2- y Cl — son mayores fuera de la raíz que dentro de la raíz. Esto puede conducir a trastornos fisiológicos dentro de las raíces y otros tejidos vegetales, como toxicidad iónica, procesos metabólicos alterados, estrés oxidativo, alteración de la membrana y menos división y expansión celular. En consecuencia, las plantas requieren más agua para crecer en suelos afectados por la sal. La transpiración es responsable del movimiento del agua y la acumulación de sales solubles en agua cerca de la raíz. La evaporación también provoca el movimiento de sal hacia la capa superior del suelo, particularmente en climas semiáridos y áridos donde la pérdida anual de agua es mayor que la precipitación anual. El manejo del suelo puede ser efectivo para eliminar el exceso de Na + y Cl — de la zona radicular. El riego por aspersión combinado con un mejor drenaje podría lixiviar estas sales a través del perfil del suelo y lejos de las raíces de las plantas. Los cultivos tolerantes a la sal deben plantarse en suelos afectados por la sal.
ESTRATEGIAS PARA EL MANEJO DE LOS NUTRIENTES DEL SUELO
La fertilidad del suelo en las granjas no se puede manejar sin el conocimiento del estado real de fertilidad, con base en observaciones del crecimiento de las plantas, mediciones de rendimiento, análisis de tejido vegetal y pruebas de fertilidad del suelo en cada campo. Una evaluación diagnóstica de la fertilidad del suelo también requiere información sobre la cantidad de residuos de cultivos que quedan en el campo después de la cosecha, cuánto y con qué frecuencia se esparcen cal agrícola y otras enmiendas del suelo en los campos, y cuánto fertilizante se aplica cada año. También debemos conocer las condiciones de rotación de cultivos, labranza, riego y drenaje en cada campo. Esta información puede explicar por qué la materia orgánica del suelo y los niveles de nutrientes están aumentando, estables o disminuyendo en toda la finca.
Si bien es tentador creer que siempre debemos tratar de aumentar la materia orgánica del suelo y los niveles de nutrientes, esto no siempre es alcanzable o deseable. Existen límites físicos a la cantidad de materia orgánica que se puede retener en el suelo, relacionados con las condiciones climáticas (principalmente temperatura y lluvia) que determinan los residuos de los cultivos que quedan después de la cosecha, la actividad microbiana del suelo y la textura del suelo. Aumentar la concentración de nutrientes solubles en agua en suelos con fertilidad alta o excesivamente alta podría aumentar el riesgo de pérdida de nutrientes al medio ambiente a través de reacciones biológicas (p. ej., pérdida de nitrógeno en formas gaseosas como NH 3, N 2 O y N 2) y vía lixiviación y erosión, que transportan NO 3 solubles en agua —y H 2 PO 4 — y nutrientes asociados a partículas a ambientes aguas abajo. En consecuencia, debemos utilizar los fertilizantes y otras enmiendas de manera prudente y juiciosa.
El valor de medir el nitrato residual del suelo para evaluar la eficiencia en el uso de nitrógeno
El nitrato residual del suelo al final de la temporada de crecimiento es N que no fue utilizado por el cultivo. Así, medir la cantidad de nitrato que queda en el perfil del suelo después de la cosecha proporciona un medio para evaluar con qué eficacia hemos manejado las fuentes de N. En climas semiáridos y subhúmedos, esta prueba se utiliza para ajustar los requerimientos de fertilizantes N para la próxima temporada de crecimiento. Sin embargo, en los agroecosistemas frescos húmedos donde existe un alto potencial de pérdida de nitrato en la temporada no creciente, la prueba de nitrato residual del suelo es un indicador del riesgo de pérdida de nitrato en los sistemas acuáticos. En la serie Agri-environmental Indicators (Clearwater et al., 2016) de Agriculture and Agri-Food Canada (Clearwater et al., 2016) la diferencia entre los insumos de N y las salidas de N se conoce como Nitrógeno Residual del Suelo (RSN) y se ha estimado para las regiones agrícolas de Canadá (ver Figura abajo).
Este indicador apunta al potencial de que una gran cantidad de nitrógeno permanezca en el suelo en el otoño posterior a la cosecha en el este de Canadá con valores típicos superiores a 40 kg N ha -1. Encuestas recientes de nitrato del suelo, medido a una profundidad de 45 cm, en la Isla del Príncipe Eduardo sugieren que esta estimación puede ser conservadora para la producción de papa en esa provincia con valores promedio superiores a 60 kg N ha -1. La implementación de prácticas 4R redujo el RSN en la producción de papa en PEI hasta en 30%.
Dado que los cultivos son los beneficiarios previstos de nutrimentos en tierras agrícolas, el fertilizante debe aplicarse de manera que optimice la adquisición de nutrientes por parte del cultivo. El enfoque de administración de nutrientes 4R es un marco de toma de decisiones que guía a las granjas en la selección de las acciones “correctas” relacionadas con el uso de fertilizantes, y se resume a continuación:
- Elija la fuente adecuada de fertilizante que liberará nutrientes solubles en agua para el cultivo. La fuente correcta de fertilizante también depende de su disponibilidad y precio. Los fertilizantes producidos en las granjas, como el estiércol o el compost, podrían ser un fertilizante barato y fácilmente disponible. Aplicar estos fertilizantes para cumplir con los requisitos de nutrientes de los cultivos primero, antes de comprar fertilizantes comerciales que suministrarán el resto de los nutrientes requeridos. ¿Se necesita un fertilizante de liberación rápida para superar una deficiencia de nutrientes en los cultivos? Considera una fuente de fertilizante que se disuelva en agua. Un fertilizante de liberación controlada, que se estabiliza biológica o geoquímicamente y libera nutrientes solubles en agua lentamente, podría ser adecuado para cultivos anuales con un largo período de crecimiento o sistemas de cultivo perennes.
- Elija la tasa correcta de fertilizante que permita que su cultivo alcance su potencial de rendimiento. Al seleccionar la tasa correcta, se tienen en cuenta los nutrientes residuales de residuos de cultivos en descomposición y estiércol animal que se aplicaron en temporadas de crecimiento anteriores. Aplicar más nutrientes de los que puede utilizar el cultivo no mejorará el rendimiento, aunque podría hacer que las malas hierbas crezcan mejor. Desde una perspectiva económica, es mejor aplicar un poco menos fertilizante del necesario, particularmente cuando las condiciones de cultivo son subóptimas debido a una primavera fría, inundación o sequía. Aplicar más fertilizante durante una temporada de crecimiento pobre no hará que el cultivo crezca mejor y es una pérdida de dinero.
- Elija el momento adecuado para aplicar fertilizante para que pueda sincronizar el suministro de nutrientes solubles en agua con periodos de alta demanda de nutrientes por parte del cultivo. Los cultivos anuales tienen una fase de crecimiento exponencial durante varias semanas durante su período de crecimiento vegetativo, que se ralentiza después de la iniciación floral. En suelos húmedos e irrigados, la mejor estrategia es aplicar fertilizante justo antes de la fase de crecimiento exponencial, por lo que las plantas absorberán los nutrientes de manera eficiente. En algunos cultivos, se debe aplicar fertilizante al inicio de la etapa reproductiva, para promover el desarrollo de semillas de alta calidad. Sin embargo, aplicar los fertilizantes requeridos al inicio de la temporada de crecimiento es una mejor estrategia en regiones semiáridas y subhúmedas porque la liberación de nutrientes es lenta cuando la precipitación ocurre de manera desigual durante el crecimiento vegetativo y las etapas reproductivas iniciales. Los cultivos perennes pueden ser fertilizados antes de que renueven su crecimiento vegetativo cada año. Los forrajes perennes (es decir, los campos de heno) que se cosechan dos, tres o cuatro veces al año pueden ser fertilizados después de cada corte sucesivo, antes de que comience el rebrote vegetativo.
- Elija el lugar adecuado para aplicar fertilizante para que pueda maximizar la absorción de nutrientes solubles en agua por la raíz de la planta. Se requiere una colocación precisa para evitar el contacto directo de las sales fertilizantes con semillas y plántulas, pero no hasta ahora que los nutrientes solubles en agua se lixivien de la zona radicular antes de que puedan ser absorbidos por los pelos radiculares. Los métodos más eficientes para los cultivos anuales implican colocar fertilizante en la hilera plantada (es decir, entre semillas o tubérculos) o al lado de la hilera plantada para que la transpiración coadyuve al movimiento de iones nutritivos a través del flujo másico (p. ej., NO 3 —, SO 4 2-) y difusión ( ej., H 2 PO 4 —, K +) procesos. Además, a medida que los fertilizantes se disuelven o mineralizan, liberarán nutrientes solubles que son accesibles para el sistema radicular proliferante. Las semillas también se pueden tratar con fertilizante, siempre y cuando el fertilizante tenga un bajo contenido de sal por lo que no hay estrés osmótico durante la germinación y el desarrollo temprano de las plántulas. La aplicación foliar es una forma rápida de entregar pequeñas cantidades de algunos fertilizantes micronutrientes, pero existe una delgada línea entre una deficiencia de micronutrientes y una toxicidad de micronutrientes en los tejidos foliares.
Los principios de administración de nutrientes 4R son los fundamentos del manejo de nutrientes en las granjas, pero deben combinarse con prácticas de conservación del suelo y el agua para ser efectivos. El marco 4R Plus que se utiliza en granjas modernas conecta el manejo de nutrientes 4R y las prácticas de conservación del suelo y el agua. El objetivo del enfoque 4R Plus es proporcionar nutrientes cuando el cultivo los necesita, mejorar la fertilidad del suelo y mejorar la calidad del agua. Las prácticas de conservación de suelos y aguas que pueden mejorar la fertilidad del suelo y el manejo de nutrientes incluyen:
- Reducir la labranza para minimizar las perturbaciones del suelo y mejorar la estructura del suelo.
- Dejar residuos de cultivos en la superficie del suelo para protegerlo del impacto de la lluvia.
- Cultivar cultivos de cobertura para proteger el suelo y apoyar la comunidad microbiana del suelo entre temporadas de cultivo.
- Aplicar fertilizante y estiércol adecuados utilizando los principios 4R de fuente correcta, tasa correcta, momento y lugar adecuados.
- Valorar las aplicaciones de estiércol, ya que el estiércol puede mejorar la biología y
- Controlar el tráfico de campo para reducir la compactación del suelo.
- Extender las rotaciones de cultivos e incluir cultivos perennes para construir materia orgánica del suelo.
- Establezca bandas de búfer de contorno, búferes de campo y búferes de flujo para proteger entornos sensibles dentro del campo y en entornos posteriores
- Las áreas altamente erosionables se pueden plantar con cultivos perennes o con árboles, en lugar de cultivos anuales.
- Utilizar pastoreo prescrito o rotacional para minimizar la erosión del suelo.
Impacto de la labranza a largo plazo y la fertilización sintética sobre los parámetros del suelo y los rendimientos de los cultivos bajo una rotación maíz-soja en el este
En el este de Canadá, el maíz (Zea mays L.) —soya [Glycine max (L.) La rotación Merr.] representa una asociación dominante cereal-leguminosa. Si bien se reconocen los beneficios económicos de esta rotación, se requiere investigación para evaluar su impacto a largo plazo en la calidad del suelo y la productividad de los cultivos bajo diferentes alternativas de manejo como la labranza reducida o tasas variables de fertilización sintética. De hecho, el papel fundamental de los experimentos de campo a largo plazo en la investigación y desarrollo agronómico ha sido reconocido durante décadas por la comunidad científica internacional como esencial para evaluar los efectos de las prácticas de manejo en la fertilidad del suelo, la calidad del suelo y la productividad de los cultivos.
En 1992, se estableció un experimento de investigación a largo plazo en el sur de Quebec sobre un sustrato arcilloso para evaluar el efecto de la labranza [arado de moldura (MP) vs labranza cero (NT)], N sintético (0, 80 y 160 kg N ha -1) y P fertilización (0, 17.5 y 35 kg P ha-1) sobre el funcionamiento del suelo y rendimientos de cultivos de una secuencia de cultivo de grano de maíz y soja. Los fertilizantes sintéticos se aplicaron únicamente a la fase de maíz de la rotación, mientras que la labranza se realizó cada año.
Los resultados obtenidos de 12 a 20 años después del inicio del estudio indicaron que el tratamiento de NT mejoró la acumulación de C orgánico, la disponibilidad de NO 3-N, P y K, y la actividad microbiana en la capa superior del suelo probablemente debido a la acumulación de residuos de cultivos en o cerca de la superficie del suelo. Esta estratificación puede beneficiar la estructura del suelo pero podría afectar la calidad de las aguas superficiales a largo plazo. Por el contrario, el tratamiento con MP se caracterizó por una distribución más uniforme de C orgánico y nutrientes a la profundidad de labranza y mayor actividad microbiana cerca del fondo de la capa de arado. Se establecieron fuertes vínculos entre las pruebas de suelo P (por ejemplo Mehlich-3 y Olsen P) y el equilibrio P, explicando cómo P puede acumularse en el tiempo con prácticas agrícolas continuas. Las emisiones de N 2 O del suelo se incrementaron por la fertilización de N en maíz pero no se vieron afectadas por la labranza El rendimiento de maíz en grano respondió linealmente a la adición de N fertilizante en todos los años, pero el rendimiento de soya fue poco afectado por N. A excepción del estado P del suelo, el fertilizante P tuvo un impacto limitado en ambos cultivos en este sitio, pero la falta de reposición eventualmente conduciría al agotamiento del suelo P. En general, el MP dio mayores rendimientos que la TC en varios años (ver Figura anterior) —en promedio de 10% en maíz y 13% en soya— y proporcionó generalmente una mejor rentabilidad. El menor desempeño de CT en este sitio en comparación con MP probablemente se debe a que las condiciones de suelo más frescas y húmedas en primavera debido a los residuos superficiales de los cultivos.
Nota: este sitio aún está en funcionamiento y otros estudios están bajo investigación. Para más detalles ver Ziadi et al. (2014).
En el futuro, los administradores de fertilidad del suelo dependerán más de las tecnologías de agricultura de precisión para lograr los objetivos de 4R Plus. La mayor ventaja de la agricultura de precisión, desde la perspectiva del manejo de los nutrientes, es que permite el desarrollo de mapas espacialmente explícitos del suelo y las condiciones hidrológicas en los campos agrícolas. Las múltiples capas de información en estos mapas nos permiten evaluar parámetros individuales, como el pH del suelo o la concentración de potasio del suelo en un campo, o podemos evaluar las interacciones entre múltiples parámetros (por ejemplo, son cambios en el pH del suelo asociados con fluctuaciones en el nivel del nivel freático al otro lado del campo?). En lugar de depender de un valor promedio de fertilidad del suelo para un campo grande, podemos observar gradientes en la fertilidad del suelo que existen en todo el campo. Conocer las zonas de baja, media y alta fertilidad nos permite ajustar las tasas de aplicación de fertilizantes y satisfacer las necesidades del cultivo que crece en una zona particular, en lugar de aplicar una tasa uniforme de fertilizante en todo el campo. Los mapas de suelos e hidrológicos también pueden identificar las áreas vulnerables en los campos donde es más probable que se produzca lixiviación o erosión. De ahí que la finca que adopte tecnologías de agricultura de precisión puede ahorrar dinero aplicando fertilizantes con precisión, donde se necesitan, y establecer zonas de amortiguamiento en las áreas sensibles del campo y en la interfaz entre campos y tierras no agrícolas. Las tecnologías de agricultura de precisión están bien alineadas con los objetivos de 4R Plus y deberían ser de gran beneficio para manejar la fertilidad del suelo en el futuro.
RESUMEN
- Los iones nutritivos solubles en agua en el agua de los poros del suelo son absorbidos por los pelos radiculares
- Los nutrientes disponibles para las plantas en el agua de los poros del suelo pueden transformarse en formas no disponibles a través de reacciones biológicas, como la absorción, inmovilización y reducción de la planta. La precipitación química y las reacciones de adsorción también eliminan los nutrientes disponibles en las plantas del agua de los poros del suelo. La pérdida física de nutrientes disponibles en las plantas ocurre cuando los suelos son lixiviados y erosionados.
- El agua de los poros del suelo se repone con nutrientes disponibles en las plantas a través de reacciones de mineralización, oxidación, meteorización, disolución y desorción.
- Las pruebas de fertilidad del suelo describen el suministro de nutrientes del suelo y se requieren para hacer recomendaciones de fertilizantes. La nutrición de los cultivos se explica por el análisis de tejido vegetal, que determina si el cultivo tiene suficientes nutrientes o es deficiente en nutrientes requeridos para lograr el rendimiento económicamente óptimo.
- Se pueden aplicar fertilizantes inorgánicos y orgánicos para reponer el suministro de nutrientes del suelo y mejorar la nutrición de los cultivos. La disolución de fertilizantes inorgánicos libera rápidamente iones nutritivos solubles en agua, mientras que los fertilizantes orgánicos contienen algunos compuestos orgánicos que deben ser mineralizados para liberar iones nutritivos solubles en agua, convirtiéndolos en un fertilizante de liberación relativamente lenta.
- El enfoque de administración de nutrientes 4R para el manejo de nutrientes del suelo se enfoca en seleccionar la fuente correcta de fertilizante, para ser aplicado en la tasa correcta, en el momento y en el lugar adecuado para obtener el mayor porcentaje de nutrientes fertilizantes en la biomasa de los cultivos. Lograr una alta eficiencia en el uso de nutrientes fertilizantes de manera rentable es el objetivo.
- Los nutrientes del suelo son susceptibles a la pérdida del sistema suelo-planta, por lo que las granjas deben ser conscientes de las implicaciones ambientales del manejo de los nutrientes del suelo.
- El “¿Se puede cavar?” Las cajas proporcionan ejemplos de pruebas de fertilidad del suelo y mejora de los nutrientes del suelo en Canadá.
LECTURA SUGERIDA
Instituto Internacional de Nutrición Vegetal. 2012. 4R nutrición vegetal: un manual para mejorar el manejo de la nutrición vegetal. Versión norteamericana. IPNI, Norcross, GA, EE. UU.
Havlin, J.L., J.D. Beaton, S.L. Tisdale, y W.L. Nelson. 2014. Fertilidad del suelo y fertilizantes: una introducción al manejo nutrimental. 8a ed. Pearson Prentice Hall, Upper Saddle River, Nueva Jersey.
Munroe, J. (ed). 2016. Manual de fertilidad del suelo. 3rd edn. Ontario Ministerio de Agricultura, Alimentación y Asuntos Rurales Publicación 611. Queen's Printer para Ontario, Toronto. http://www.omafra.gov.on.ca/english/crops/pub611/pub611.pdf
Reid, K. 2014. Mejorando tu suelo: Una guía práctica para el manejo del suelo para el jardinero casero serio. Firefly Books Ltd., Richmond Hill, Ontario, 272 p.
PREGUNTAS DE ESTUDIO
- ¿Cómo son absorbidos los nutrientes del suelo por las plantas?
- Complete la siguiente tabla.
Nutriente ¿Macronutrientes o Micronutrientes? ¿Fuente en suelo? Papel en la nutrición vegetal N P Ca S Cu Fe - Dé un ejemplo de una reacción biológica que puede agotar la cantidad de nitrógeno disponible en las plantas en el agua de los poros del suelo.
- ¿Qué es una reacción química que reduce la cantidad de potasio disponible en las plantas en el agua de poro del suelo?
- ¿Por qué la aplicación de un fertilizante que contiene NH 3 tiende a acidificar el suelo?
- El nitrógeno suele ser el nutriente más limitante para que los cultivos agrícolas alcancen su potencial de rendimiento, por lo que ¿es una buena idea agregar tasas excesivamente altas de fertilizante nitrogenado a las tierras agrícolas? ¿Por qué o por qué no?
- ¿Cuál es la mejor herramienta de diagnóstico para determinar los requerimientos de fertilizantes de los cultivos: pruebas de fertilidad del suelo o análisis de tejido vegetal?
- Los fertilizantes micronutrientes se pueden aplicar al follaje de los cultivos. ¿Cuál es la ventaja de este método de fertilización?
- ¿Cuáles son algunas consideraciones para ayudarle a elegir la fuente de fertilizante adecuada para su cultivo?
- ¿Cuáles son las prácticas adecuadas de conservación del suelo y del agua para prevenir la pérdida de nutrientes por erosión?
REFERENCIAS
Abdi, D., Cade-Menun, B.J., Ziadi, N., y Parent, L.-É. 2014. Impacto a largo plazo de las prácticas de labranza y fertilización con fósforo en las formas de fósforo del suelo determinado por espectroscopía de resonancia magnética nuclear 31P. J. Environ. Qual. 43 (4): 1431—1441.
Bender, R.R., J.W. Haegele, M.L. Ruffo, y F.E. Abajo. 2010. Absorción, partición y remobilización de nutrientes en híbridos modernos de maíz transgénicos protegidos por insectos. Agron. J. 105 (1): 161—170.
Carter, M.R. y Gregorich, E.G. 2008. Muestreo de suelos y métodos de análisis. 2a ed. Sociedad Canadiense de Ciencias del Suelo. CRC Press, Boca Ratón, FL.
Centre de référence en agriculture et agroalimentaire du Québec. 2010. Guía de référence en fecundación. 2e édn. Centro de Référence en Agriculture et Agroalimentaire du Québec, Ste Foy, QC.
Chantigny, M.H., Angers, D.A., Morvan, T., y Pomar, C. 2004. Dinámica del nitrógeno de lodo porcino en suelo y planta según lo determinado con N-15. Suelo Sci. Soc. Am. J. 68 (2): 637—643.
Deen, B., Lauzon, J., y Bruulsema, T. 2007. Respuesta del maíz a la nutrición intensiva de cultivos. Mejores Cultivos 91:20—21. http://www.ipni.net/publication/bett...48874B7A852579 800081d5ce/$ archivo/mejor%20cultivos% 202007-2% 20p20.pdf
Dessureault-Rompré, J., Zebarth, B.J., Chow, T.L., Burton, D.L., Sharifi, M., Georgallas, A., Porter, G., Moreau, G., Leclerc, Y., Arsenault, W.J., y Grant, C.A. 2011. Predicción del suministro de nitrógeno del suelo en campos de papa en clima fresco y húmedo. Suelo Sci. Soc. Am. J. 75 (2): 626—637.
Drury, C.F., Yang, J., De Jong, R., Huffman, T., Reid, K., Yang, X., Bittman, S., y Desjardins, R. 2016. Nitrógeno residual del suelo. Páginas 114—120 En R.L. Clearwater, T. Martin, y T. Hoppe (Eds.) Sustentabilidad ambiental de la agricultura canadiense: serie de informes de indicadores agroambientales. Reporte #4. Ottawa, ON: Agricultura y Agroalimentación Canadá
Elbon A., y Whalen, J.K. 2015. Abastecimiento de fósforo a cultivos hortícolas de micorrizas arbusculares vesiculares: una revisión. Biol. Agric. Hort. 31 (2): 73—90.
Eskin, N., Vessey, K., y Tian, L. 2014. Avances de la investigación y perspectivas de la bacteria fijadora de nitrógeno, Gluconacetobacter diazotrophicus, en plantas monocotiledóneas. Int. J. Agron. 2014, 13 págs. artículo 208383. https://doi.org/10.1155/2014/208383
Evans, J.R. 1989. Fotosíntesis y relaciones nitrogenadas en hojas de plantas C 3. Ecologia 78 (1): 9—19.
Fleury, D. 2020. Manejo de nitrógeno 4R para trigo y canola. Top Crop Manager 19 agosto 2020 https://www.topcropmanager.com/4r-ni...at-and-canola/
Follett, R.H., Murphy, L.S., y Donahue, R.L. 1981. Fertilizantes y enmiendas de suelos. Prentice-Hall, Inc., Englewood Cliffs, Nueva Jersey.
Havlin, J.L., Beaton, J.D., Tisdale, S.L., y Nelson, W.L. 2014. Fertilidad del suelo y fertilizantes: una introducción al manejo nutrimental. 8a ed. Pearson Prentice Hall, Upper Saddle River, Nueva Jersey.
Él, Z.Q., Honeycutt, C.W., Griffin, T.S., Cade-Menun, B.J., Pellechia, P.J., y Dou, Z.X. 2009. Formas de fósforo en estiércol lácteo convencional y orgánico identificadas por espectroscopía de RMN P‐31 en solución y estado sólido. J. Environ. Qual. 38 (5): 1909—1918.
Instituto Internacional de Nutrición Vegetal. 2012. 4R nutrición vegetal: un manual para mejorar el manejo de la nutrición vegetal. Versión norteamericana. IPNI, Norcross, GA, EE. UU.
Jones, J.B., Jr. 2003. Manual agronómico: manejo de cultivos, suelos y su fertilidad. CRC Press, Boca Ratón, FL.
Karamanos, R.E. 2008. Recomendaciones de nitrógeno y fósforo para Manitoba para los costos de producción actuales. Presentado en la Conferencia de Agrónomos de Manitoba 2008, Winnipeg, MB
http://umanitoba.ca/faculties/afs/MA...is%20Karamanos %20papel.pdf
Kour, D. Rana, K.L., Kaur, T., Yadav, N., Yadav, A.N., Kumar, M., Kumar, V., Dhaliwal, H.S., y Saxena, A.K. 2021. Biodiversidad, desarrollos actuales y posibles aplicaciones biotecnológicas de microbios solubilizantes y movilizadores de fósforo: Una revisión. Pedosfera 31 (1): 43—75.
Kumar, V., Vogelsang, L., Schmidt, R.R., Sharma, S.S., Seidel, T., y Dietz, K.-J. 2020. La remodelación del crecimiento radicular bajo estrés combinado de arsénico e hipoxia está ligada a la privación de nutrientes. Fronteras en la Ciencia Vegetal. 23 de octubre de 2020. https://doi.org/10.3389/fpls.2020.569687
Leytem, A.B., Smith, D.R., Applegate, T.J., y Thacker, P.A. 2006. Influencia del ácido fítico del estiércol en la solubilidad del fósforo en suelos calcáreos. Suelo Sci. Soc. Am. J. 70 (5): 1629—1638.
Marty, C., Lévesque, J.-A., Bradley, R.L., Lafond J., y Paré, M.C. 2019. Impactos contrastantes de dos especies de malezas en la absorción de nitrógeno de fertilizantes de arándanos bajos en un campo comercial. PLoS ONE 14: e0215253.
Mehlich, A. 1984. Extractante de prueba de suelo Mehlich-3: una modificación del extractante Mehlich-2. Commun. Suelo Sci. Planta Anal. 15 (12): 1409—1416.
Mortvedt, J.J., Cox, F.R., Shuman, L.M., y Welch, R.M. 1991. Micronutrientes en la agricultura. Serie de libros SSSA 4, Sociedad Americana de Agronomía, Madison, WI.
Munroe, J. (ed). 2016. Manual de fertilidad del suelo. 3rd edn. Ontario Ministerio de Agricultura, Alimentación y Asuntos Rurales Publicación 611. Queen's Printer para Ontario, Toronto. http://www.omafra.gov.on.ca/english/...611/pub611.pdf
Ontario Ministerio de Agricultura, Alimentación y Asuntos Rurales (OMAFRA). 2006. Planeación del manejo de nutrientes Serie Mejores Prácticas de Gestión, Guelph, ON.
Rascio, N., y La Rocca, N. 2013. Fijación biológica de nitrógeno. Módulo de Referencia en Sistemas Terrestres y Ciencias Ambientales. Elsevier, Ámsterdam. doi:10.1016/B978-0-12-409548-9.00685-0
Reid, R., y Hayes, J. 2003. Mecanismos y control de la captación de nutrientes en plantas. Int. Rev. Cytol. 29:73—114. doi: 10.1016/S0074-7696 (03) 29003-3.
Ruiz Herrera, L.F., Shane, M.W., y López-Bucio, J. 2015. Regulación nutricional del desarrollo radicular. WiRs Dev. Biol. 4:431—443. doi: 10.1002/wdev.183
Sims, J.T., Maguire, R.O., Leytem, A.B., Gartley, K.L., y Pautler, M.C.. 2002. Evaluación de Mehlich 3 como prueba agroambiental de fósforo del suelo para el Atlántico Medio de los Estados Unidos de América. Suelo Sci. Soc. Am. J. 66 (6): 2016—2032.
Stumborg, C., Schoenau, J.J., y Malhi, S.S. 2007. Balance de nitrógeno y patrón de acumulación en tres suelos de pradera contrastantes que reciben aplicaciones repetidas de cerdos líquidos y estiércol de ganado sólido. Nutr. Cicl. Agroecosísta. 78:15—25.
Westerman, R.L. 1990. Pruebas de suelo y análisis de plantas. 3er edn. Serie de libros SSSA 3, Sociedad Americana de Agronomía, Madison, WI.
Whalen, J.K. 2014. Manejo de la descomposición mediada por la biota del suelo y mineralización de nutrientes en agroecosistemas sustentables. Avances en Agricultura 2014:13 p. Artículo 384604. doi: 10.1155/2014/384604
Whalen, J.K., Thomas, B.W. y Sharifi, M. 2019. Prácticas novedosas y tecnologías inteligentes para maximizar el valor fertilizante nitrogenado del estiércol para la producción de cultivos en regiones templadas frías y húmedas. Adv. Agron. 153:1—85.
Zebarth, B.J., Leclerc, Y., Moreau, G., Gareau, R., y Milburn, P.H. 2003. Contenido de nitrógeno inorgánico del suelo en campos comerciales de papa en New Brunswick. Can. J. Suelo Sci. 83 (4): 425—429.
Ziadi, N., Angers, D.A., Gagnon, B., Lalande, R., Morel, C., Rochette, P., y Chantigny, M.H. 2014. La labranza a largo plazo y la fertilización sintética afectan el funcionamiento del suelo y los rendimientos de los cultivos en una rotación maíz-soja en el este Can. J. Suelo Sci. 94 (3): 365—376.
Ziadi, N., Simard, R.R., Allard, G., y Lafond, J. 1999. Evaluación de campo de membranas de intercambio aniónico como método de ensayo de N suelo para pastizales. Can. J. Suelo Sci. 79 (2): 281—294.
Acerca de los Autores
Joann K. Whalen, profesor James McGill en la Universidad McGill y profesor adjunto en la Universidad Agrícola Gansu y con el Instituto Nordeste de Geografía y Agroecología, Academia China de Ciencias

Joann recibió su B.Sc. (Agr.) de la Universidad Dalhousie, M.Sc. de la Universidad McGill y Ph.D. de la Universidad Estatal de Ohio (EE. UU.). Es agrónoma profesional (agrónoma) en Quebec, Canadá. Su investigación se centra en la fertilidad del suelo y la ecología del suelo en agroecosistemas. Ha publicado más de 230 publicaciones científicas revisadas por pares y supervisado/co-supervisado a más de 70 estudiantes en los niveles de maestría, doctorado y postdoctorado. Imparte cursos de fertilidad del suelo, planeación del manejo de nutrientes y química ambiental del suelo.
Joann es Editor Jefe de Biología del Suelo y Bioquímica, una revista académica que publica artículos de investigación originales y científicamente desafiantes de importancia internacional que describen y explican los procesos biológicos que ocurren en el suelo. Es miembro de la Soil Science Society of America y de la Canadian Society of Soil Science. Joann es el primer científico internacional en ser elegido para un mandato de 3 años como Presidente de la Sociedad Americana de Agronomía (2022-2024). Creció en una comunidad agrícola cerca de Sussex, New Brunswick y siempre se ha interesado en los aspectos prácticos del cultivo de alimentos. En su opinión, los especialistas en fertilidad del suelo son los científicos agrícolas más ampliamente capacitados porque tienen que reunir conocimientos de tantos campos —física, hidrología, química, bioquímica, biología vegetal, microbiología y genética— para comprender los complejos y dinámicos procesos del suelo responsables de crecimiento de cultivos. Para dar sentido a las respuestas del suelo, tenemos que cavar más profundo, ¡lo que le viene de manera bastante natural a un científico del suelo!
Noura Ziadi, Investigadora Científica, Agricultura y Agroalimentación Canadá; Profesora Adjunta Université Laval, la Universidad de Posgrado de la Academia China de Ciencias, Université du Québec en Abitibi-Témiscamingue

Noura es una investigadora científica con Agricultura y Agroalimentación Canadá en la ciudad de Quebec. Tiene una B.Sc. (Agronomía) de Túnez y un M.Sc. y un Ph.D. (Fertilidad del Suelo y Nutrición Vegetal) de la Universidad Laval, Quebec, Canadá. Noura también es profesora adjunta en la Université Laval (2005-), la Universidad de Posgrado de la Academia China de Ciencias (2012-) y la Université du Québec en Abitibi-Témiscamingue (2016-).
Noura tiene una destacada carrera en ciencias del suelo especialmente en fertilidad del suelo y nutrición vegetal y está realizando su investigación a escala nacional e internacional (Francia, China, Suiza, Finlandia, Túnez, Irán, Arabia Saudita) dentro de equipos multidisciplinarios que incluyen gobierno y universidad investigadores y socios de la industria. Noura publicó más de 155 artículos, cinco reseñas y 11 capítulos de libros, incluidos 37 artículos con el Canadian Journal of Soil Science (CJSS). Noura se incorporó al CSSS en 1994 y se ha desempeñado como Consejera Oriental (2008-2010), Presidente Electo (2017), Presidente (2018) y Paso-Presidente (2019). Noura es editora asociada (AE) del CJSS desde 2011, ha manejado 107 manuscritos para esta revista y fue reconocida como la mejor AE en 2017. Noura ha sido reconocida por sus contribuciones a la ciencia del suelo y al CSSS con un Fellow Award en 2015.
Jeff J. Schoenau, Profesor y Cátedra de Investigación del Ministerio de Agricultura de Saskatchewan — Nutrient Cycling & Management, Departamento de Ciencias del Suelo, Universidad de Ciencias del Suelo

Jeff es profesor de fertilidad del suelo y agrólogo profesional que trabaja en el Departamento de Ciencias del Suelo de la Universidad de Saskatchewan. Es titular de la Cátedra de Manejo de Nutrimentos del Suelo del Ministerio de Agricultura de Saskatchewan en el Colegio de Agricultura y Biorecursos, y es becario del Instituto Agrícola de Canadá. Nació en Saskatchewan, completó sus títulos de licenciatura y posgrado en la década de 1980 en la Facultad de Agricultura de la Universidad de Saskatchewan y ha trabajado allí desde entonces. También cultiva con su esposa Lynne cerca de Central Butte, Saskatchewan. Sus actividades de investigación, docencia y extensión tratan sobre la fertilidad del suelo y fertilizantes, el ciclo de nutrientes y las prácticas de manejo del suelo en sistemas de cultivo de praderas.
Maxime C. Paré, Profesor, Université du Québec à Chicoutimi

Enseño ciencias del suelo a estudiantes de licenciatura, la mayoría de los cuales están inscritos en el programa de biología de la UQAC. Enseño ciencias del suelo como clase introductoria, y analizamos la química del suelo, la biología, el ciclo de nutrientes y la pedología. Siempre es interesante cómo inicialmente la mayoría de los estudiantes ven la ciencia del suelo de manera negativa, generalmente hago una pequeña encuesta durante la primera clase del semestre, y cómo sus puntos de vista cambian a lo largo del semestre a medida que los estudiantes se dan cuenta de la importancia del suelo para la biología, la vida y el bienestar general del planeta. También incluyo la ciencia del suelo en la mayoría de mis actividades docentes de campo. Me gusta mostrar los vínculos entre esferas, como cómo lo que vemos cuando miramos hacia arriba, por ejemplo, los rasgos de las plantas y los árboles, influye fuertemente en lo que encontramos cuando miramos hacia abajo, es decir, en el suelo, y viceversa. Por último, la ciencia del suelo me permite hacer investigación y apoyar a muchos estudiantes de posgrado en una variedad de disciplinas de investigación, desde diversos dominios agrícolas (arándano silvestre, haskap, papas, cultivos comerciales, etc.) hasta la silvicultura y las ciencias ambientales. ¿Cómo podría ser más estimulada?
David L. Burton, Profesor, Departamento de Ciencias Vegetales, Alimentarias y Ambientales, Facultad de Agricultura, Universidad Dalhousie

El Dr. David Burton es Científico de Suelos y Profesor en el Departamento de Plantas, Alimentos y Medio Ambiente de la Universidad Dalhousie. Su investigación examina el papel del ambiente del suelo en la influencia de la naturaleza y extensión del metabolismo microbiano en el suelo. Su enfoque ha estado en los procesos en el ciclo del nitrógeno en los suelos y sus implicaciones para la fertilidad del suelo y el impacto ambiental. El objetivo de este trabajo es comprender mejor los factores que controlan la función microbiana del suelo y utilizar esta información para desarrollar sistemas resilientes de manejo de tierras en respuesta a un clima cambiante.
Tom Bruulsema, científico jefe del IPNI Canadá

Desde julio de 2019, Tom Bruulsema es Científico Jefe de Plant Nutrition Canada, brindando apoyo a los programas de administración de nutrientes de Fertilizer Canada, The Fertilizer Institute y la International Fertilizer Association. Antes de la disolución del IPNI más grande, fue vicepresidente de los programas del Instituto en las Américas, e investigó a nivel mundial. De 2015 a 2017 dirigió el Programa de Fósforo del Instituto. El Dr. Bruulsema ha sido reconocido como miembro de la American Society of Agronomy, la Soil Science Society of America y la Canadian Society of Agronomy. Anteriormente fue investigador asociado en la Universidad de Minnesota (1994), y agrónomo del Comité Central Menonita en Bangladesh (1986-1990).


