3.4: Minerales Silicatos
- Page ID
- 88586
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Los minerales se categorizan en función de su composición y estructura. Los minerales de silicato se construyen alrededor de un ion molecular llamado tetraedro de silicio-oxígeno. Un tetraedro tiene forma piramidal con cuatro lados y cuatro esquinas. Los minerales de silicato forman el grupo más grande de minerales de la Tierra, que comprende la gran mayoría del manto y la corteza terrestre. De los casi cuatro mil minerales conocidos en la Tierra, la mayoría son raros. Solo hay unos pocos que conforman la mayoría de las rocas que probablemente se encuentren con criaturas que habitan en la superficie como nosotros. Estos generalmente se llaman los minerales formadores de rocas.
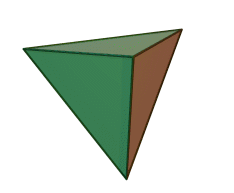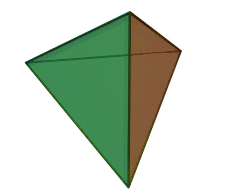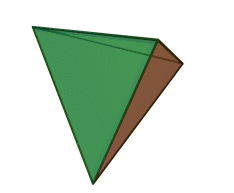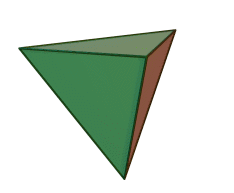
El tetraedro de silicio-oxígeno (SiO 4) consiste en un solo átomo de silicio en el centro y cuatro átomos de oxígeno ubicados en las cuatro esquinas del tetraedro. Cada ion oxígeno tiene una carga -2 y el ion silicio tiene una carga +4. El ion silicio comparte uno de sus cuatro electrones de valencia con cada uno de los cuatro iones de oxígeno en un enlace covalente para crear una figura simétrica geométrica piramidal de cuatro lados. Solo se comparte la mitad de los electrones de valencia del oxígeno, lo que le da al tetraedro silicio-oxígeno una carga iónica de -4. Este tetraedro de silicio-oxígeno forma enlaces con muchas otras combinaciones de iones para formar el gran grupo de minerales de silicato.

El ion silicio es mucho más pequeño que los iones oxígeno (ver las figuras) y encaja en un pequeño espacio en el centro de los cuatro grandes iones de oxígeno, ver si se retira la bola superior (como se muestra en la figura a la derecha). Debido a que solo se comparte uno de los electrones de valencia de los oxígenos de esquina, el tetraedro de silicio-oxígeno tiene esquinas químicamente activas disponibles para formar enlaces con otros tetraedros de sílice u otros iones cargados positivamente como Al +3, Fe +2, +3, Mg +2, K +1, Na +1, y Ca +2. Dependiendo de muchos factores, como la química original del magma, los tetraedros de sílice-oxígeno pueden combinarse con otros tetraedros en varias configuraciones diferentes. Por ejemplo, los tetraedros se pueden aislar, unir en cadenas, láminas o estructuras tridimensionales. Estas combinaciones y otras crean la estructura química en la que se pueden insertar iones cargados positivamente para composiciones químicas únicas que forman grupos minerales de silicato.

Los Silicatos Ferromagnesios Oscuros
 GFDL, CC-BY-SA-3.0 o CC BY-SA 2.5], vía Wikimedia Commons" width="347px" height="260px" src="https://geo.libretexts.org/@api/deki...lt-300x225.jpg">
GFDL, CC-BY-SA-3.0 o CC BY-SA 2.5], vía Wikimedia Commons" width="347px" height="260px" src="https://geo.libretexts.org/@api/deki...lt-300x225.jpg">
La familia de los olivinos
El olivino es el componente mineral principal en la roca del manto como la peridotita y el basalto. Es característicamente verde cuando no está desgastado. La fórmula química es (Fe, Mg) 2 SiO 4. Como se describió anteriormente, la coma entre hierro (Fe) y magnesio (Mg) indica que estos dos elementos ocurren en una solución sólida. No debe confundirse con una solución líquida, una solución sólida ocurre cuando dos o más elementos tienen propiedades similares y pueden sustituirse libremente entre sí en la misma ubicación en la estructura cristalina.

El olivino se conoce como una familia mineral debido a la capacidad del hierro y el magnesio para sustituirse entre sí. El hierro y el magnesio en la familia de los olivinos indican una solución sólida que forma una serie composicional dentro del grupo mineral que puede formar cristales de todo el hierro como un miembro terminal y todas las mezclas de hierro y magnesio entre todo el magnesio en el otro miembro extremo. Se aplican diferentes nombres minerales a las composiciones entre estos miembros finales. En la serie olivina de minerales, los iones hierro y magnesio en la solución sólida son aproximadamente del mismo tamaño y carga, por lo que cualquiera de los átomos puede encajar en la misma ubicación en los cristales en crecimiento. Dentro del magma de enfriamiento, los cristales minerales continúan creciendo hasta que se solidifican en roca ígnea. Las cantidades relativas de hierro y magnesio en el magma progenitor determinan qué minerales forman la serie. Otros elementos más raros con propiedades similares al hierro o al magnesio, como el manganeso (Mn), pueden sustituirse en la estructura cristalina del olivino en pequeñas cantidades. Dichas sustituciones iónicas en cristales minerales dan lugar a la gran variedad de minerales y a menudo son responsables de diferencias de color y otras propiedades dentro de un grupo o familia de minerales. El olivino tiene un miembro terminal de hierro puro (llamado fayalita) y un miembro final de magnesio puro (llamado forsterita). Químicamente, el olivino es principalmente sílice, hierro y magnesio y por lo tanto se agrupa entre los minerales ferromagnesianos de color oscuro (hierro=ferro, magnesio=magnesiano) o máficos, una contracción de sus símbolos químicos Ma y Fe. Los minerales máficos también se conocen como minerales ferromagnesianos de color oscuro. Ferro significa hierro y magnesiano se refiere al magnesio.
La estructura cristalina del olivino está construida a partir de tetraedros de sílice independientes. Los minerales con estructuras tetraédricas independientes se denominan neosilicatos (u ortosilicatos). Además del olivino, otros minerales de neosilicato comunes incluyen granate, topacio, cianita y circón.
Otros dos arreglos similares de tetraedros son cercanos en estructura a los neosilicatos y grado hacia el siguiente grupo de minerales, los piroxenos. En una variación de tetraedros independientes llamados sorosilicatos, existen minerales que comparten un oxígeno entre dos tetraedros e incluyen minerales como la epidota verde pistacho, una piedra preciosa. Otra variación son los ciclosilicatos, que como su nombre indica, consisten en anillos tetraédricos, e incluyen piedras preciosas como el berilo, la esmeralda, la aguamarina y la turmalina
Familia de fuentes Pyroxene
 iRocks.com — CC-BY-SA-3.0 [CC BY-SA 3. 0], vía Wikimedia Commons" width="300px" height="231px" src="https://geo.libretexts.org/@api/deki...05-300x231.jpg">
iRocks.com — CC-BY-SA-3.0 [CC BY-SA 3. 0], vía Wikimedia Commons" width="300px" height="231px" src="https://geo.libretexts.org/@api/deki...05-300x231.jpg">
El piroxeno es otra familia de minerales ferromagnesianos oscuros, típicamente de color negro o verde oscuro. Los miembros de la familia del piroxeno tienen una composición química compleja que incluye hierro, magnesio, aluminio y otros elementos unidos a tetraedros de sílice polimerizada. Los polímeros son cadenas, láminas o estructuras tridimensionales, y están formados por múltiples tetraedros unidos covalentemente a través de sus átomos de oxígeno de esquina. Los piroxenos se encuentran comúnmente en rocas ígneas máficas como peridotita, basalto y gabro, así como rocas metamórficas como eclogita y esquisto azul.

Los piroxenos se construyen a partir de largas cadenas simples de tetraedros de sílice polimerizada en los que los tetraedros comparten dos oxígenos de esquina. Las cadenas de sílice están unidas entre sí en las estructuras cristalinas por cationes metálicos. Un miembro común de la familia del piroxeno es el augite, el mismo contiene varias series de soluciones sólidas con una fórmula química compleja (Ca, Na) (Mg, Fe, Al, Ti) (Si, Al) 2 O 6 que da lugar a una serie de nombres minerales individuales.
Esta estructura cristalina monocatenaria se une con muchos elementos, que también pueden sustituirse libremente entre sí. La composición química generalizada para piroxeno es XZ (Al, Si) 2 O 6. X representa los iones Na, Ca, Mg o Fe, y Z representa Mg, Fe o Al. Estos iones tienen tamaños iónicos similares, lo que permite muchas posibles sustituciones entre ellos. Aunque los cationes pueden sustituirse libremente entre sí en el cristal, llevan diferentes cargas iónicas que deben equilibrarse en la estructura cristalina final. Por ejemplo, Na tiene un cargo de +1, pero Ca tiene un cargo de +2. Si un ion Na + sustituye a un ion Ca +2, crea una carga desigual que debe ser equilibrada por otras sustituciones iónicas en otra parte del cristal. Tenga en cuenta que el tamaño iónico es más importante que la carga iónica para que se produzcan sustituciones en series de soluciones sólidas en cristales.
Familia de fuentes Amphibole

![Solurce: Por Dave Dyet http://www.shutterstone.com http://www.dyet.com (Obra propia) [Dominio público], <a data-cke-saved-href="https://commons.wikimedia.org/wiki/File%3AOrthoclase_Hornblende.jpg" href="https://commons.wikimedia.org/wiki/File%3AOrthoclase_Hornblende.jpg" Un cristal de ortoclasa (feldespato potásico) con cristales oscuros alargados de hornblende](http://opengeology.org/textbook/wp-content/uploads/2016/07/03.15_Orthoclase_Hornblende-300x300.jpg) vía Wikimedia Commons" width="230px" height="230px" src="https://geo.libretexts.org/@api/deki...ain-41x300.png">
vía Wikimedia Commons" width="230px" height="230px" src="https://geo.libretexts.org/@api/deki...ain-41x300.png">
Los minerales anfíboles se construyen a partir de cadenas de sílice dobles polimerizadas y también se les conoce como inosilicatos. Imagina dos cadenas de piroxeno que se conectan entre sí compartiendo el tercer oxígeno en cada tetraedro. Los anfíboles generalmente se encuentran en rocas ígneas y metamórficas y suelen tener un hábito cristalino de hoja larga. El anfíbol más común, hornblende, suele ser negro; sin embargo, vienen en una variedad de colores dependiendo de su composición química. La roca metamórfica, anfibolita, está compuesta principalmente por minerales anfíboles.

Los anfíboles están compuestos de hierro, magnesio, aluminio y otros cationes unidos con tetraedros de sílice. Estos minerales ferromagnesianos oscuros se encuentran comúnmente en gabro, basalto, diorita, y a menudo forman las motas negras en el granito. Su fórmula química es muy compleja y generalmente se escribe como (RSi 4 O 11) 2, donde R representa muchos cationes diferentes. Por ejemplo, también se puede escribir más exactamente como AX 2 Z 5 ((Si, Al, Ti) 8 O 22) (OH, F, Cl, O) 2. En esta fórmula, A puede ser Ca, Na, K, Pb o blanco; X es igual a Li, Na, Mg, Fe, Mn o Ca; y Z es Li, Na, Mg, Fe, Mn, Zn, Co, Ni, Al, Cr, Mn, V, Ti o Zr. Las sustituciones crean una amplia variedad de colores como verde, negro, incoloro, blanco, amarillo, azul o marrón. Los cristales de anfíbol también pueden incluir iones hidróxido (OH —), que se produce a partir de una interacción entre los minerales en crecimiento y el agua disuelta en el magma.
Silicatos en lámina


Los silicatos en láminas se construyen a partir de tetraedros que comparten los tres oxígenos de sus esquinas inferiores, formando así láminas de tetraedros con sus esquinas superiores disponibles para unirse con otros átomos. Las micas y arcillas son tipos comunes de silicatos laminares, también conocidos como filosilicatos. Los minerales de mica generalmente se encuentran en rocas ígneas y metamórficas, mientras que los minerales arcillosos se encuentran con mayor frecuencia en rocas sedimentarias. Dos micas frecuentemente encontradas son biotita de color oscuro, frecuentemente encontrada en granito, y moscovita de color claro, que se encuentra en la roca metamórfica llamada esquisto.

Químicamente, los silicatos laminares suelen contener silicio y oxígeno en una proporción 2:5 (Si 4 O 10). Las micas contienen principalmente sílice, aluminio y potasio. La mica biotita tiene más hierro y magnesio y se considera un mineral de silicato ferromagnesiano. Las micas moscovita pertenecen a los minerales de silicato félsico. El félsico es una contracción formada a partir del feldespato, el mineral dominante en las rocas félsicas.


La ilustración de la estructura cristalina de la mica muestra los átomos de O de esquina unidos con átomos de K, Al, Mg, Fe y Si, formando láminas polimerizadas de tetraedros enlazados, con una capa octaédrica de Fe, Mg o Al, entre ellos. Los iones de potasio amarillos forman enlaces Van der Waals (atracción y repulsión entre átomos, moléculas y superficies) y mantienen las láminas juntas. Los enlaces de Van der Waals difieren de los enlaces covalentes e iónicos, y existen aquí entre los sándwiches, manteniéndolos juntos en una pila de sándwiches. Los enlaces de Van der Waals son débiles en comparación con los enlaces dentro de las láminas, permitiendo que los sándwiches se separen a lo largo de las capas de potasio. Esto le da a la mica su característica propiedad de escindirse fácilmente en láminas.

Los minerales arcillosos se presentan en sedimentos formados por la meteorización de rocas y son otra familia de minerales de silicato con una estructura laminar tetraédrica. Los minerales arcillosos forman una familia compleja y son un componente importante de muchas rocas sedimentarias. Otros silicatos laminares incluyen serpentina y clorito, que se encuentran en rocas metamórficas.
Los minerales arcillosos están compuestos por silicatos de aluminio hidratados. Un tipo de arcilla, la caolinita, tiene una estructura como un sándwich de cara abierta, siendo el pan una sola capa de tetraedros de silicio-oxígeno y una capa de aluminio como extensión en una configuración octaédrica con los oxígenos superiores de las láminas.
Silicatos de Marco
 CC BY-SA 4.0], via Wikimedia Commons" width="362px" height="308px" src="https://geo.libretexts.org/@api/deki...il-300x255.jpg">
CC BY-SA 4.0], via Wikimedia Commons" width="362px" height="308px" src="https://geo.libretexts.org/@api/deki...il-300x255.jpg">
El cuarzo y el feldespato son los dos minerales más abundantes en la corteza continental. De hecho, el feldespato en sí mismo es el mineral más abundante en la corteza terrestre. Hay dos tipos de feldespato, uno que contiene potasio y abundante en rocas félsicas de la corteza continental, y el otro con sodio y calcio abundantes en las rocas máficas de la corteza oceánica. Junto con el cuarzo, estos minerales se clasifican como silicatos marco. Se construyen con un marco tridimensional de tetraedros de sílice en el que los cuatro oxígenos de esquina se comparten con tetraedros adyacentes. Dentro de estos marcos en el feldespato se encuentran agujeros y espacios en los que pueden encajar otros iones como el aluminio, el potasio, el sodio y el calcio dando lugar a una variedad de composiciones minerales y nombres minerales. Por lo general, se encuentran en rocas ígneas, como granito, riolita y basalto, así como rocas metamórficas y rocas sedimentarias detríticas. Las rocas sedimentarias detríticas están compuestas por partículas de roca mecánicamente erosionadas, como arena y grava. El cuarzo es especialmente abundante en rocas sedimentarias detríticas debido a que es muy resistente a la desintegración por la intemperie.
 CC BY-SA 4.0], via Wikimedia Commons" width="361px" height="241px" src="https://geo.libretexts.org/@api/deki...-1-300x200.jpg">
CC BY-SA 4.0], via Wikimedia Commons" width="361px" height="241px" src="https://geo.libretexts.org/@api/deki...-1-300x200.jpg">
El cuarzo está compuesto por sílice pura, SiO 2 con los tetraedros dispuestos en un marco tridimensional. Las impurezas constituidas por átomos dentro de este marco dan lugar a muchas variedades de cuarzo entre las que se encuentran piedras preciosas como la amatista, el cuarzo rosa y el citrino. Los feldespatos son principalmente sílice con aluminio, potasio, sodio y calcio. El feldespato ortoclasa (KalSi 3 O 8), también llamado feldespato de potasio o espato K, está hecho de sílice, aluminio y potasio. El cuarzo y el feldespato ortoclasa son minerales félsicos. Félsico es el término compositivo aplicado a minerales ígneos continentales y rocas que contienen abundancia de feldespato ortoclasa. Otro feldespato es la plagioclasa con la fórmula (Ca, Na) AlSi 3 O 8, la solución sólida (Ca, Na) indica una serie de minerales, un extremo de la serie con calcio CaAl 2 Si 2 O 8, llamado anortita, y el otro extremo con NaAlSi 3 O de sodio 8, llamado albita. Observe cómo el mineral acomoda la sustitución de Ca ++ y Na +. Los minerales en esta serie de soluciones sólidas tienen diferentes nombres minerales.

Tenga en cuenta que el aluminio, que tiene un tamaño iónico similar al silicio, puede sustituir al silicio dentro de los tetraedros (ver figura). Debido a que los iones potasio son mucho más grandes que los iones sodio y calcio, que son muy similares en tamaño, la incapacidad de la red cristalina para acomodar tanto el potasio como el sodio/calcio da lugar a las dos familias de feldespato: ortoclasa y plagioclasa respectivamente. Los silicatos de entramado se denominan tectosilicatos e incluyen feldespatoides y zeolitas ricos en metales alcalinos.


